欧盟草药和我国中药注册法规体系比较研究
2013-03-16李秦川陈永法潘勤
李秦川陈永法潘勤
(1中国药科大学,江苏 南京 211198;2天津中新药业研究中心,天津 300457)
欧盟草药和我国中药注册法规体系比较研究
李秦川1陈永法1潘勤2
(1中国药科大学,江苏 南京 211198;2天津中新药业研究中心,天津 300457)
本文通过对欧盟草药和我国中药注册法规体系的介绍,阐明现有完整的欧盟草药注册法规体系,分析中欧双方注册法规体系产生差异的原因,为中药更好地适应欧盟草药注册法规体系起到指引作用。
欧盟草药;中药;注册法规体系
适应欧盟草药注册法规是中药顺利进入欧盟市场的关键,比较中药和欧盟草药注册法规体系将为我国中药进入欧盟市场提供参考。由于中药包括中药材、中药饮片和中成药等,其范围远远大于欧盟草药的范围,故本文的比较仅限于在中药与欧盟草药相一致的范围内进行。
1 欧盟草药注册法规体系
1.1 背景
欧盟由于其体制的独特性,草药注册法规的发展也有其独特性。欧盟各国从各自为政到成立经济共同体,草药的管理同样经历了由欧盟各国各自为政到有一个相对统一的法规作为指导的过程。欧洲对于草药的管理经历了相当长的时间,总体来说草药管理的发展与整个欧洲药品管理体系的发展是并行的[1],但草药注册法规的建立起步较晚。2004年2004/24/EC指令的颁布对欧盟草药管理具有里程碑的意义,自此草药管理在欧盟有了明确的标准,促进了欧盟对完善草药注册法规的思考。
1.2 立法进程
1.2.1 法律渊源 欧盟药品立法的法律渊源是条约、委员会立法、法院判例、欧盟内部采用的声明及决议等[2]。欧盟法律渊源引导欧盟的立法。
1.2.2 完善过程 从20世纪60年代起欧盟就开始了对草药立法的探索,欧盟草药立法从无到有,逐步规范,其完善过程见表1。
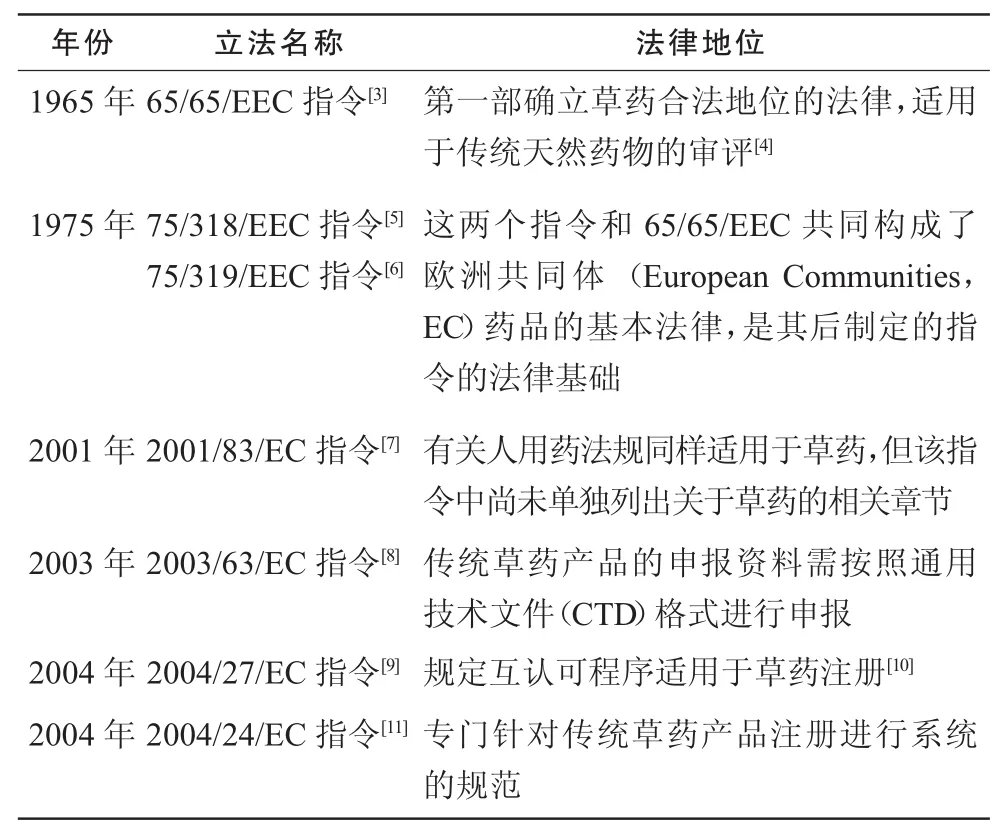
表1 欧盟草药立法的完善过程
EC早在 1965年就有对草药立法的意识,但由于当时EC各成员国之间对草药认同度不尽相同,草药质量也参差不齐,草药生产者按药品注册标准申报草药的积极性也不高,因此,按照一个统一的法律规范对草药进行管理的难度较大。
随着草药市场的扩大,1975年,EC对市场中流通的草药进行了清理,逐渐规范草药产品市场,制定一个统一的法律规范是趋势所在。2001年中国加入世界贸易组织(WTO),中药面向国际推动了欧盟草药的立法发展;同年,欧盟成立草药产品委员会(HMPC),经过对2001/83/EC指令的修订提议、咨询意见,最终,出台了2004/24/EC指令。纵观欧盟草药立法,从第一次确定草药合法地位到对草药进行单独立法历经39年。
1.2.3 欧盟 2004/24/EC指令实施情况 2010年,欧盟国家资格审查局(NCAs)根据欧盟政府授权,收集各成员国的注册数据,统计出截至2010年底简化注册指令(TUR)在欧盟各成员国的实施情况,包括各成员国的申请数量、批准的数量以及单一组分产品和复方产品所占比例等多方面信息。草药在欧盟的注册情况以及今后的发展趋势见图1,2,3[12]。
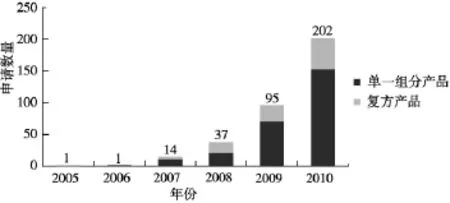
图1 2005-2010年单一组分草药产品和草药复方产品采取TUR方式申请的数量

图2 各成员国单一组分草药产品和草药复方产品采取TUR方式申请的数量
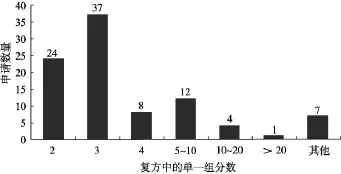
图3 草药复方产品TUR申请中含有的单一组分的数量注:其他指此类复方药物中含辅助维生素和矿物质
图1显示的是2005-2010年采取TUR方式注册的单组分草药产品和草药复方产品的数量。从图中可以看出在TUR注册数量明显上升的情况下,草药复方产品的注册数量也呈现上升趋势。由此可见,欧盟在实施TUR的过程中,各成员国对草药复方产品的认可度逐渐增加,有利于建立完善的草药注册法规体系。
图2显示的是各成员国采取TUR方式注册的单一组分草药产品和草药复方产品的数量,数据统计截至2010年12月31日。TUR申请总量为353份,草药复方产品有93份,占26.35%。其中,英国、德国、奥地利、瑞典、爱沙尼亚、匈牙利、拉脱维亚等国对草药复方的认同度较高,均有或多或少的草药复方注册申请,奥地利草药复方申请数量更是达到本国TUR申请总量的50%。选择合适的可能率先建立良好的草药注册法规体系国家作为突破点对中药进入欧盟市场具有事半功倍的效果。
截至2010年12月31日,欧盟草药复方产品TUR申请中含有的单一组分的数量如图3所示。其中,含有2种和3种组分的申请分别占25.81%和39.78%,复方中超过20种组分草药的申请只有1个,占1.08%。欧盟草药复方产品中所含组分倾向于少于10种,以2~ 3种居多,这对欧盟草药复方注册法规体系的建立有深远的影响。
1.3 法律体系
欧盟草药注册管理遵循欧盟制定的相关法律法规。条约是欧盟内的最高法律,具有类似宪法的性质。欧盟在条约的框架下制定一系列的二级法,包括约束性法律(法规、指令等)和软性法律(决议、通讯、指南等)。欧盟药品管理法规的实施细则常以指南和注意事项的形式公布[1]。
1.4 相关法规
1.4.1 法规 1965年,欧洲经济欧共体(EEC)发布了65/65/EEC指令[3],该指令是欧洲最主要的关于药品法律、法规及管理的规定,明确提出组成药品的物质可以为化学性、动物性和植物性的物质,确立了草药的合法地位[1]。
1.4.2 指令
1.4.2.1 2001/83/EC 2001年11月6日,欧盟议会和理事会正式签署2001/83/EC指令,该指令共130条,整合了以前的指令,内容丰富、全面[7],是一部关于人用药品的单独性、综合性指令。
1.4.2.2 2003/63/EC 为了节约药品审评的时间和资源,规范各个地区的注册申请,欧盟、美国和日本在2000年人用药物注册技术要求国际协调会(ICH)上达成一致意见,同意对CTD建立一套统一的格式和术语。为此,欧盟对2001/83/EC指令附录Ⅰ当中的申报资料要求进行了修订,2003/ 63/EC指令于2003年6月25日正式颁布。目前,传统草药产品欧盟注册提供的申报资料也必须要按照CTD的格式,否则,审评机构不予受理[13]。1.4.2.3 2004/27/EC 欧盟于2004年3月21日正式通过了2004/27/EC指令,该指令对2001/83/EC指令中原有的注册审批程序即互认可程序进行了修订,这为我国中药进入欧盟市场提供了新的契机[13]。1.4.2.4 2004/24/EC 2004年4月30日,欧盟议会和理事会颁布实施了2004/24/EC指令,该指令主要就传统草药注册的相关问题对 2001/83/EC指令进行了修订,系欧盟首次针对传统草药制订的法令,对统一、规范传统草药在欧盟的注册管理,促进传统草药在欧盟的发展具有重要意义[13]。
1.4.3 指南 2006-2008年,欧洲药品管理局(EMA)陆续出台了多个有关欧盟草药的指南性文件,如 Guideline on the Non-clinical Development of Fixed Combinations of Medicine Products、Guideline on the Clinical Assessment of Fixed Combinations of Herbal Substances等。自2004年TUR实施以来,欧盟对草药的注册日益关注,通过发布指南性文件细化草药的注册要求,同时也为今后草药注册法规体系的完善奠定基础。
2 中药注册法规体系
2.1 背景
2007年7月10日国家食品药品监督管理局(SFDA)发布了新修订的《药品注册管理办法》,确立了科学监管理念统领药品注册工作的指导思想,但新办法中对中药的具体规定尚没有完全明确,需要进一步解释和说明具体条款的内涵和技术要求。因此,SFDA在修订《药品注册管理办法》的同时,着手起草《中药注册管理补充规定》。补充规定共22条,包括了中药注册宏观管理的总体要求、鼓励中药研发创新、注重中药生产过程和指标控制、科学合理制定更改剂型的技术要求等内容,进一步保证中药产品质量。
2.2 立法进程
自1985年首部《中华人民共和国药品管理法》颁布实施以来,我国建立了较为规范的新药审评体制,并在之后不断地对药品监督管理法律体系进行完善。其中,针对中药注册的法规也不断进行改革,以适应新形势的要求。
1987年,《新药审批办法》对其中有关中药的部分作了补充规定和说明;1992年,卫生部颁发《关于药品审批管理若干问题的通知》,再次对有关中药的部分进行了修订和补充规定,使中药新药的管理更为科学、全面,并推动了基础研究深人开展。1999年修订的《新药审批办法》对中药新药审批管理进一步加强。中药审评要求从无到有、逐步提高,并在之后进一步规范。
2007年,针对药品注册中暴露出的问题,对2005年版的《药品注册管理办法》再次修订,并在之后颁布实施了《中药注册管理补充规定》等配套法规和指导原则,中药注册体系基本形成[14]。
药品注册管理法规的体系改革(见表2)带动了中药的立法进程,使中药立法逐渐从药品注册法规中分离,根据中药的综合性、伦理性、科技性和预见性单独进行立法。
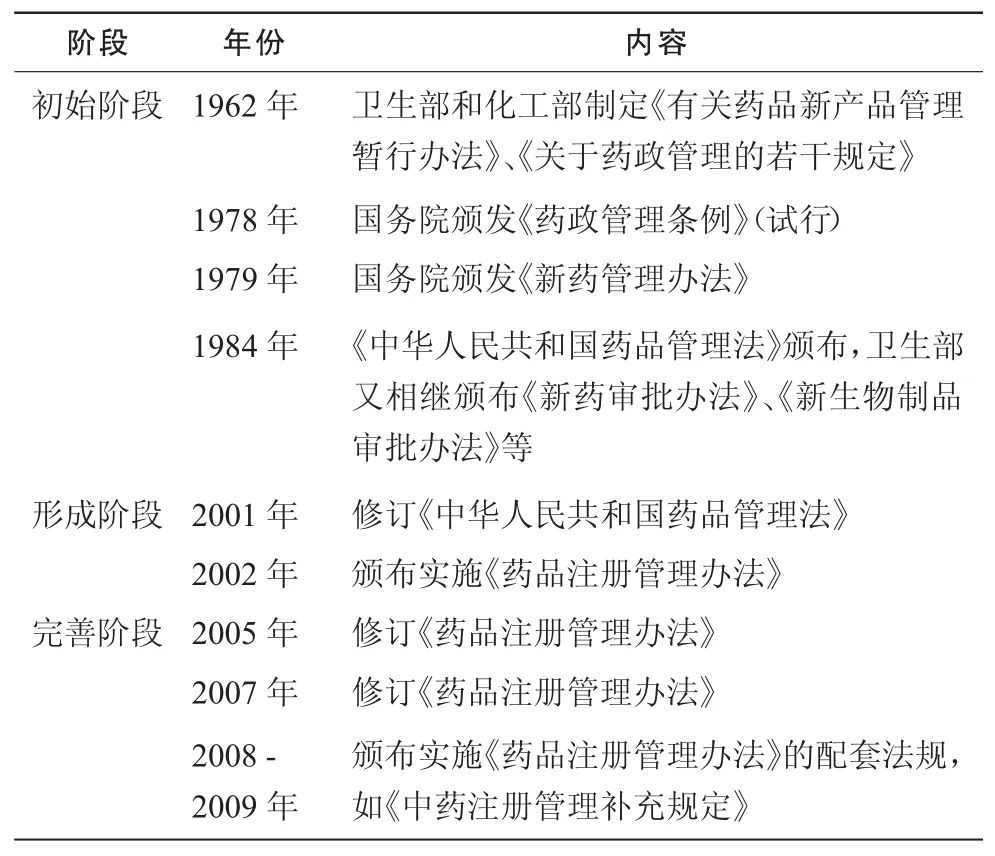
表2 药品注册管理法规体系改革历程
2.3 法律体系
中药的立法遵循中国法律体系,涉及多个部门。中药立法应当遵循我国法律位阶原则,任何法律法规不能与宪法相违背。如《中药注册补充规定》属于部门规章,《中华人民共和国药品管理法》属于法律,当两者发生冲突时,应当优先适用高位阶的法律。
2.4 相关法规
我国药品注册管理法规体系在经历了不断的补充、修订后,建立了较为完善的制度体系,药品注册管理法规也逐步转变为现在具备一定科学性和系统性的模式,中药的注册管理法规也在逐渐完善。我国当前的药品注册管理法规体系可分解为国家法律、行政法规、部门规章、部门规范性文件、技术要求和指导原则等层面,具体见表3。

表3 当前我国药品注册管理法规体系的构成[14]
3 中欧法律体系产生差异的原因
3.1 文化背景
欧盟是由多个国家组成的共同体,文化元素多元化是欧盟制定法律法规应当考虑的重要因素之一。在立法过程中努力寻找文化多样性和统一性的平衡点。
中药法律法规的制定始终有一条主线贯穿其中,以中医理论为基础[15],遵循儒家和道家的哲学体系和中医的阴阳五行学说[16]。中药法律体系的建立吸收了中药文化重宏观、重归纳,辨证论治的中医药理念,在统一的基础上发展与完善。
3.2 政治体制
欧盟的政治体制因其独特性影响着草药注册法规在欧盟的发展。二战后,欧洲各国意图建立统一的欧洲实现共同发展的愿望[17]。因此,欧洲各国与中国一般以国家本位为政治基础不同,欧盟议会对草药在欧盟的发展有重大影响。欧盟议会左派对中医药有认同感,对中医药在欧盟发展提供了良好的支持力量[18],促进了草药注册法规的制定、完善与实施。
我国是共产党领导、各民主党派共同发展的国家,区别于欧盟的多个政治派系,因此易于达到各利益方之间的平衡。同时,中国各党派大多数都接受中医药理论,接受中药用药,这也促进了中药注册法规的发展。
3.3 司法体制
欧盟草药法律法规的制定、实施与完善受英美法系和大陆法系两大法系的影响,因此,在制定法律时需要考虑两大法系的特点,不能有失偏颇。中国在移植大陆法系的基础上建立了具有中国特色的社会主义法系,社会主义法系在某些方面仍然沿用大陆法系的思想,但其本质上已经产生了较大的改变。中药的立法即遵循社会主义法系。
社会主义法系和大陆法系有相通之处,中药进入欧盟可以以大陆法系国家为切入口,从国别选择上,可以首先从德国开始,因德国在欧盟中占有领导地位且德国民众对中药持比较宽容和接受的态度,有良好的社会基础[18]。中药在欧盟立法也可以合理利用英国作为判例法国家的优势,判例法具有开放性和快捷性。如果能够在英国成功进行中药的注册,有此案例作为依据,对在英国立法成功大有帮助,其他国家的立法也能以此为依据。中药还可以在欧盟层面上通过欧盟议会对各成员国进行立法,可操作性强[20];同时还可以尽可能多地让欧盟议会等立法机构吸纳中药在中国的立法思想。
4 结语
无论是中药注册法规体系还是欧盟草药注册法规体系,其建立的价值取向都是相同的,都是力图完善注册规范,促进产品注册的标准化。但由于文化背景、政治体制、司法体制等方面的差异,这两种注册法规体系不尽相同。欧盟政治派别较多,文化冲突较为明显,需要在实践中逐渐接受中药的理念,因此其草药注册法规体系的建立起步较晚,也相对缓慢。
如今欧盟当局意图通过多方协商、征询多方意见建立完善的欧盟草药注册法规体系。因此,我国应抓住契机,加强欧盟对中医药理念的认同,阐述中药注册法规体系的构建思想,为其提供思路和参考,促进欧盟草药注册法规体系的建立,为中药早日进入欧盟市场提供法律支持。
[1] 苏刚强,李伯刚.欧盟草药药品注册指南[M].北京:人民卫生出版社,2005.
[2] Cooke E.欧盟对药品管理的立法以及药监法规的法律背景[R/OL].[2012-01-12].http://wenku.baidu.com/view/a8ecde5e804 d2b160b4ec0c3.html.
[3] Council of the European Economic Community.Council Directive of 26 January 1965 on the approximation of provisions laid down by law,regulation or administrative action relating to medicinal products(65/65/EEC)[S].[2013-06-13].http://eur-lex.europa. eu/LexUriServ/LexUriServ.do?uri=DD:I:1965-1966:31965L0065:EN:PDF.
[4] 刘平羽,陈永法.欧盟药物审评程序及要求[J].上海医药,2004,25(8):350-352.
[5] Council of the European Economic Community.Council Directive of 20 May 1975 on the approximation of the laws of Member States relating to analytical,pharmaco-toxicological and clinical standards and protocols in respect of the testing of proprietary medicinal products(75/318/EEC)[S].[2013-06-13].http://eur-lex.europa. eu/LexUriServ/LexUriServ.do?uri=OJ:L:1975:147:0001:0012:EN:PDF.
[6] European Medicines Agency.Second Council Directive 75/319/ EEC of 20 May 1975 on the approximation of provisions laid down by Law,Regulation or Administrative Action relating to proprietary medicinal products[S].[2013-06-13].http://eur-lex.europa.eu/ LexUriServ/LexUriServ.do?uri=CELEX:31975L0319:EN:HTML.
[7] European Medicines Agency.Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use[S]. [2013-06-13].http://eur-lex.europa.eu/LexUriServ/LexUriServ.do? uri=CELEX:32001L0083:EN:HTML.
[8] European Medicines Agency.Commission Directive 2003/63/EC of 25 June 2003 amending Directive 2001/83/EC of the EuropeanParliament and of the Council on the Community code relating to medicinal products for human use(Text with EEA relevance)[S]. [2013-06-13].http://eur-lex.europa.eu/LexUriServ/LexUriServ.do? uri=OJ:L:2003:159:0046:0094:EN:PDF.
[9] European Medicines Agency.Directive 2004/27/EC of the European Parliament and of the Council of 31 March 2004 amending Directive 2001/83/EC on the Community code relating to medicinal products for human use(Text with EEA relevance)[S].[2013-06-13].http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2004:136:0034:0057:EN:PDF.
[10] 郑永锋.欧洲草药药品管理相关指令评析[J].中国中医药信息杂志,2006,13(3):1-5.
[11] European Medicines Agency.Directive 2004/24/EC of the European Parliament and of the Council of 31 March 2004 amending,as regards traditionalherbalmedicinalproducts,Directive 2001/83/EC on the Community code relating to medicinal products for human use[S].[2013-06-13].http://eur-lex.europa.eu/Lex-UriServ/LexUriServ.do?uri=OJ:L:2004:136:0085:0090:EN:PDF.
[12] European Medicines Agency.Uptake of the traditional use registration scheme and implementation of the provisions of Directive 2004/24/EC in EU Member States[R].[2012-01-12].http://www. ema.europa.eu/docs/en_GB/document_library/Report/2011/05/ WC500106706.pdf.
[13] 张跃.中成药欧盟注册的研究[D].哈尔滨:黑龙江中医药大学,2010.
[14] 张晓东,李连达.我国药品注册管理法规体系的形成及现状思考[J].中国新药与临床杂志,2010,29(2):155-158.
[15] 李金良.中药产品国际化的文化传播战略[J].中国软科学,2009(1):48-55.
[16] Kayne SB.Traditional Medicine:a global perspective[M].London:Pharmaceutical Press,2010.
[17] 张松涛.论欧洲统一的宪法化进程及其对我国的借鉴[D].上海:上海财经大学,2005.
[18] 黄建银.中医药进入欧盟的途径和方法的思考与建议[J].中国当代医药,2010,17(1):7-8.
The Comparison Study on the Registration Systems of Laws and Regulations of Herbal Medicine in European Union and Traditional Chinese Medicine in China
Li Qinchuan1,Chen Yongfa1,Pan Qin2(1 China Pharmaceutical University,Jiangsu Nanjing 211198,China;2 The Research Center of Tianjin Zhongxin Pharmaceutical,Tianjin 300457)
The registration systems of laws and regulations of herbal medicine in European Union and traditional Chinese medicine in China were introduced in this paper.The integrated registration system of laws and regulations in European Union was described,and the causes of differences between the registration systems of European Union and China were analyzed so as to provide a guidance for the better adaption to the registration system of laws and regulations of herbal medicine in European Union.
Herbal Medicine in European Union;Traditional Chinese Medicine;Registration System of Laws and Regulations
10.3969/j.issn.1672-5433.2013.07.013
2012-03-07)
李秦川,女,硕士。研究方向:医药政策法规。E-mail:linda_wind617@hotmail.com
陈永法,男,博士。研究方向:国外药事法规。通讯作者E-mail:cyf990@163.com
