饲喂果葡糖浆对意大利蜜蜂蜂群的影响
2013-02-22王文祥刘亭亭吴小波
王文祥,刘亭亭,吴小波 ,张 飞
(江西农业大学 蜜蜂研究所,江西 南昌 330045)
意大利蜜蜂(Apis mellifera ligustica.)简称意蜂,在分类学上属膜翅目(Hymenoptera)蜜蜂科(Apidae)蜜蜂属(Apis),是世界上优势最大的一个蜂种,于20 世纪初引入我国。因其能够促进农作物授粉,具有较强的产蜜、产浆能力,已在我国大部分地区进行饲养,并成为本地的当家品种[1]。
蜜蜂在自然条件下,通常可以从外界获取营养食物,其中植物中的花蜜和花粉是蜜蜂的主要食物。然而,在受蜜源缺乏、恶劣气候等因素的影响时,蜂群采不到足够的花蜜和花粉,就需要人工补喂糖饲料和蛋白饲料,以保证蜜蜂正常生活。刘俊峰等人研究了蜜蜂早春外界缺少花粉和花蜜时蛋白饲料的需要[2-3]。目前对蜜蜂的糖饲料饲喂主要以白砂糖为主,对糖饲料的代替品研究较少。近年来,随着白砂糖价格的一路上扬,不少蜂农开始用果葡糖浆代替白砂糖饲喂蜂群。
果葡糖浆,也称高果糖浆(high fructose syrup)或异构糖浆,是以酶法转化淀粉所得的糖化液经葡萄糖异构酶的异构作用,将其中一部分葡萄糖异构成果糖,由葡萄糖和果糖组成的一种混合糖糖浆[4]。现在市场上主要是F42 和F55 两个品种,因其甜度与白砂糖相近,所以被蜂农用来饲喂蜂群。目前,对果葡糖浆作为蜜蜂糖饲料的安全问题还存在着不少争议。据沈育初等[5]报道,认为果葡糖浆可以替代白砂糖饲喂蜂群;而陈渊等[6]认为用果葡糖浆作蜜蜂越冬饲料得不偿失。正是鉴于此。本实验拟研究饲喂果葡糖浆对蜂群育王及工蜂抗氧化酶基因的表达量的影响,探讨果葡糖浆作为蜜蜂糖饲料的可行性,为蜜蜂饲料研究提供理论依据。
1 材料和方法
1.1 实验材料
1.1.1 供试昆虫 江西农业大学蜜蜂研究所饲养的意大利蜜蜂。
1.1.2 实验时间和地点 2011 年3 月—2011 年11 月,江西农业大学蜜蜂研究所。
1.1.3 实验用糖 白砂糖(广西华盛集团露塘糖业有限责任公司糖厂,一级);果葡糖浆(江西天禾糖业发展有限公司,F42)。
1.1.4 试剂及仪器 总RNA 提取试剂盒Trizol,RNA 酶抑制剂购自全式金公司;琼脂糖购自Promega公司;DNA marker DL2000,M-MLV 反转录酶及SYBR GreenⅡ荧光定量试剂购自TaKaRa 公司。离心机(飞鸽KA-1000 型,上海安亭科学仪器厂),台式冷冻离心机(Eppendorf 5810R),移液器(Eppendorf),PCR 仪(eppendorf mastercycler personal),Real-Time PCR System (Bio-Rad 公司)。
1.2 实验方法
1.2.1 蜂群饲养管理 选用群势一致的健康意大利蜜蜂10 群,随机分为2 组,每组5 群。其中处理组饲喂果葡糖浆(treatment),对照组饲喂白砂糖(control)。试验期间,外界缺少蜜源,定期检查蜂群并进行饲喂,以保证蜂群内有充足的食物,其它饲养条件(如自由采水、防病等)也调整一致。饲喂果葡糖浆两个月后,进行育王和工蜂样品采集。
1.2.2 饲喂果葡糖浆对蜂群育王质量的影响 另选一群健康的蜂群作为供虫源,移取刚孵化的1 日龄工蜂幼虫到王台,并分别插入到两组实验蜂群中,3 d 后取浆。统计移虫台数和接受台数,接受台数除以移虫台数为王台接受率;用分析天平称量王浆重量,记录单个王台的产浆量。
另外,从供虫源中移取刚孵化的幼虫到育王框中,分别放入到两组实验蜂群中进行育王,等到蜂王出房前1 d,将产浆条放入恒温恒湿箱中进行培养(35 ℃,RH 75%),待蜂王出房后,每组选取30 只,用分析天平测量处女蜂王体质量。
1.2.3 饲喂果葡糖浆对意大利蜜蜂工蜂Cu-Zn SOD、CAT 基因mRNA 表达量的影响 (1)蜜蜂样品采集。分别从两组实验群中选取即将出房的封盖子脾,放入恒温培养箱(35 ℃,RH 75%),待工蜂出房后,在其胸部背侧进行颜色标记,并放回原群。分别采集1 日龄、10 日龄及30 日龄蜜蜂样品。每群蜂取30 只蜜蜂,随机取4 只蜜蜂的头部,混合,作为1 个样品用于抗氧化酶基因mRNA 表达量的检测,每个样品3 个重复。取样后蜜蜂样品立即放入液氮速冻,随后放入-80 ℃保存,用于提取总RNA。
(2)RNA 的提取和cDNA 第一链的合成。用Trizol 试剂盒进行工蜂样品的RNA 提取。所有操作均按照试剂盒说明书进行,RNA 最后溶于30 μL RNA-free 的dH2O 中,经琼脂糖凝胶电泳和紫外分光光度计检测后,-80 ℃保存。用反转录试剂盒对总RNA 进行反转录,反应体系为50 μL:8 μL 总RNA,10 μL Buffer,8 μL dNTP,1.5 μL M - MLV,3 μL Oligo dT,1 μL RNA 酶 Inhibitor,18.5 μL DEPC 水。反转录反应条件如下:体系混匀后,42 ℃反应60 min,75 ℃灭活5 min。反转录产物保存于-80 ℃。
(3)实时荧光定量PCR。所有引物均按照SYBR premix Ex TaqTM 试剂盒要求,参照GenBank 上已发表的序列,采用 DNAMAN 5.0 设计引物(跨内含子),引物序列见表1。qRT - PCR 反应体系为20 μL:4 μL 反转录产物,目的基因上游和下游引物各 0.4 μL,5.2 μL H2O,10 μL SYBR GreenⅡ;PCR扩增程序:94 ℃预变性 3 min,94 ℃ 30 s,62 ℃ 30 s,72 ℃ 40 s,40 个循环,72 ℃ 10 min;最后以每5 s 上升0.5 ℃的速度从61 ℃到95 ℃记录熔解曲线,每个反转录样品重复3 次。使用仪器为 Bio -Rad 公司 iCycler iQ。反应结束后收集目的基因与内参基因的Ct 值,每个PCR 反应的扩增效率用qpcR,R 来计算[7]。
基因的相对表达量用以下公式计算:

(1)式中E 是PCR 扩增效率;Ct 是循环阈值;i 是第i 个内参基因;n 是内参基因数量;r 是目的基因的相对表达量。

表1 Cu-Zn SOD,CAT 和β-actin 基因扩增产物Tab.1 Oligo-nucleotide primer pairs used in the amplification of Cu-ZnSOD,CAT and β-actin genes
1.3 数据统计分析
试验数据采用StatView 5.0 的ANOVA and t -test 进行统计分析,各处理平均数间用ANOVA 或ANCOVA 进行差异显著性比较及相关分析。
2 结果与分析
2.1 饲喂果葡糖浆对意大利蜜蜂王台接受率及王台中王浆量的影响

表2 饲喂果葡糖浆对对意大利蜜蜂产浆量及王台接受率的影响Tab.2 The effect of high fructose syrup diet on production of royal jelly and the acceptance rate of queen cells of Apis mellifera L.
如表2 所示,从单个王台产浆量来看,饲喂果葡糖浆的处理组和饲喂白砂糖的对照组差异不显著。在王台接受率方面,处理组和对照组之间差异也不显著。
2.2 饲喂果葡糖浆对意大利蜜蜂处女蜂王初生体质量的影响
由图1 可知,在其它外界条件相同的情况下,饲喂果葡糖浆的意大利蜜蜂蜂群所培育的蜂王与对照组蜂群所培育的蜂王在初生体质量方面差异不显著。

图1 饲喂果葡糖浆对意大利蜜蜂蜂王初生体质量的影响Fig.1 The effect of high fructose syrup diet on emergence weight of queen of Apis mellifera L.
2.3 饲喂果葡糖浆对意大利蜜蜂Cu-Zn SOD、CAT 基因 mRNA 表达量影响
从图2 和图3 可知,Cu-Zn SOD 和CAT 这两个抗氧化酶基因在意大利蜜蜂3个不同日龄工蜂头部中均有表达,而且各个时期Cu-Zn SOD mRNA 的表达量均高于内参基因(r >0),而CAT mRNA 的表达量均低于内参基因(r <0)。但是,在工蜂的3 个日龄中,处理组蜜蜂头部Cu-Zn SOD、CAT 基因mRNA 的表达量和对照组之间差异不显著。

图2 意大利蜜蜂不同发育时期CuZnSOD mRNA 表达量Fig.2 Cu-Zn SOD mRNA expression level in Apis mellifera L.at different development stages
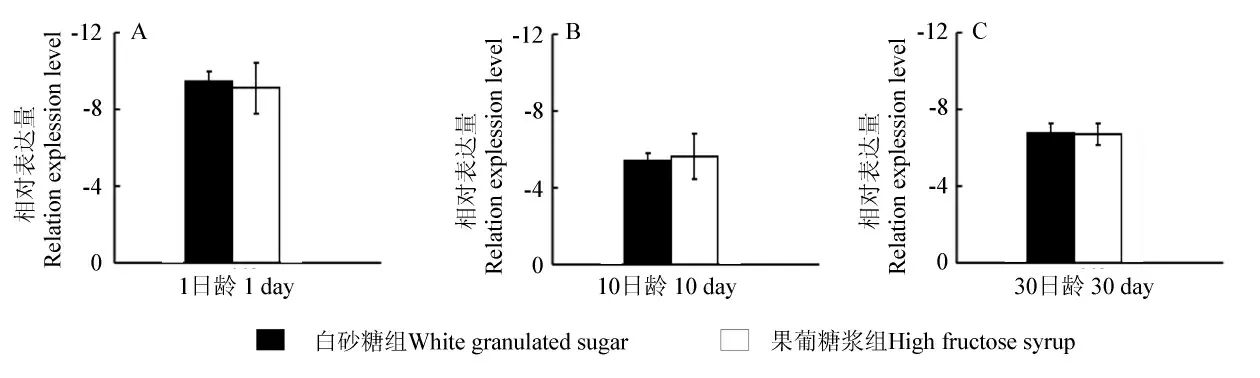
图3 意大利蜜蜂不同发育时期CAT mRNA 表达量Fig.3 CAT mRNA expression level in Apis mellifera L.at different development stages
3 讨 论
3.1 饲喂果葡糖浆对意大利蜜蜂王台浆量及王台接受率的影响
蜂群产浆量和王台接受率与蜂王的品种、蜂群的管理、外界气候、蜜粉源、蜂群群势和饲养营养水平等因素有关。方文富等研究发现蜂王浆的产量与蜂王的品种、移入王台内幼虫的大小等有一定的关系[8-9]。Mouro[10]、Sahinler 等[11]报道蜂群产浆量和王台接受率与季节和蜜蜂基因型相关。王改英[12]、罗建能等[13]研究表明饲粮蛋白水平与蜂群王浆产量和王台接受率密切相关。本研究在其它条件相同的情况下,分别饲喂果葡糖浆和白砂糖,检测其对王台浆量和王台接受率的影响。结果表明:使用果葡糖浆代替白砂糖饲喂蜂群对单个王台产浆量和王台接受率无显著差异。这可能是因为果葡糖浆作为糖饲料,其能量效价与白砂糖相近,在蜜蜂体内除了提供蜜蜂发育和维持日常采集活动所需的能量外,并不对器官(例如:咽下腺)的形成和发育造成不良影响。
3.2 饲喂果葡糖浆对意大利蜜蜂蜂王初生质量的影响
蜂王初生体质量与卵巢管的发育程度和卵小管的数目成正相关,初生体质量大的蜂王,具有较强的产卵能力[14]。因此,蜂王的初生体质量是衡量蜂王品质优劣的重要标志。据报道,蜂王的初生体质量与季节、蜜源、降水量、群势等有着密切的相关性[15]。在其它条件都相同的情况下,蜂王初生体质量与哺育蜂分泌的蜂王浆的质量密切相关。本研究发现:饲喂果葡糖浆的蜂群和饲喂白砂糖蜂群所培育的蜂王的初生体质量差异不显著。这可能是因为饲喂果葡糖浆与饲喂白砂糖对哺育蜂所分泌的王浆组分影响不大所致,是否如此,有待进一步研究与论证。
3.3 饲喂果葡糖浆对意大利蜜蜂Cu-Zn SOD、CAT 基因mRNA 表达量影响
在有氧条件下,动物机体的正常代谢过程中会产生大量的氧自由基,过多的自由基如果不能及时被清除,将会攻击各种生物大分子,引起一系列氧化损伤,进而导致生物体衰老和病变。正常情况下,细胞内的自由基处于动态平衡状态,不会引起伤害,这是因为细胞内存在着自由基清除系统,该系统主要是通过有关的抗氧化酶清除机体内的自由基[16]。本研究结果表明,三个不同发育时期,Cu-Zn SOD、CAT基因在蜜蜂头部均有表达,其中Cu-Zn SOD 基因在三个时期的mRNA 表达量均高于内参基因(r >0),而CAT mRNA 的表达量均低于内参基因(r <0)。与饲喂白砂糖相比,饲喂果葡糖浆对同日龄工蜂抗氧化酶基因Cu-Zn SOD、CAT mRNA 的表达量无显著影响。这可能是因为果葡糖浆与白砂糖(蔗糖)水解后的成分相近,在蜜蜂机体内有着和白砂糖相似的代谢途径,蜜蜂食用果葡糖浆后,可能不会对其形成应激。另外,随着日龄的增加,两组实验组的工蜂Cu -Zn SOD 基因mRNA 的表达量也随之增加,其表达量在30 日龄时,达到最大值。这可能与工蜂的劳动强度与所处环境有关。蜂群内工蜂按日龄分工,随着日龄的增长,工蜂的劳动强度也不断加大。而且,工蜂由内勤蜂转变为采集蜂,她们所处的环境由原来相对稳定的蜂箱内环境转换成充满不定因素的外界自然环境,从而使Cu -Zn SOD 基因表达量增加。另外,CAT 基因mRNA 的表达量,则出现先增加,后降低的趋势,其表达量在10 日龄时,达到最大值。这可能是因为10 日龄工蜂分泌蜂王浆,饲喂小幼虫和蜂王,导致其头部代谢比较旺盛,CAT 的活性较高。本研究结果与肖培新等[17]的报道不同,可能与所采蜜蜂样品发育时期和提取RNA 的器官和组织不同有关[18],这也有待于进一步研究与分析。
致谢:在本实验得到了黄强、曾珍秀、韩旭和田柳青的帮助,在此表示感谢。
[1]曾志将.养蜂学[M].2 版.北京:中国农业出版社,2009:13-15.
[2]刘俊峰,吴小波,颜伟玉,等.饲粮蛋白质水平对中华蜜蜂春繁性能及幼虫抗氧化性能的影响[J].江西农业大学学报,2011,33(5):960-964.
[3]刘俊峰,刘光楠,颜伟玉,等.三种人工饲料对中华蜜蜂春繁的影响[J].江西农业大学学报,2011,33(1):137-140.
[4]杨海军.果葡糖浆的特性及应用[J].食品科学,2002,23(2):154-156.
[5]沈育初.白砂糖的最佳代用品——淀粉糖[J].蜜蜂杂志,2006,26(6):41.
[6]陈渊.用果葡糖浆作越冬饲料得不偿失[J].蜜蜂杂志,2011,31(2):31.
[7]Qiang H,Kryger P,Le Conte Y,et al.Survival and immune response of drones of a Nosemosis tolerant honey bee strain towards N.ceranae infections[J].Journal of Invertebrate Pathology,2012(01).
[8]方文富,胡彦鹏.萧山浆蜂与本地意蜂产浆性能的对比研究[J].中国养蜂,2002,53(4):7-9.
[9]方文富,国占宝.意蜂采用2,3 日龄工蜂幼虫产浆的研究[J].中国养蜂,2000,51(4):4-6.
[10]Mouro G F,Toledo V A A.Evaluation of Apis mellifera Carniolan and Africanized honey bees in royal jelly production[J].Brazilian Archives of Biology and Technology,2004,47(3):469-476.
[11]Sahinler N,Kaftanoglu O.The effects of season and honeybee (Apis mellifera L.)genotype on accaptance rates and royal jelly production[J].Türk Vet ve Hay Derg,2005,29:499-503.
[12]王改英,吴在富,杨维仁,等.饲粮蛋白质水平对意大利蜜蜂咽下腺发育及产浆量的影响[J].动物营养学报,2011,23(7):1147-1152.
[13]罗建能,沈生初,金汤东.蜜蜂蛋白质饲料对工蜂初生重和蜂王浆生产的影响研究[J].浙江畜牧兽医,2009,34(5):5-6.
[14]谢代癸.对蜂王初生体重与质量的研究[J].中国养蜂,1983,34(2):13-14.
[15]毕建璐,李志勇.不同季节培育蜂王初生重比较分析[J].蜜蜂杂志,2003,23(11):5-6.
[16]Atsushi K,Akira S.Critical amino acids in human DNA polymerases л and к involved in erroneous incorporation of oxidized nucleotide[J].Nucleic Acids Research,2010,38(3):859-867.
[17]肖培新,吴在富,刘昭华,等.意大利工蜂不同发育时期抗氧化酶基因mRNA 表达量的变化[J].昆虫学报,2010,53(11):1202-1206.
[18]张克烽,张子平,陈芸,等.动物抗氧化系统中主要抗氧化酶基因的研究进展[J].动物学杂志,2007,42(2):153-160.
