一株纳豆芽孢杆菌的产酶条件优化
2013-02-13吴庆红陈义伦
李 妍,吴庆红,陈义伦,*,周 波*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.泰山学院附属中学,山东 泰安 271018;3.土肥资源高效利用国家工程实验室,山东农业大学生命科学学院,山东 泰安 271018)
血栓病威胁着人类的健康与生命,溶解血栓是治疗这类疾病的首选方法;当前的溶栓剂,如尿激酶、链激酶、重组组织型纤溶酶原激活剂等,存在半衰期短、副作用大、价格昂贵等缺点[1-3]。纳豆激酶(nattokinase,NK)是一种在纳豆发酵过程中由纳豆菌(Baciuus natto)或纳豆枯草杆菌(B.subtilis natto)产生的丝氨酸蛋白酶[4-5],研究表明[6-8]纳豆激酶成本低廉,作用迅速,药效时间长,安全性好,具有很强的纤溶活性,不但能直接作用于纤溶蛋白,而且还能激活体内纤溶酶原,从而增加内源性纤溶酶的量与作用,有望称为新型的溶栓药物。响应面分析法(response surface methodology,RSM)是能通过综合实验设计和数学建模得到准确有效结论的实验设计方法[9-10],被广泛应用于各类发酵条件的优化[11-15]。
本课题组在前期的研究中筛选到一株纳豆芽孢杆菌,采用Plackett-Burman法和响应面分析法的方法对该菌产纳豆激酶的液体发酵条件进行优化,以期获得较高的纳豆激酶产量,对该酶进一步的产业化应用提供理论依据。
1 材料与方法
1.1 材料与培养基
1.1.1 材料与试剂
菌种为山东农业大学资源与环境微生物实验室保藏的纳豆芽孢杆菌。
冻干人纤维蛋白原 上海莱士血制品有限公司;凝血酶 美国Sigma公司;尿激酶 阿拉丁公司。
1.1.2 培养基
斜面培养基(g/L):胰蛋白胨10、酵母抽提物5、NaCl 10,pH7.0;种子培养基:纯牛乳100mL、葡萄糖2.5g;发酵培养基:胰蛋白胨、乳糖、Na2HPO4、NaH2PO4、CaCl2、MgSO4,pH7.0。
1.2 方法
1.2.1 粗酶液的制备
纳豆芽孢杆菌菌株经过斜面培养基活化24h后,转接到种子培养基中,30℃、180r/min培养12h,按一定的接种量接到发酵培养基中,30℃、180r/min培养56h后,取发酵液于4℃、8000r/min冷冻离心10min得到的上清液,即为粗酶液。
1.2.2 酶活力的测定方法
纳豆激酶酶活力测定采用纤维蛋白平板法[10],以尿激酶绘制标准曲线。
1.2.3 产酶条件的单因素试验
在发酵培养基的基础上选择不同的碳源、氮源以及营养盐之比进行发酵产酶[16-17],确定菌株的产酶最优培养基组成;并且在产酶最优培养基的基础上进行发酵条件的优化,包括种龄、接种量、发酵时间、培养温度、装液量。
1.2.4 Plackett-Burman筛选影响产酶的重要因素设计
实验中选用n=12的PB设计,把每个因素设计成高(+1)和低(-1)2个水平。
1.2.5 响应面优化试验
采用响应面分析法中的Box-Behnken试验设计[18-20],对PB实验筛选到的关键因子做进一步的分析,获得影响该菌发酵产酶的最优发酵条件。
1.3 数据分析
采用Design Expert统计软件分析数据。
2 结果与分析
2.1 纳豆芽孢杆菌产酶条件的优化结果
2.1.1 最适发酵培养基的优化结果
2.1.1.1 碳源对产酶的影响
采用的基础培养基(g/L)为:胰蛋白胨20.0、Na2HPO45.0、NaH2PO41.0、CaCl20.2、MgSO40.5,分别以葡萄糖、乳糖、麦芽糖、蔗糖、麸皮为碳源,添加量为10g/L,进行发酵产酶实验,研究碳源对产酶的影响,结果见图1。乳糖作为碳源时,最有利于产酶,其次是葡萄糖;麸皮和麦芽糖作为碳源,产酶量不高,当蔗糖作为碳源时,发酵过程则不产生纳豆激酶,这与已往的研究存在差异[16],可能是因为菌株的差异造成的结果。

图1 碳源对产酶的影响Fig.1 Effect of carbon source on the activity of nattokinase
2.1.1.2 氮源对产酶的影响
采用的基础培养基(g/L)为:乳糖10.0、Na2HPO45.0、NaH2PO41.0、CaCl20.2、MgSO40.5,分别以胰蛋白胨、酵母粉、牛肉膏、硫酸铵、磷酸二氢铵作为氮源,添加量为20g/L,进行发酵产酶实验,研究氮源对产酶的影响,结果见图2。最适氮源为牛肉膏,其次是胰蛋白胨和酵母粉,而硫酸铵和磷酸二氢铵作为氮源不能满足大量产酶的需求,出于实验操作的考虑,本实验采用胰蛋白胨作为氮源。

图2 氮源对产酶的影响Fig.2 Effect of nitrogen source on the activity of nattokinase
2.1.2 最适发酵条件的优化结果
2.1.2.1 种龄对产酶的影响
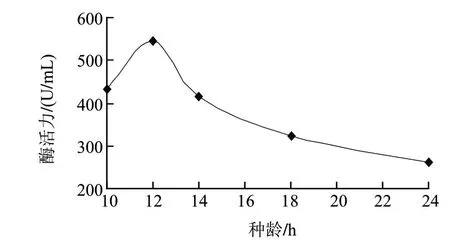
图3 种龄对产酶的影响Fig.3 Effect of inoculation age on the activity of nattokinase
在最适发酵培养基的基础上,将种龄分别为10、12、14、18、24h的种子活化液接入摇瓶进行发酵实验,结果见图3。最初随着种龄的增加,细菌数量的增多,产酶量逐渐提高,当用种龄为12h的活化液进行发酵,最有利于产酶。当种龄超过12h后,随着细菌生长活力的下降,产酶量开始降低,至24h时活化液非常不利于产酶。
2.1.2.2 接种量对产酶的影响
在最适发酵培养基的基础上,将种龄为12h的种子活化液按1%、2%、3%、4%、5%、6%的接种量接入摇瓶进行发酵实验,结果见图4。接种量为2%时,最有利于产酶。接种量过高或过低都不利于产酶,过低影响细菌数量,导致产酶不足;过高则因为培养基的营养成分被大量的微生物的生长而快速消耗,影响了发酵后期的产酶。
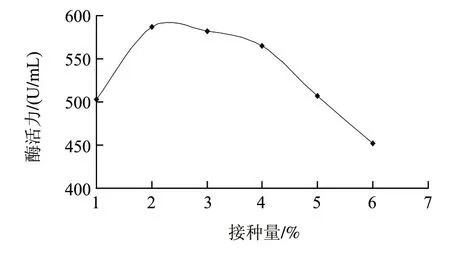
图4 接种量对产酶的影响Fig.4 Effect of inoculum size on the activity of nattokinase
2.1.2.3 发酵时间对产酶的影响
在最适发酵培养基的基础上,选定不同发酵时间12、24、36、48、56、64、72h进行酶活力测定,结果见图5。随着发酵时间的增加,产酶量逐渐提高,当发酵时间超过50h,产酶量趋于稳定,因此将56h作为最适发酵时间。

图5 发酵时间对产酶的影响Fig.5 Effect of fermentation time on the activity of nattokinase
2.2 Plackett-Burman设计筛选影响产酶的重要因素
在单因素试验的基础上选取各因素的高、低水平,按表1设计进行了3轮重复试验,取样测定纳豆激酶的酶活力,取3次测量的平均值,结果见表1。计算各因素效应,评价其重要性,各因素所代表的参数、水平见表2。这个模型是显著的,胰蛋白胨添加量、MgSO4添加量、接种量及发酵温度是影响产酶的重要因素,其中胰蛋白胨添加量、MgSO4添加量、接种量呈现显著的正效应,发酵温度则呈现负效应,因此应当提高胰蛋白胨添加量、MgSO4添加量、接种量,降低发酵温度。根据P值大小,选择3个因素:胰蛋白胨添加量、MgSO4添加量及发酵温度进行响应面优化试验。
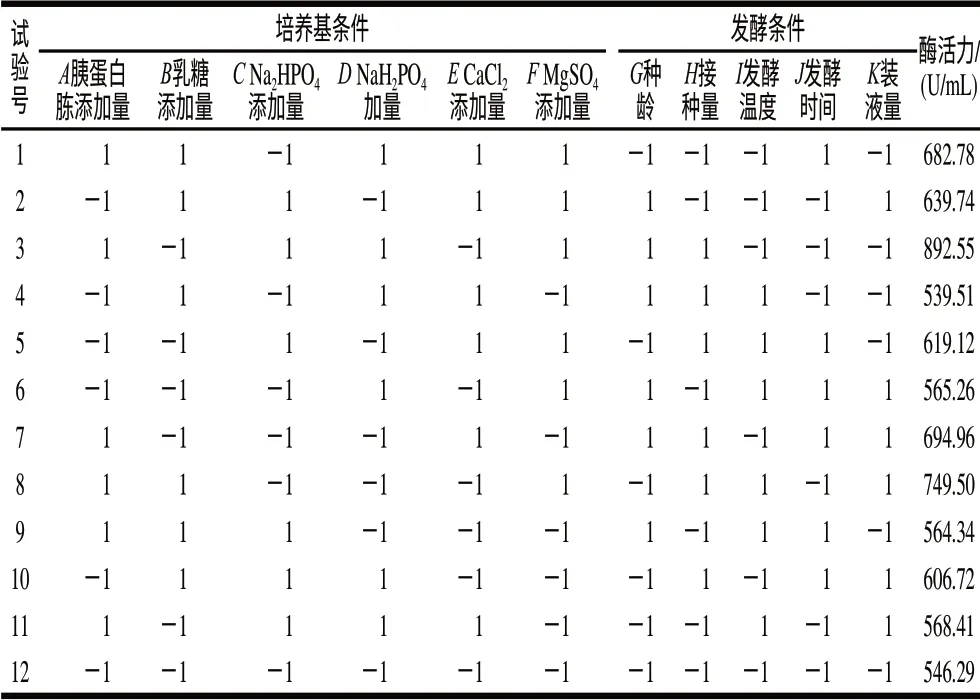
表1 Plackett-Burman试验设计与结果(n=12)Table 1 Design and results of Plackett-Burman tests (n=12)
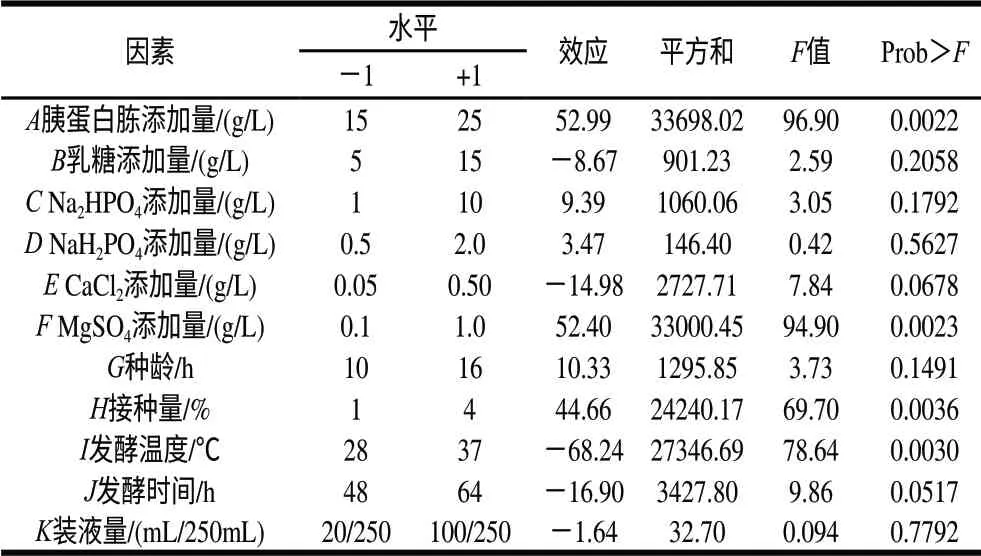
表2 Plackett-Burman试验因素、水平及其效应Table 2 Factors, levels and effects of Plackett-Burman tests
2.3 中心组合试验
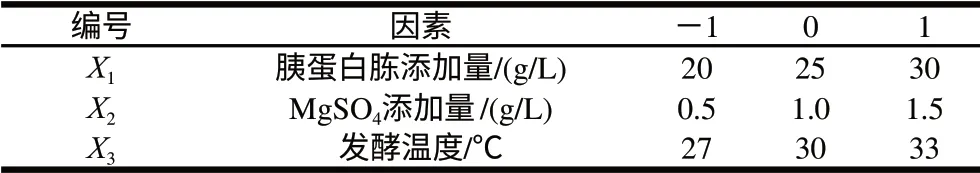
表3 中心组合试验的自变量及其水平Table 3 Variables and levels of central composite tests
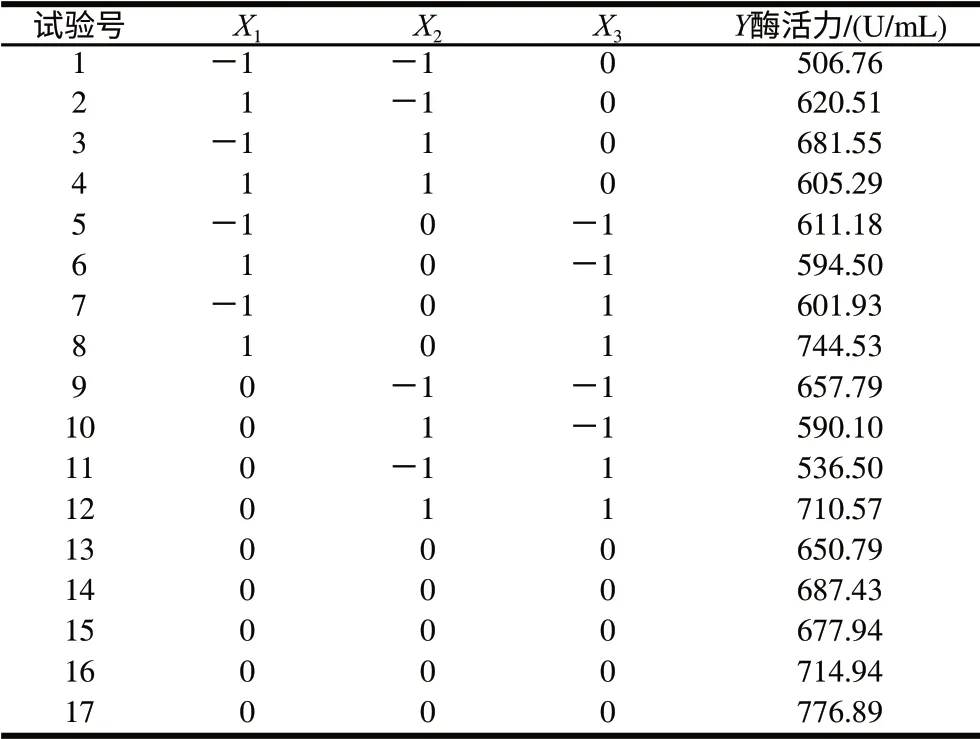
表4 中心组合试验设计及结果Table 4 Design and results of central composite tests
利用Box-Behnken进行响应面试验设计,对PB试验筛选出3个显著因素进行优化,以酶活力为响应值,对应于因变量Y。各自变量水平见表3,试验设计及结果见表4。
通过Design Expert1软件对试验结果进行分析,获得回归方程如下:
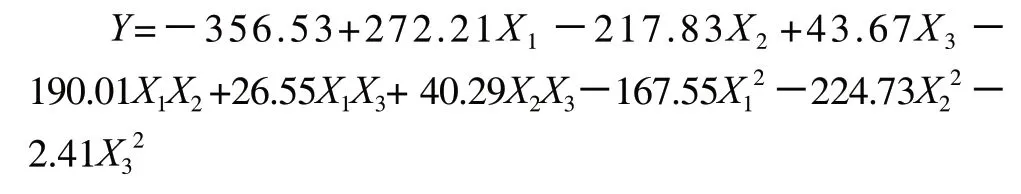
通过对上述二次回归方程进行方差分析,验证回归模型及各参数的显著度,结果见表5。

表5 酶活力二次多项模型的方差分析表Table 5 Analysis of variance for quadratic model of nattokinase activity
由表5可见,模型Prob>F值<0.0500,该模型是显著的,确定系数R2=96.3%,表明该模型与实际情况拟合很好。因此该模型可用于分析和预测纳豆芽孢杆菌液体发酵产纳豆激酶的酶活力。
图6~8为响应面分析的曲面图,可直观地看出各变量与响应值,变量与变量之间的关系,而且回归模型确实存在最大响应值。该模型可预测的最大值为739.818U/mL,此时极值点坐标:X1=26.6g/L,X2=1.35g/L,X3=33℃。为了检验模型预测的准确性,在优化条件下进行发酵验证实验,即发酵培养基条件为:胰蛋白胨26.6g/L、乳糖10.0g/L、Na2HPO45.0g/L、NaH2PO41.0g/L、CaCl20.2g/L、MgSO41.35g/L;发酵条件为:种龄12h、接种量2%、发酵温度33℃、发酵时间56h、装液量50mL/250mL时,所得纳豆激酶酶活力为743.65U/mL,比优化前提高了232.33U/mL,可见该模型能较好的预测实际产酶情况。
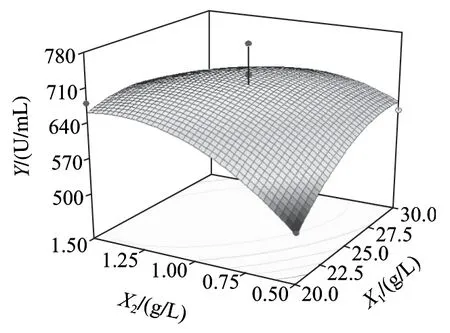
图6 Y=f(X1, X2)响应面图Fig.6 Response surface plot for Y = f(X1, X2)
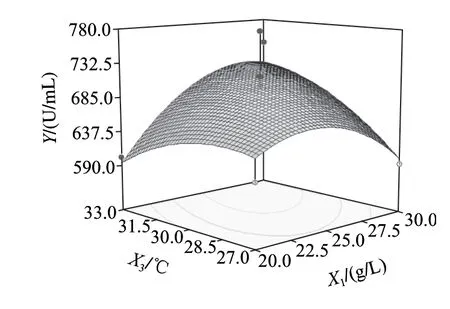
图7 Y=f(X1, X3)响应面图Fig.7 Response surface plot for Y = f(X1, X3)
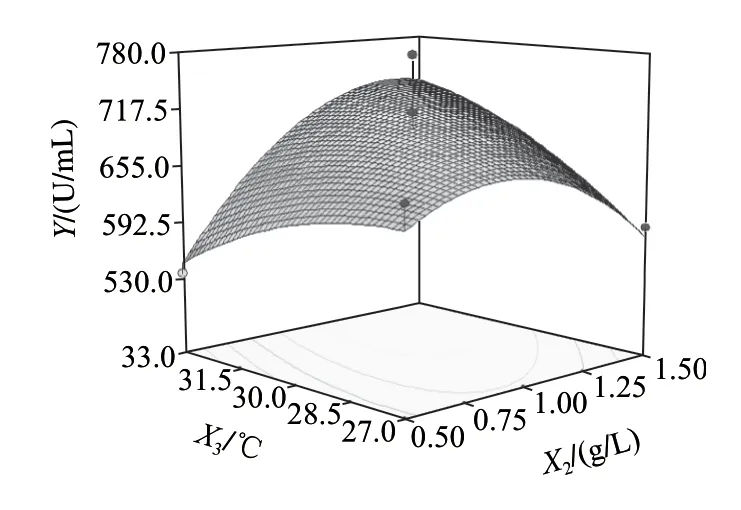
图8 Y=f(X2, X3)响应面图Fig.8 Response surface plot for Y = f(X2, X3)
3 结 论
本研究在单因素试验的基础上,利用Plackett-Burman法筛选出影响产纳豆激酶的重要因素有胰蛋白胨添加量、MgSO4添加量和发酵温度;然后采用Box-Behnken实验设计对这3个重要因素做进一步分析,获得最优的发酵产酶条件为:发酵培养基(g/L)条件:胰蛋白胨26.6、乳糖10.0、Na2HPO45.0、NaH2PO41.0、CaCl20.2、MgSO41.35;发酵条件:种龄12h、接种量2%、发酵温度33℃、发酵时间56h、装液量50mL/250mL;此时实际产酶活力为743.65U/mL,与回归模型预测值存在较小的误差,验证了回归模型的准确性;在此发酵条件下,纳豆激酶的酶活力较优化前提高了232.33U/mL。
[1]SHERRY S.Recombinant tissue plasminogen activator(rt-PA)∶ is it the thrombolytic agent of choice for an evolving acute myocardial infarction[J].Am J Cardiol, 1987, 59(9)∶ 984-989.
[2]FUJITA M, HONG K, ITO Y, et al.Thrombolytic effect of nattokinase on a chemically induced thrombosis model in rat[J].Biol Pharm Bull,1995, 18(10)∶ 1387-1391.
[3]SUMI H, HAMADA H, NAKANISHI K.et al.Enhancement of the fibrinolytic activity in plasma by oral administration of nattokinase[J].Acta Haematol, 1990, 84∶ 139-143.
[4]SUMI H, HAMADA H, TSUSHIMA H, et a1.A novel fibrinolytic enzyme(nattokinase)in the vegetable cheeseNatto∶ a typical andpopular soybean food in the Japanese diet[J].Experientia, 1987,43(10)∶ 1110-1111.
[5]陈志文, 徐尔尼, 肖美燕.纳豆激酶的研究进展[J].食品科学, 2002,23(10)∶ 130-134.
[6]杜平中.溶栓药物的研究进展[J].国外医药∶ 合成药、生化药、制剂分册, 1998, 19(2)∶ 67-71.
[7]邹和昌.溶栓剂的发展及研究[J].中国药学杂志, 1997, 32(5)∶ 263.
[8]迟东升, 阮新民.新型溶栓剂∶ 纳豆激酶[J].心血管病学进展, 2007,28(4)∶ 545-550.
[9]慕运动.响应面方法及其在食品工业中的应用[J].郑州工程学院学报, 2001, 22(3)∶ 91-94.
[10]ASTRUP T, MULLERTZ S.The fibrin plate method for estimating fibrinolytic activity[J].Arch Biochem Biophys, 1952, 40(2)∶ 346-351.
[11]卢可, 娄永江, 周湘池.响应面优化杨梅果醋发酵工艺参数研究[J].中国调味品, 2011, 36(2)∶ 57-60.
[12]董超, 李楠, 程辉彩, 等.纳豆激酶发酵条件的优化[J].食品科学,2009, 30(1)∶ 151-154.
[13]王乐.纳豆激酶高产菌株筛选及发酵工艺优化研究[M].济南∶ 山东轻工业学院, 2009.
[14]王萍, 杜连祥, 路福平, 等.溶栓纳豆芽抱杆菌的筛选鉴定及产纳豆激酶条件的研究[J].食品与发酵工业, 2006, 32(2)∶ 74-77.
[15]梅乐和, 胡升, 许静, 等.纳豆中纳豆枯草杆菌的筛选和纳豆激酶的分离过程研究[J].浙江大学学报∶ 工学版, 2004, 38(10)∶ 1355-1360.
[16]王成涛, 籍保平, 张丽萍.纳豆激酶高活性菌株的筛选及其发酵条件的优化[J].食品科学, 2004, 25(4)∶ 71-74.
[17]桂春燕, 陈义伦, 谢晓平, 等.黄河三角洲耐高渗碱性纤维素酶产生细菌YRD-19的诱变育种和产酶条件优化[J].食品工业科技, 2010,31(10)∶ 163-168.
[18]STOWE R A, MAYER R P.The application of PB method in bacteria research[J].Industrial and Engineering Chemistry, 1996, 58(2)∶ 36-40.
[19]胡升, 梅乐和, 姚善泾.响应面法优化纳豆激酶液体发酵[J].食品与发酵工业, 2003, 29(1)∶ 13-17.
[20]张健, 高年发.利用响应面法优化丙酮酸发酵培养基[J].食品与发酵工业, 2006, 32(8)∶ 52-55.
