α平滑肌肌动蛋白红色荧光蛋白报告基因载体的构建及其在细胞中的表达
2013-01-29阮志燕
蔡 琳 宋 卉 阮志燕
广东食品药品职业学院,广东广州 510520
特发性肺间质纤维化(idiopathic pulmonary fibros,IPF)是一种慢性弥漫性肺间质疾患,发病原因不明,组织学表现为寻常型间质性肺炎(usual interstitial pneumonitis, UIP)[1]。IPF是最常见的特发性间质性肺病,预后差,生存中值只有4年[1-3]。IPF主要发病人群年龄为50~70岁,分布没有人种易感性,男性年发病率为7/10万,女性年发病率为11/10万[4]。IPF的组织学特征包括:肺泡上皮细胞不均一性的损伤活化、特征性的成纤维细胞灶存在和大量细胞外基质沉积[5]。虽然目前对其发病机制有一定的认识,但是其病因和具体的细胞分子机制还未明了。值得注意的是,肺纤维化目前还缺乏有效的治疗手段,患者最后的转归均为呼吸衰竭和死亡。
成纤维细胞灶的形成是IPF关键的病理改变,其主要效应细胞是成肌纤维细胞[6]。目前大多数学者认为,损伤的肺泡上皮细胞通过上皮细胞-间质转分化(epithelial to mesenchymal transition,EMT)是肌纤维细胞的主要来源[6]。EMT 的过程表现为上皮细胞标志物的消失,转而表达间质细胞标志蛋白 α 平滑肌肌动蛋白(α smooth muscle actin,α-SMA)[7]。
α-SMA基因表达的异常激活与调控在肺泡上皮细胞向成肌纤维细胞转分化的过程中占有极为重要的地位,在EMT过程中细胞如何启动和调控α-SMA基因的表达尚未明了。为了探讨肺泡上皮α-SMA基因在肺纤维化微环境下的转录激活,本课题组构建了由α-SMA启动子驱动的红色荧光蛋白报告载体,并在肺泡上皮细胞中进行表达和定位。
1 材料与方法
1.1 试剂和仪器
人肺泡上皮细胞A549细胞株、大肠杆菌DH5α、VSMp8质粒(含小鼠α-SMA启动子序列)由本校实验室保存;质粒微量提取试剂盒、凝胶回收试剂盒(优晶公司);红色荧光蛋白报告质粒空载体pDs-Red(Clontech公司);限制性核酸内切酶(宝生物公司);Lipofactine 2000转染试剂(Invitrogen 公司);重组人 TGF-β1(R&D 公司);倒置荧光显微镜(德国Leica公司);凝胶成像系统(美国Kodak公司)。
1.2 实验方法
1.2.1 α-SMA启动子红色荧光报告载体pDs-Red-SMAp的构建 已知α-SMA启动子区是插入在质粒VSMp8多克隆位点BamHⅠ和sphⅠ之间,用BamHⅠ和sphⅠ内切酶酶切VSMp8得到启动子序列,将其插入pGEM-7Zf质粒的BamHⅠ和sphⅠ位点之间;然后用BamHⅠ和ApaⅠ内切酶酶切再次得到α-SMA启动子序列;继而将启动子序列亚克隆于pDs-Red的BamHⅠ和ApaⅠ位点之间;最终得到重组质粒pDsRed-SMAp。重组子经BamHⅠ和ApaⅠ双酶切鉴定、测序鉴定无误后,扩增备用。
1.2.2 细胞培养 A549细胞株培养在含10%胎牛血清的低糖DMEM培养基中,常规培养于5%的CO2、37℃人工培养箱。
1.2.3 质粒转染 转染前1天,将A549细胞以1.5×104/mL细胞密度接种于24孔板,待24孔培养板中细胞融合至70%~80%时,依照Lipofectine 2000转染试剂的操作指南进行转染。
1.2.4 实验分组和TGF-β1刺激 实验分为4组,A组:转染对照空载体质粒pDsRed组;B组:转染对照空载体质粒pDsRed+TGF-β1组;C组:转染重组质粒 pDsRed-SMAp组;D组:转染重组质粒pDsRed-SMAp+TGF-β1组。需用TGF-β1刺激的组,分别于转染后12 h加入终浓度为10 μg/L的TGF-β1刺激4 h,在荧光显微镜下观察细胞内红色荧光蛋白表达。上述实验重复3次。
2 结果
2.1 pDsRed-SMAp重组载体的酶切鉴定
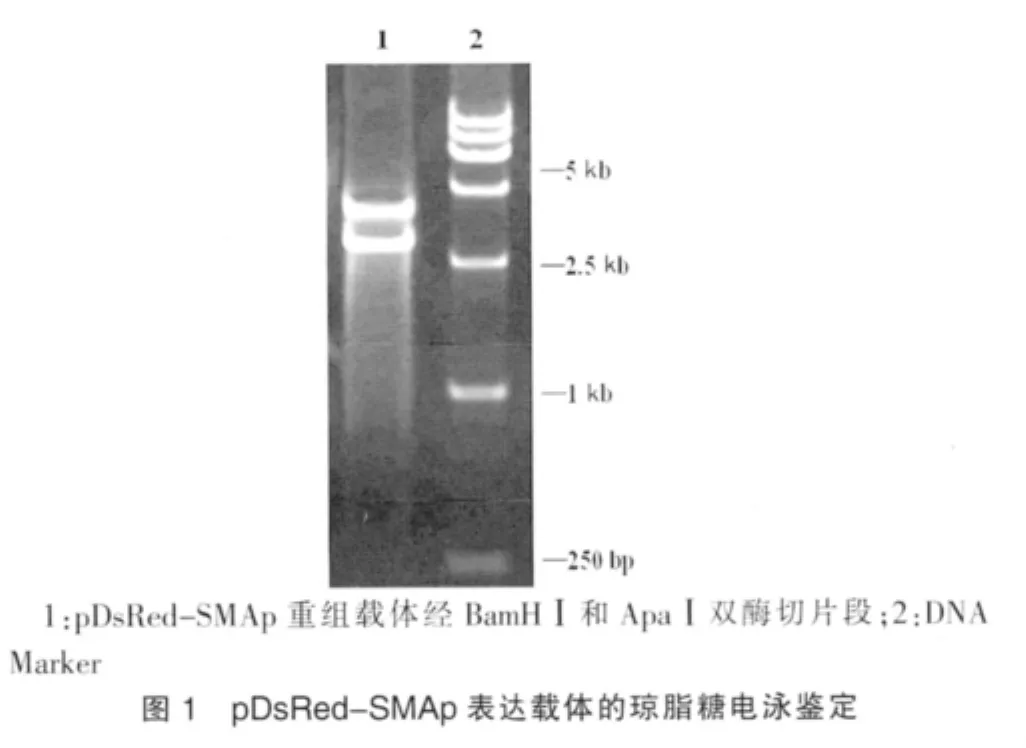
pDsRed-SMAp重组载体经BamHⅠ和ApaⅠ双酶切,凝胶电泳可见切出约4.1 kb和3.7 kb的两个片段,所得酶切片段与设计相符(图1)。
2.2 pDsRed-SMAp重组载体的测序鉴定
经上海生工生物工程有限公司T7通用引物测序,结果与预期序列完全一致,DNA序列和读码框完全正确。
2.3 pDsRed-SMAp红色荧光报告载体在上皮细胞中的表达
A组细胞转染红色荧光蛋白表达空载体质粒pDs-Red,在荧光显微镜下该组肺泡细胞中未观察到红色荧光蛋白(图2A)。B组为转染了空载体质粒pDs-Red的细胞在TGF-β1刺激4 h以后,依然不能在荧光显微镜下观察到红色荧光 (图2B)。C组细胞是转染α-SMA启动子驱动的红色荧光蛋白报告质粒pDsRed-SMAp,在镜下后可见到少量而微弱的红色荧光,但是表达荧光的细胞数量少,细胞呈颗粒状,缺少正常细胞形态(图2C)。D细胞在转染α-SMA启动子红色荧光报告载体12 h后加TGF-β1刺激4 h,在荧光显微镜下则可观察到细胞发出高亮度的红色荧光,表达红色荧光的细胞数量较多,细胞形态呈铺路石状贴壁生长,与正常的肺泡上皮细胞形态一致(图2D)。上述实验共重复3次,结果一致。
3 讨论
传统的观点认为特发性肺纤维化是由慢性炎症引起的,因此予以皮质激素和细胞毒性药物治疗IPF,可以抑制炎症造成的肺组织损伤,从而减轻和治疗肺纤维化[8-9]。但是临床治疗表明,使用糖皮质激素和细胞毒性抗炎治疗对于IPF无明确的疗效,并且许多确诊为IPF的病例中发现其病理组织炎性反应较轻微。近年来的研究表明,IPF的病理改变是由肺泡上皮细胞的损伤造成,反复的损伤刺激导致肺泡上皮细胞转分化为表达α-SMA的成肌纤维细胞,发生EMT。成肌纤维细胞由于其表达间质细胞标志物α-SMA,从而具有了收缩性,并且可以分泌大量的细胞外基质(ECM)沉积在肺组织中,成为IPF的主要效应细胞[10]。

TGF-β被认为是诱导器官纤维化(包括肺纤维化)的“总开关”,是促EMT作用最强的细胞因子,可以启动并完成整个EMT过程[10]。无论是离体实验或在体实验均证实,过表达的TGF-β能促进肺泡上皮细胞转分化,表达间质细胞标志蛋白α-SMA,加重肺纤维化[11-13]。因此,深入研究TGF-β诱导作用下上皮细胞α-SMA的分子调控机制对阐明IPF过程中肺泡上皮细胞发生EMT的病理机制非常重要。
红色荧光蛋白 (red fluorescent protein,RFP)是海葵中分离出来的一种生物发光蛋白,能够在紫外线激发下发出红色荧光[14]。而本研究所采用的DsRed是Clontech公司商业化的一种低毒、低寡聚化及成熟快的红色荧光蛋白突变体[15]。由于荧光蛋白基因可以在未受任何损坏的活体细胞中检测其表达,DsRed被广泛地应用于报告基因的研究。报告基因技术是将一段顺式调控序列插入报告基因上游以控制报告基因的表达,从而直观地“报道”该顺式调控序列的表达调控以及与其相关信号转导通路的活动[16]。DsReD具有很高的消光系数和荧光量子产量,用作报告基因具有荧光亮度高的优势;DsReD发射荧光的强度要比罗丹明B等染料和最好的GFP突变体高得多;DsReD具有较强的抵御光漂白的能力;另外,DsReD对pH值不敏感,pH范围4.5~12时仍保持稳定,这使其使用范围更加广泛。同时,DsReD除了可在活体细胞连续观察的优点,较少受到外来荧光干扰,灵敏度与信噪比高[17]。
本研究构建的α-SMA启动子红色荧光报告载体pDsRed-SMAp是将α-SMA启动子序列插入红色荧光报告基因上游,通过紫外线激发检测红色荧光的强弱,从而示踪α-SMA启动子在活体细胞中的活化情况,对启动子的表达调控进行评估。本研究将成功构建的pDsRed-SMAp重组质粒在人肺泡上皮细胞内进行转染后发现,在静息的上皮细胞可见到少量而微弱的红色荧光,但是表达荧光的细胞数量少,细胞呈颗粒状,缺少正常细胞形态,因此可以推测这些微弱的荧光并非由活体的上皮细胞发出,有可能是死亡细胞产生的非特异性荧光。说明在肺泡上皮细胞中缺乏α-SMA的表达,与既往研究结果一致。而在10 μg/L的TGF-β1刺激4 h后,可在荧光显微镜下观察到由α-SMA启动子驱动的红色荧光蛋白基因高水平表达,发出高亮度的红色荧光,表达红色荧光的细胞数量较多,细胞形态呈铺路石状贴壁生长,与正常的肺泡上皮细胞形态一致。表明在TGF-β1的刺激下诱导了α-SMA启动子活化,所构建的α-SMA启动子驱动的红色荧光报告基因系统具有完整的细胞内功能。
综上所述,本研究成功构建了α-SMA启动子红色荧光报告载体pDsRed-SMAp,具有稳定性好、荧光持续时间长、不破坏细胞结构及直接观察等优点,为研究肺纤维化EMT病理过程中α-SMA的基因调控提供了有效的工具。
[1]Gross TJ,Hunninghake GW.Idiopathic pulmonary fibrosis[J].N Engl J Med,2001, 345(7):517-525.
[2]Gribben J,Hubbard RB,Le-Jeune I,et al.Incidence and mortality of idiopathic pulmonary fibrosis and sarcoidosis in the UK [J].Thorax,2006,61(11):980-985.
[3]Bjoraker JA,Ryu JH,Edwin MK,et al.Prognostic significance of histo pathologic subsets in idiopathic pulmonary fibrosis[J].Am J Respir Crit Care Med,1998,157(1):199-203.
[4]Kim DS,Collard HR,King TE.Classification and natural history of the idiopathic interstitial pneumonias[J].Proc Am Thorac Soc,2006,3(4):285-292.
[5]Kamp DW.Idiopathic Pulmonary fibrosis the inflammation hypothesis revisited[J].Chest,2003,124(4):1187-1190.
[6]Willis BC,DuBois RM,Borok Z.Epithelial Origin of Myofibroblasts during Fibrosis in the Lung[J].Proc Am Thorac Soc,2006,3(4):377-382
[7]De Wever O,Westbroek W,Verloes A,et al.Critical role of N-cadherin inmyofibroblastinvasionandmigrationinvitrostimulatedbycolon-cancer-cell-derived TGF-β or wounding[J].J Cell Sci,2004,117(20):4691-4703.
[8]Mason RJ,Schwartz MI,Hunninghake GW,et al.Pharmacological therapy for idiopathic pulmonary fibrosis:past,present,and future[J].Am J Respir Crit Care Med,1999,160(5):1771-1177.
[9]Katzenstein AL,Myers JL.Idiopathic pulmonary fibrosis: clinical relevance of pathologic classification [J].Am J Respir Crit Care Med,1998,157(4):1301-1315.
[10]Futagawa T,Akiba H,Kodama T,et al.Expression and function of 4-1BB and 4-1BB ligand on murine dendritic cells [J].Int Immunol,2002,14(3):275-286.
[11]Sime PJ,Xing Z,Graham FL,et al.Adenovector-mediated Gene Transfer of Active Transforming Growth Factor-β1 Induces Prolonged Severe Fibrosis in Rat Lung[J].J Clin Invest,1997,100(4):768-776.
[12]Kalluri R,Neilson EG.Epithelial-mesenchymal transition and its implications for fibrosis[J].J Clin Invest,2003,112(12):1776-1784.
[13]Yao HW,Xie QM,Chen JQ,et al.TGF-beta1 induces alveolar epithelial to mesenchymal transition in vitro [J].Life Sci,2004,76(1):29-37.
[14]Matz MV,Fradkov AF,Labas YA,et al.Fluorescent proteins from nonbioluminescent anthozoa species[J].Nat Biotechnol,1999,17(10):969-973.
[15]Sumner JP,Westerberg NM,Stoddard AK,et al.DsRed a highly sensitive,selective,and reversible fluorescence-based biosensor for both Cu(+)and Cu(2+)ions[J].Biosens Bioelcctron,2006,21(7):1302-1308.
[16]Massoud TF,Paulmurugan R,De A,et al.Reporter gene imaging of protein-protein interactions in living subjects[J].Curr Opin Biotechnol,2007,18(1):31-37.
[17]Dmitrienko DV,Vrzheshch EP,Drutsa VL,et al.Red fluorescent protein DsRed:parametrization ofits chromophore as amino acid residue for computer modeling in the OPLS-AA force field[J].Biochemistry(Mosc),2006,71(10):1133-1152.
