阿霉素对心肌肌醇依赖酶l-JNK通路的影响
2013-01-04孔宏亮苗志林李占全叶丽萍
孔宏亮 苗志林 李占全 叶丽萍
(辽宁省人民医院心脏中心 沈阳110016)
阿霉素(adriamycin,Adr)的高效、广谱抗肿瘤特性使其被广泛应用于治疗多种恶性肿瘤,不过,其导致不可逆心肌病、心力衰竭(heart failure,HF)的心脏毒性却严重限制其在临床上的应用,并因此成为HF模型构建的经典方法之一。目前认为细胞凋亡在Adr心肌毒性中发挥重要作用,可能涉及线粒体途径、Fas途径、PI3K/Akt途径、神经酰胺信号系统、P38MAPK途径、P53途径、P35途径和GATA-4途径等的相互作用[1,2]。具有内源性整合调控机制的内质网应激(endoplasmic reticulum stress,ERS)在适度表达时可调节细胞自稳态而抑制凋亡,但持续过度的 ERS却触发细胞凋亡[3-5]。
在 ERS 中,肌 醇 依 赖 酶 1(inositol-requiring enzyme,IRE 1)通路起着重要作[5-7],在IRE1启动细胞凋亡中,最显著的就是c-Jun N末端激酶(JNK)途径[5-7]:IRE1 激 活 后,通 过 TNF 受 体 相 关 因 子 2(tumor necrosis factor receptor-associated receptor 2,TRAF2)-凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)-c-Jun N末端激酶(c-Jun N-termianl kinase,JNK)途径激活JNK,诱导细胞凋亡。目前,对于Adr致心肌损伤效应中,ERS所发挥的作用罕见报道,更遑论Adr对IRE1-TRAF2-ASK1-JNK通路的影响。
材料和方法
1.动物和试剂
Wistar大鼠(150-200g)和乳鼠(1-3d)源自中国医科大学动物中心[SCXK(辽)2003-0009]。试剂:阿霉素(adriamycin,Adr;Sigma公司),总Rt-PCR提取试剂盒、Rt-PCR逆转录试剂盒和Rt-PCR引物(武汉博士德生物技术公司),FCM试剂盒(Sigma),即用型兔抗大鼠IRE、X盒结合蛋白1(X box-binding protein l,XBP l)、TRAF2、ASK1、JNK1/2和 GAPDH 兔抗鼠多克隆抗体及羊抗兔Ig G等(宝生物工程大连有限公司)等。
2.Adr构建HF模型
参照文献 构 建 HF 模 型[3,4,9],方 法 如 下:随 机取健康大鼠分为Adr组 (n=15)和对照组(control group,n=10);Adr组腹部注射 Adr(2 mg/kg),每三天一次共连续五次,之后每周一次共五次,停用2周后心脏超声检查确认HF模型成功构建;对照组按Adr注射方法注射等量生理盐水。所有大鼠均常规喂养。
3.心脏超声检查
按下述方法对大鼠行心脏超声检查[1,2,8]:腹部注射10%水合氯醛 (0.3-0.4mg/l00g)15-20min后仰卧位固定,重复3次测定左室射血分数(LVEF)并取其均值,LVEF<45%被作为HF标准。
4.心肌细胞培养和干预
根据文献选择培养乳鼠心肌细胞,方法如下[10-14]:取心脏左室并剪碎,予0.08%胰蛋白酶振荡、消化(37℃)后离心细胞悬液 (-4℃,100 g,10 min),移沉淀物入培养皿,差速贴壁法获取心肌细胞并接种于培养瓶,隔2天全量换含15%FBS的H-DMEM营养液;将心肌细胞随机分为对照组和Adr组(1μmol/L),干预前24 h各组均 换 为L-DMEM (含15%FBS),干预时培养液中无FBS,干预时间均为96 h。
5.FCM 分析细胞凋亡率(Apoptosis Rate,AR)
将培养的两组乳鼠心肌细胞消化、洗涤后并调整每样本细胞数为1×106/m L,根据试剂盒说明书行FCM,激发光波长488 nm,用515 nm波长检测FITC荧光、560nm波长检测PI荧光,以二维点阵图显示并记录凋亡细胞百分比。在FCM双变量散点图上,左下象限为活细胞(FITC-/PI-),右下象限为凋亡细胞(FITC+/PI-)。每样本至少检测三次,取其均值。
6.Western blot检测
提取心肌总蛋白后将其调至同一浓度,完成聚丙烯酰胺凝胶电泳(每孔加样20μl)、转膜、封闭后,分别加入IRE 1、XBP l、TRAF 2、ASK1、p-ASK1、JNK1/2、p-JNK1/2和 GAPDH 一抗(均1∶200稀释),4℃孵育过夜,于洗膜后加入二抗(1∶400)孵育1h,完成后采用自动凝胶成像分析系统计算积分光密度(IOD),将其IOD分别与内参IOD比值作为相应蛋白半定量指标。每样本至少检测三次并取其均值。
7.统计学方法
采用SPSS 15.0软件包行统计学处理,计量资料以均值±标准差(±s)表示,用One-way方差(One-way ANOVN)进行统计学分析,P<0.05具有统计学意义。
结 果
1.Adr损伤心肌
在体研究显示Adr组LVEF显著低于对照组(0.53±0.03 vs 0.41±0.02%;图1)。体外研究显示阿霉素组心肌细胞凋亡率显著高于对照组(23.3±4.0%vs 5.7±2.1%,P=0.003;图2)。
2.Adr对IRE1α的影响(图3)
Adr构建的HF大鼠心肌组织中IRE1α和p-IRE1α水平均显著高于对照组(P=0.000),分别是对照组的4.42±0.35和3.47±0.20倍;与在体研究相似,Adr干预的心肌细胞亦显著提高IRE1α和p-IRE1α的表达(P=0.000),分别是对照组的5.41±0.27和4.91±0.45倍。
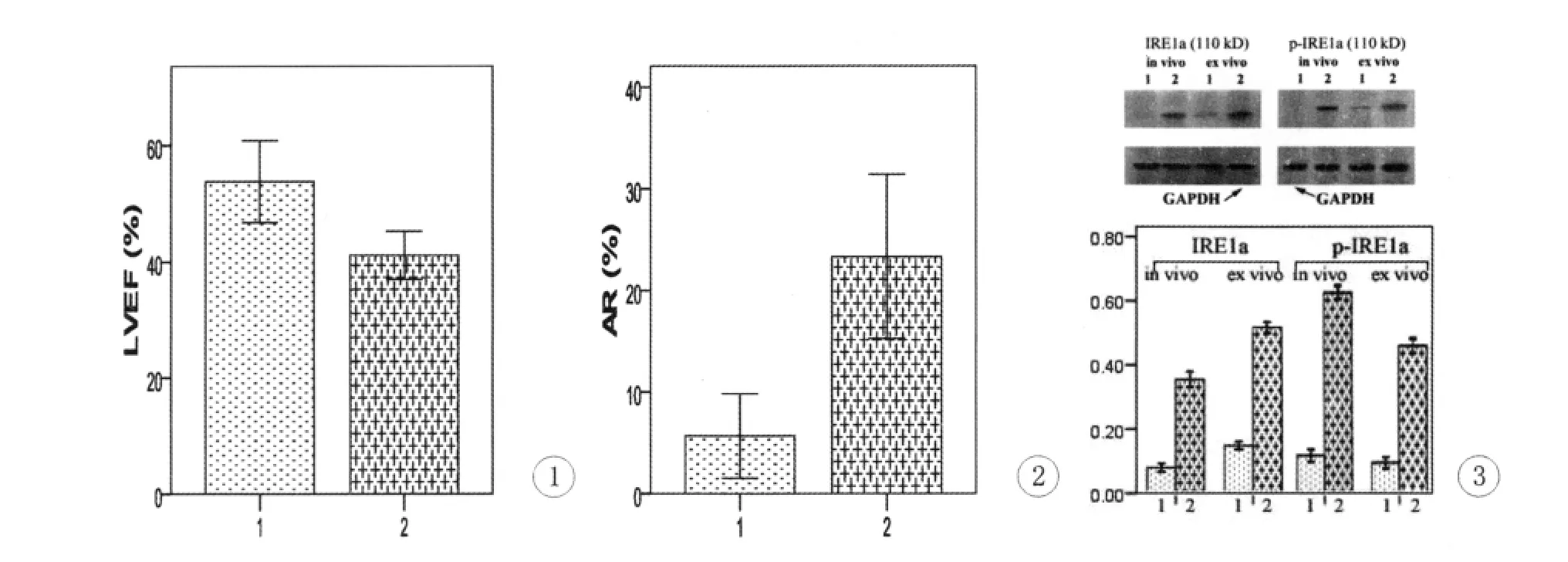
图1 在体研究的各组LVEF。1:对照组,2:Adr组图2 体外研究的各组心肌细胞AR。1:对照组,2:Adr组图3 Western blot检测IRE1α和p-IRE1α蛋白的表达。1:对照组,2:Adr组Fig.1 The mean± SD of LVEF in each group,in vivo.1:control group,2:Adr groupFig.2 AR of cardiomyocytes in each group,in vitro.1:control group,2:Adr groupFig.3 protein assay in each group by western blot.1:control group,2:Adr group
3.Adr对XBP l的影响(图4、图5)
与相应对照组相比,体内(4.40±0.13倍,P=0.000))、体外(4.51±0.12倍,P=0.000)Adr组XBP l蛋白的表达均显著升高。
4.Adr对TRAF 2的影响(图4、图5)
体内和体外Adr组TRAF 2蛋白均显著高于相应对照组(P<0.001),分别是对照组的5.91±0.22和4.45±0.05倍。
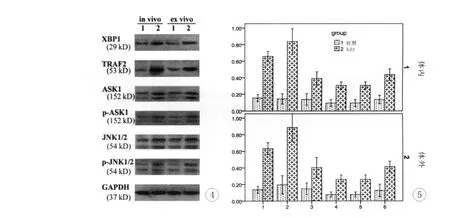
图4 Western blot检测各组蛋白的表达1和2分别代表对照组和Adr组图5 各组蛋白表达直方图 分组内的1和2分别代表对照组和Adr组;X轴上1、2、3、4、5、6分别代表XBP l、TRAF 2、ASK1、p-ASK1、JNK1/2和p-JNK1/2;1和2分别代表体内和体外Fig.4 protein assay in each group by western blot 1 and 2 represents control group and Adr group,respectivelyFig.5 histogram of protein in each group 1 and 2,in each group,represents control group and Adr group,respectively;1,2,3,4,5 and 6,in X axis,represents XBP l,TRAF 2,ASK1,p-ASK1,JNK1/2 and p-JNK1/2,respectively;1 and 2 represents in vivo and ex vivo,respectively
5.Adr对ASK1的影响(图4,5)
Adr构建的HF大鼠心肌组织中总ASK1和p-ASK1水平显著高于对照组(P<0.001),分别是对照组的2.79±0.11倍和3.44±0.10倍;Adr干预的心肌细胞亦显著上调总ASK1和p-ASK1的表达(P=0.000),分别是对照组的2.67±0.15倍和3.25±0.12倍。尤为重要的是,Adr组ASK1磷酸化水平(即p-ASK1与总ASK1比值)显著上调(P=0.000),体内、体外分别是对照组1.46±0.11倍和1.24±0.10倍。
6.Adr对JNK1/2的影响(图4,5)
不管在体内或在体外,Adr组JNK1/2、p-JNK1/2蛋白和其磷酸化水平(即p-JNK1/2与总JNK1/2比值)均显著高于相应对照组(P=0.000),体内分别是对照组的2.16±0.09倍、3.14±0.15倍和1.45±0.21倍,体外分别是对照组的2.03±0.06倍、3.23±0.11倍和1.58±0.15倍。
讨 论
Adr致HF等的心脏毒性使其成为构建HF模型的经典方法,不过,关于其毒性的确切机制并不清楚,虽然目前认为Adr致HF的机制涉及到多个方面[1,2],但对其在ERS方面的研究罕见报道。诚然,ERS中的IRE1通路失衡在促进HF进程中起着重要作用[3-5],但ERS中的IRE1通路是否介导其毒性并不清楚,因此,本研究从IRE1-ASK1-JNK通路方面探讨Adr介导HF毒性的机制。
IRE1位于内质网膜,是一个跨膜丝氨酸/苏氨酸蛋白激酶,非应激状态下,IRE1与GRP78等分子伴侣结合成稳定复合物而不被激活;应激时,IRE1与GRP78等分子伴侣被动解离,自发寡聚化和反式自磷酸化,继而激活其梭基端的核糖核酸内切酶域而具有核酸内切酶活性[12,13]。本研究显示Adr致HF及致体外培养的心肌细胞损伤时大量表达IRE1α和促进其磷酸化,提示IRE1α的表达和磷酸化独立于HF之外,另外亦提示IRE1α过表达可能系细胞损伤的一个标记[14]和IRE1-ASK1-JNK通路的始动环节。Adr致IRE1表达和磷酸化可能系心肌细胞应激时IRE1与GRP78等分子伴侣分离并自磷酸化有关,但IRE1是否通过翻译增加其表达以及是否通过其他方式激活等仍待探讨。
IRE1通过剪切编码XBP1 mRNA翻译生成XBP1,具有活性的XBP1转位至细胞核后上调ERS相关基因的表达,研究表明缺氧可促使乳鼠心肌细胞表 达 XBP1[15],XBP1 适 度 表 达 可 通 过 上 调GRP78而增强内质网处理未折叠蛋白能力,但其过度持续表达却促发细胞凋亡。本研究证实Adr致心肌损伤同时伴有XBP1蛋白表达的上调,提示其可能与Adr毒性效应相关,但其如何介导IRE1-ASK1-JNK通路并不明确。可溶性蛋白TRAF2存在于胞浆内,是将信号从内质网传向胞浆的关键介质,具有抗凋亡和促凋亡双重效应。本实验发现Adr在致心肌损伤过程中上调IRE1和TRAF2表达,此提示IRE1-TRAF2信号通路被激活并参与内质网细胞凋亡反应[14]。
活化的IRE1和TRAF2进一步激活ASK1-JNK途径,而ASK1的激活可促进心肌细胞凋亡(包括非凋亡性细胞死亡)、心肌再灌注损害和心肌病,同时可激活JNK1/2[16,17]。本研究显示 Adr既可在体内又可在体外促发ASK1、p-ASK1的表达甚至促进其磷酸化水平,此无疑提示Adr的心肌毒性可直接通过其提高ASK1的表达和磷酸化水平实现。JNK信号通路是通过ERS介导细胞凋亡的重要信号通路,研究证明Adr干预显著升高JNK表达和其磷酸化水平,敲出JNK基因或抑制JNK表达可减轻心肌细胞凋亡和改善心功能[18,19],本研究进一步证实Adr可独立于HF促发心肌表达JNK和促进其磷酸化水平。
总之,本研究在进一步证实阿霉素心肌毒性基础上,较为系统的探讨了Adr通过IRE1-ASK1-JNK通路致心肌损害的机制,最终显示Adr通过上调和磷酸化IRE1α、提高XBP l和TRAF 2表达等进一步上调ASK1、JNK1/2蛋白和其磷酸化水平,从而导致HF的发生、发展;另外,不管是体内或体外,各个因子的蛋白水平表达均一致等更进一步证实Adr致HF中的IRE1-ASK1-JNK通路独立于HF之外。
[1]孔宏亮,宋丽杰,李占全等.人参皂甙Rbl对阿霉素心力衰竭大鼠致心脏纤维化因子表达的影响.南京医科大学学报,2012,32(1):26-29
[2]孔宏亮,袁龙,宋丽杰等.人参皂甙Rbl对阿霉素致心力衰竭大鼠心脏凋亡相关蛋白和mRNA表达的影响.广东医学,2012,33(15):267-271
[3]Groenendyk J,Sreenivasaiah PK,Kim do H,et al.Biology of endoplasmic reticulum stress in the heart.Circ Res,2010,107(10):1185-1197
[4]Xin W,Li X,Lu X,et al.Involvement of endoplasmic reticulum stress-associated apoptosis in a heart failure model induced by chronic myocardial ischemia.Int J Mol Med,2011,27(4):503-509
[5]Groenendyk J,Michalak M.Endoplasmic reticulum quality control and apoptosis.Acta Biochim Pol,2005,52(2):381-395
[6]Hongliang Kong,Zhanquan Li,Shumei Zhao,et al.Cardiac autonomic nerve fiber regeneration in chromic heart failure:do Akt gene-transduced mesenchymal stem cells promote repair.Neural Regeneration Research,2010,5(1):28-34
[7]孔宏亮,李占全,袁龙.人参皂甙Rbl通过一氧化氮合酶/一氧化氮系统抑制血管紧张素Ⅱ所致的心肌细胞肥大.广东医学,2012,33(2):167-169
[8]Hongliang Kong,Zhanquan Li,Shumei Zhao,et al.Cardiac autonomic nerve fiber regeneration in chromic heart failure:do Akt gene-transduced mesenchymal stem cells promote repair.Neural Regeneration Research,2010,5(1):28-34
[9]Kong HL,Wang JP,Li ZQ,et al.Anti-hypoxic effect of ginsenoside Rbl on neonatal rat cardiomyocytes is mediated through the specific activation of glucose transporter-4 ex vivo.Acta Pharmacol Sin,2009,30(4):396-403
[10]赵颖军,孔宏亮,李占全等.人参皂甙Rbl通过survivin改善乳鼠心肌细胞缺氧凋亡.广东医学,2010,31(21):2760-2762
[11]孔宏亮,赵颖军,陈敏等.高糖对乳鼠心肌细胞葡萄糖转运载体-4的影响.广东医学,2010,31(11):1387-1389
[12]Buck TM,Wright CM,Brodsky JL.The activities and function of molecular chaperones in the endoplasmic reticulum.Semin Cell Dev Biol,2007,18(6):751-761
[13]Malhotra JD,Kaufman RJ.Endoplasmic reticulum stress and oxidative stress:a vicious cycle or a double-edged sword?Antioxid Redox Signal,2007,9(12):2277-2293
[14]Sari FR,Watanabe K,Widyantoro B,et al.Partial inactivation of cardiac 14-3-3 protein in vivo elicits endoplasmic reticulum stress(ERS)and activates ERS-initiated apoptosis in ERS-induced mice.Cell Physiol Biochem,2010,26(2):167-178
[15]Thuerauf DJ,Marcinko M,Gude N,et al.Activation of the unfolded protein response in infarcted mouse heart and hypoxic cultured cardiac myocytes.Circ Res,2006,99:275-282
[16]Minn Y,Cho KJ,Kim HW,et al.Induction of apoptosis signal-regulating kinase 1 and oxidative stress mediate agedependent vulnerability to 3-nitropropionic acid in the mouse striatum.Neurosci Lett,2008,430(2):142-146
[17]Liu Q,Sargent MA,York AJ,et al.ASK1 regulates cardiomyocyte death but not hypertrophy in transgenic mice.Circ Res,2009,105(11):1110-1117
[18]Ghosh J,Das J,Manna P,et al.The protective role of arjunolic acid against doxorubicin induced intracellular ROS dependent JNK-p38 and p53-mediated cardiac apoptosis.Biomaterials,2011,32(21):4857-4866
[19]Das J,Ghosh J,Manna P,et al.Taurine suppresses doxorubicin-triggered oxidative stress and cardiac apoptosis in rat via up-regulation of PI3-K/Akt and inhibition of p53,p38-JNK.Biochem Pharmacol,2011,81(7):891-909
