黑曲霉发酵法辅助提取芒萁黄酮及其抗氧化研究
2012-12-27丁利君黄聪华黎银珠
曾 伟 丁利君 黄聪华 黎银珠
(广东工业大学轻工化工学院,广东 广州 510006)
黑曲霉发酵法辅助提取芒萁黄酮及其抗氧化研究
曾 伟 丁利君 黄聪华 黎银珠
(广东工业大学轻工化工学院,广东 广州 510006)
该试验旨在确定黑曲霉发酵法辅助提取芒萁黄酮的最佳提取工艺,并探讨其抗氧化性。采用黑曲霉发酵法制备混合酶液的方法,通过单因素试验、正交试验确定提取芒萁黄酮的最佳条件,并通过测定芒萁黄酮对羟基自由基、DPPH的清除作用和还原力的分析,对其抗氧化活性进行研究。结果表明,黑曲霉发酵法制备复合酶液,提取芒萁黄酮的最佳条件为加酶量2.5mL,pH 5.0,于70℃下酶解2h;黑曲霉产复合酶辅助提取率最高,由不加酶的6.66%提高到11.67%,芒萁黄酮提取物有良好的清除羟基自由基的能力。
芒萁;黄酮;黑曲霉;抗氧化
芒萁(dicranopteris linearis),又名铁狼萁,是水龙骨目里白科芒萁属的蕨类植物,广泛分布于中国长江以南各省区。芒萁有很好的药用价值,其根茎及叶可治冻伤,能清热解毒,袪瘀消肿止血[1]。它含有糖类、有机酸、黄酮类、皂苷、强心苷、蒽醌类等有效成分,特别是总黄酮含量丰富。研究[2,3]表明,黄酮类化合物具有抗氧化、抗癌、防止心血管疾病、消炎、抗过敏、镇痛、抗菌、抗病毒等作用。目前,提取黄酮类化合物的方法很多,如有机溶剂提取[4]、超声波[5]、超临界流体萃取[6,7]、微波法[8]、酶法[9,10]等,而未见发 酵法辅助提取黄酮的相关报道。该法通过微生物发酵法产生复合酶制剂,并以之分解植物细胞壁中的木质素、纤维素等大分子物质,促进有效成分的浸出,相对超声波、超临界流体萃取、微波法而言,设备简单,成本低。故本试验采用微生物发酵法辅助提取芒萁黄酮,优化其提取工艺,分析其抗氧化活性,为芒萁资源的开发与利用提供理论基础。
1 材料和方法
1.1 试验材料
芒萁:采摘于广州大学城。将新鲜芒萁去杂洗净,于80℃烘干后粉碎,过80目筛,密封保存,备用。
芦丁:上海润捷化学试剂有限公司;
邻苯三酚:分析纯,天津福晨化学试剂厂;
其他试剂:均为国产分析纯;
黑曲霉:由广东工业大学轻工化工学院学院微生物实验室提供;
固体发酵基础培养基:麸皮10g(250mL三角瓶),水15mL,参照文献[11]制备。
1.2 主要仪器
双光束紫外可见分光光度仪:TU-1901,北京普析通用仪器有限责任公司;
微波消解仪:XT-9900型,上海新拓微波溶样测试技术有限公司。
1.3 试验方法
1.3.1 制备混合酶液 斜面培养方法挑取黑曲霉斜面保藏菌种,接于斜面培养基培养后,用无菌水将斜面上的孢子洗下。将1mL孢子悬液接入固体发酵培养基,于600r/min 35℃条件下震荡培养4d,50℃干燥48h,粉碎,过60目筛,制成粉状干菌备用。称取0.500g粉状干菌,加20mL水溶解,磁力搅拌10min,用水定容至50mL,摇匀,在4℃下存放2d,过滤,得混合酶液,备用[12,13]。
1.3.2 总黄酮含量的测定 参照文献[8]。
1.3.3 芒萁黄酮对羟基自由基的清除作用 根据文献[14]修改如下:在10mL试管中依次加入9mmol/L Fe2+1mL,8.8mmol/L H2O21mL,摇匀,静置10min;取不同浓度的样品溶液2mL,摇匀,静置10min,再加入9mmol/L水杨酸-乙醇溶液1mL,摇匀,静置30min后,于510nm处测其吸光值,其清除率按式(1)计算:

式中:
E——羟基自由基的清除率,%;
A0——空白对照液的吸光值;
Ax——加入不同黄酮浓度样品的溶液吸光值;
Aj——不加水杨酸的吸光值。
在文献[14]的基础上,式(1)中引入Aj是为了消除样液本身对测定结果的干扰。
1.3.4 芒萁黄酮对DPPH的清除作用 根据文献[15]修改如下:取不同黄酮浓度的样品(0.02,0.04,0.06,0.08,0.10,0.12mg/mL)1mL,与 0.5mmoL/mL 的 DPPH 溶 液0.25mL混合,加乙醇至10mL,在黑暗中37℃放置20min,在517nm 测定其吸光值Ai;0.5mmol/mL DPPH 溶液0.25mL与1mL乙醇混合,摇匀,加乙醇至10mL,在黑暗中37℃放置20min,在517nm测定其吸光值A0;不同浓度样品1mL与0.25mL乙醇混合,摇匀,加乙醇至10mL,在黑暗中37℃ 放置20min,在517nm测定其吸光值Aj。以乙醇为空白调零。其抑制率按式(2)计算:

式中:
I—— 抑制率,%;
A0——空白对照液的吸光值;
Ai——加入不同浓度样品的溶液吸光值;
Aj——样液在测定波长的吸光值。
在文献[15]的基础上,在式(2)中引入Aj是为了消除样液本身对测定结果的干扰。
1.3.5 芒萁黄酮对还原力的影响 参照文献[16]。
2 结果与分析
2.1 黑曲霉发酵法提取芒萁黄酮的单因素试验结果
2.1.1 温度对芒萁黄酮提取效果的影响 准确称量芒萁粉末5.0g,加入酶液2.5mL,无菌水100mL,pH 7,分别于23(室温),30,40,50,60,70℃下浸提1.5h后,抽滤,定容至250mL,测定总黄酮含量,分析提取温度对芒萁黄酮提取量的影响。由图1可知,随着浸提温度的提高,芒萁黄酮的提取率逐渐增加;在60℃后,提取率增加幅度变小,以下试验选取60℃为提取温度。
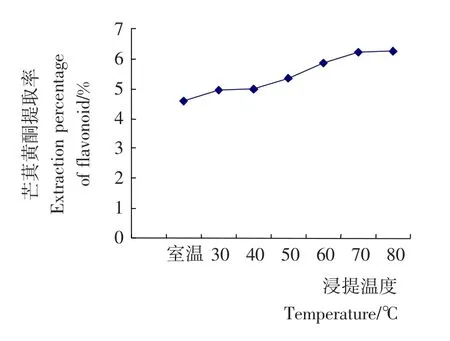
图1 提取温度对芒萁黄酮提取效果的影响Figure 1 The influence of the temperature of extraction of flavonoid from Dicranopteris linearis
2.1.2 浸提时间对芒萁黄酮提取效果的影响 准确称量芒萁粉末5.0g,加入酶液2.5mL,无菌水100mL,于pH 7,60℃下分别浸提0.5,1.0,1.5,2.0,2.5,3.0h,抽滤,定容至250mL,测定总黄酮含量,分析浸提时间对芒萁黄酮提取量的影响。由图2可知,随着浸提时间的增加,芒萁黄酮提取量也呈增加趋势,但浸提时间超过1.5h后,增幅变小,以下处理中,均采用1.5h提取。
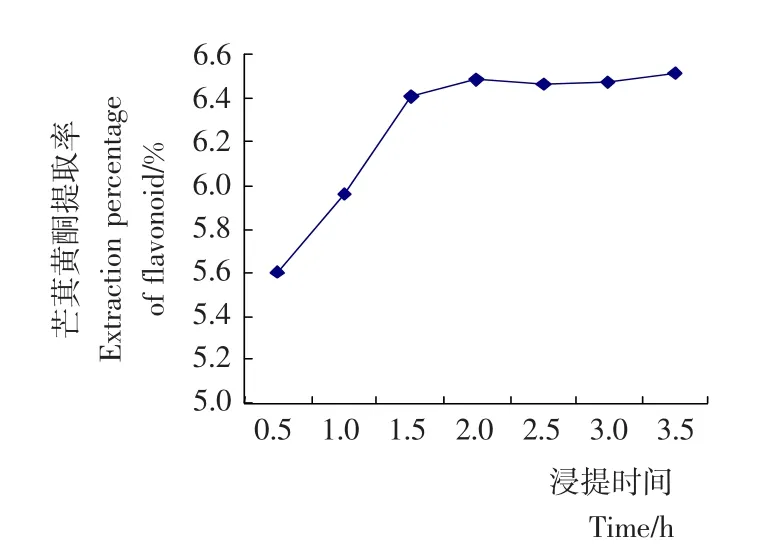
图2 提取时间对芒萁黄酮提取率的影响Figure 2 The influence of the time of extraction of flavonoid from Dicranopteris linearis
2.1.3 酶液添加量对提取效果的影响 准确称量芒萁粉末5.0g,酶液添加量分别为0,15,20,25,30,35mL,无菌水100mL,于pH 7,60℃下浸提1.5h,抽滤,定容至250mL,测定总黄酮含量,确定加酶液的量对芒萁黄酮提取量的影响。由图3可知,加入酶液,芒萁黄酮提取率增加;随着加酶量的增加而增加,增加到1.5mL后,芒萁黄酮提取率的增幅逐渐减小。
2.1.4 pH值对芒萁黄酮提取效果的影响 准确称量芒萁粉末5.0g,加入无菌水100mL,分别调节pH 值至4,5,6,7,8,并加入黑曲霉酶液1.5mL于60℃下浸提1.5h,测定总黄酮含量,分析pH值对芒萁黄酮提取量的影响。由图4可知,黑曲霉在pH值为5时,芒萁黄酮的提取量达到最高。
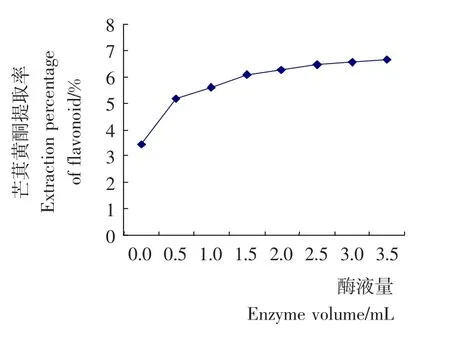
图3 酶液量对芒萁黄酮提取效果的影响Figure 3 The inluence of enzyme volume on extraction of flavonoid from Dicranopteris linearis
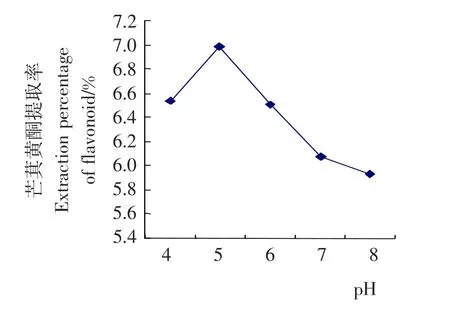
图4 pH值对芒萁黄酮提取效果的影响Figure 4 The influence of pH value on extraction of flavonoid from Dicranopteris linearis
2.2 黑曲霉提取芒萁黄酮正交试验及其结果
采用黑曲霉制备复合酶用于辅助提取芒萁黄酮,考虑到各因素之间的相互作用,在单因素试验的基础上,对提取温度、浸提时间、加酶量、pH值进行四因素三水平的正交试验,从中确定微生物辅助提取芒萁黄酮的最佳提取条件,因素水平见表1,试验设计及结果见表2。
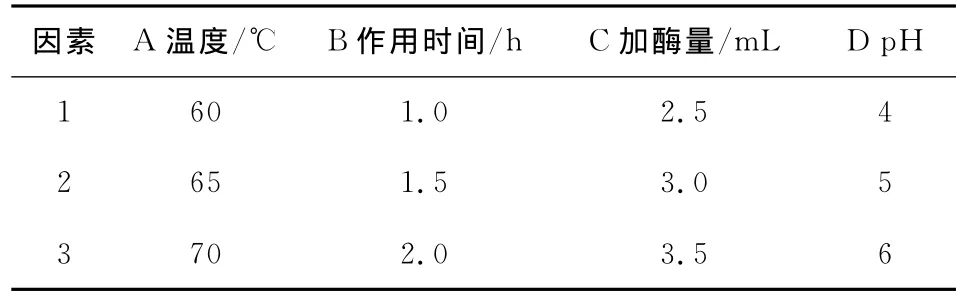
表1 因素水平表Table 1 Factors and levels
由表2可知,最优组合是A3B3C3D2,即温度为70℃、加酶量为3.5mL、时间为2h、pH值为5.0。各因素对芒萁黄酮提取率的影响大小顺序为A>B>C>D,即提取温度对芒萁黄酮提取率的影响比较大,主要是因为温度对酶活有较大的影响。综合考虑各方面的影响,pH值选择5.0,加酶量为2.5mL,即最佳提取条件为加酶量2.5mL,pH 值5.0,于70℃酶解2h。黑曲霉发酵产生的复合酶,具有多种活性较强的酶系,如纤维素酶、淀粉酶、果胶酶、蛋白酶等,可将原料中的纤维素等大分子化合物降解,从而破坏植物的细胞壁,促进有效成分的提取。验证实验表明,在温度为70℃、加酶量为2.5mL、时间为2h、pH值为5.0的条件下,芒萁黄酮的提取率为11.67%。
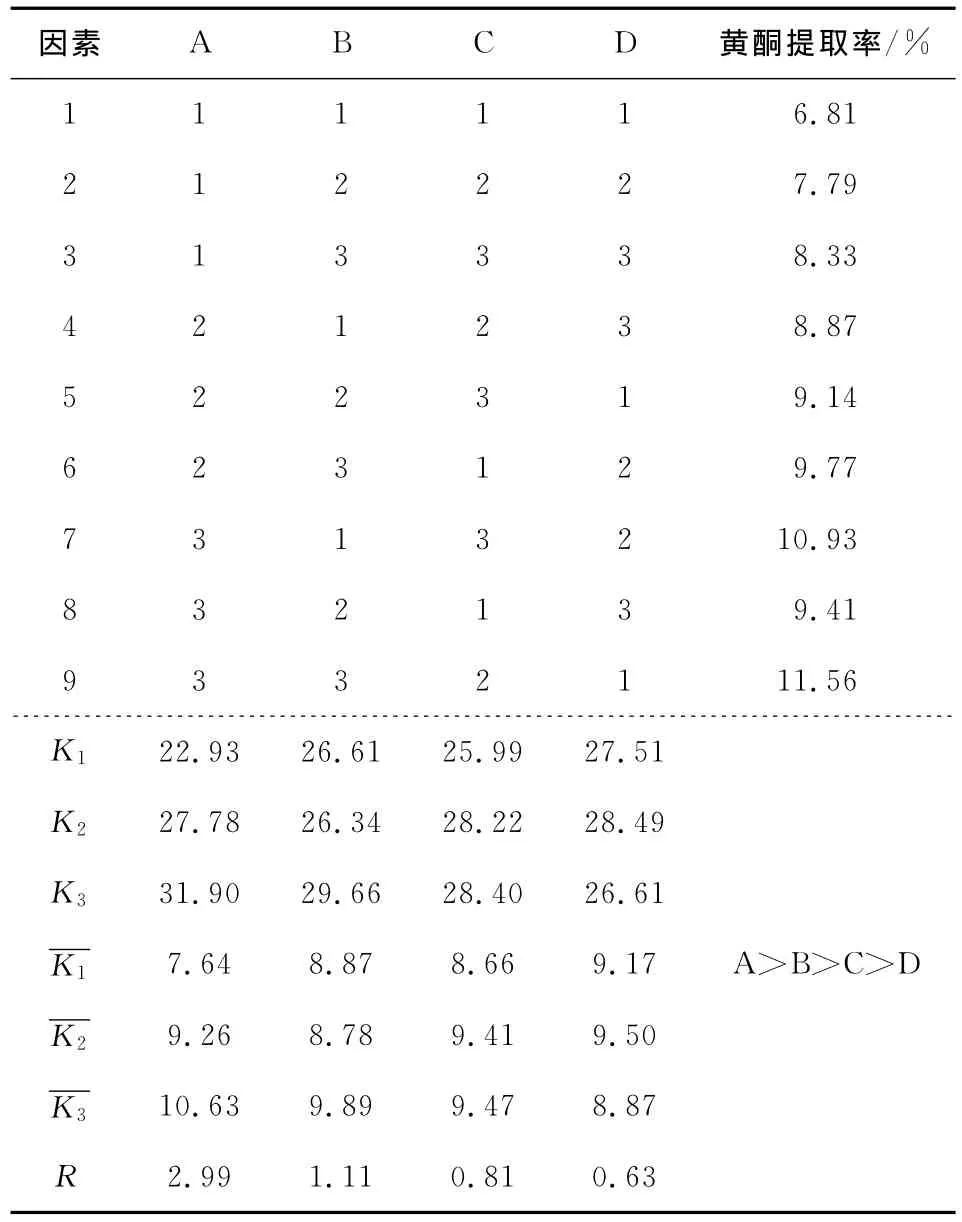
表2 L9(34)正交试验设计及结果Table 2 Analyze and results of the L9(34)orthogonal array design
2.3 芒萁黄酮的抗氧化试验结果
2.3.1 芒萁黄酮对·OH清除作用 由图5可知,对羟基自由基的清除率随着芒萁总黄酮的增加而增加,其IC50为1.22mg/mL。表明芒萁黄酮对清除羟基自由基具有较好的效果,有良好的抗氧化作用。
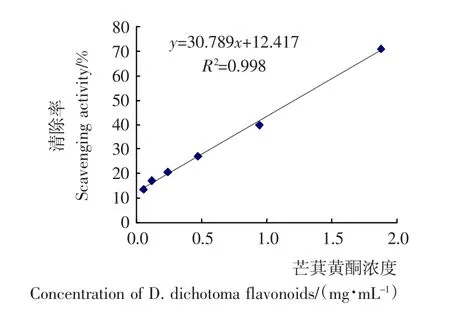
图5 芒萁黄酮对羟基自由基的清除作用Figure 5 The influence of D.dichotoma flavonoids on·OH
2.3.2 芒萁黄酮对DPPH清除能力 由图6可知,随着芒萁黄酮浓度的增加,对DPPH清除能力随之提高,芒萁黄酮表现出一定的对DPPH清除能力。
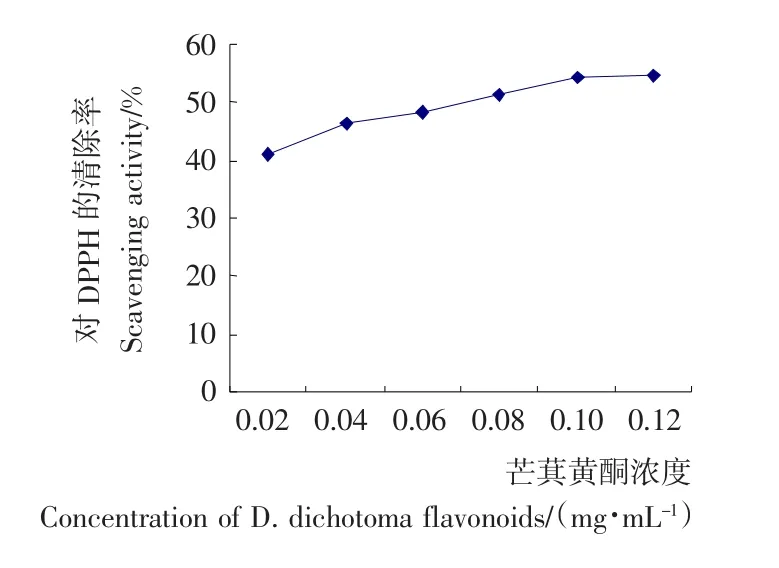
图6 芒萁黄酮对DPPH的清除效果Figure 6 The influence of D.dichotoma flavonoids on DPPH
2.3.3 芒萁黄酮对还原能力的影响 由图7可知,芒萁黄酮的还原力随其浓度的增加而增加,表明芒萁黄酮有较强的给予电子的倾向,使自由基转变成更稳定的状态,从而实现其抗氧化作用。
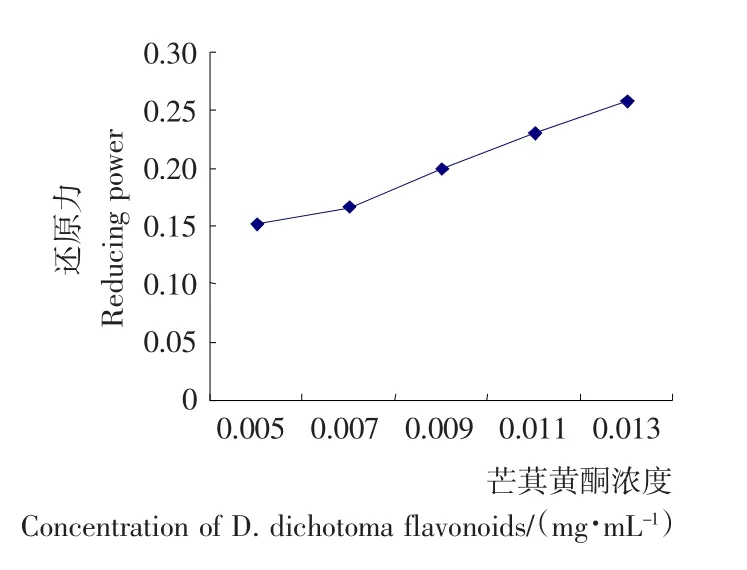
图7 芒萁黄酮对还原力的影响Figure 7 The effect of D.dichotoma flavonoids on reducing power
3 结论
采用黑曲霉发酵制取复合酶,辅助提取芒萁黄酮,不但可以有效提高黄酮得率,还可以大大降低生产成本,为芒萁的进一步开发提供了科学依据。芒萁黄酮有很好的抗氧化性。关于芒萁黄酮的具体结构还需要进一步研究探讨。
1 卢海生,庄惠如.福建福州鼓山药用蕨类植物资源调查[J].亚热带通讯,1999,28(2):42~46.
2 陈建军.木里木香和铁芒萁的次生代谢物及其生物活性研究[D].甘肃:兰州大学,2009
3 Rice E C,Miller N J.The relative antioxidant activities of plant derived ployphenloic flavonoids[J].Free Radical Res.,1995(2):375~383.
4 丁利君,周圳辉,林燕如.芒萁中黄酮物质的提取与其抗氧化研究[J].食品科学,2005,26(8):77~82.
5 刘晓艳,白卫东,温珏晶.超声辅助提取柿叶黄酮的工艺研究[J].食品机械,2007,23(3):70~72
6 崔宁,潘家祯,王春涛,等.超高压超临界流体撞击流方法制备破壁灵芝孢子粉的工艺研究[J].华东理工大学学报(自然科学版),2005,31(4):504~509.
7 李昶红,李薇.预破碎细胞壁超临界二氧化碳萃取除虫菊酯[J].农药,2004,24(11):504~506.
8 田世龙,李守强.苦荞中黄酮微波提取方法及其动态变化研究[J].食品机械,2008,24(4):149~152
9 秦蓝,许时婴,王璋.采用酶法液化技术制备高品质的南瓜汁[J].食品与发酵工业,2004,29(12):48~53.
10 刘云.微生物发酵法提取柑桔皮渣膳食纤维的工艺及其理化特性研究[D].四川:四川农业大学,2008.
11 戴四发,贺淹才.黑曲霉产纤维素酶系各组分特性及酶解条件[J].华侨大学学报(自然科学版),2001,22(1):65~69
12 王丽丽,刘晓兰,郑喜群,等.黑曲霉固态发酵产生果胶酶条件的优化[J].食品科技,2008,33(5):14~18.
13 汤海鸥,程茂基,石秀侠.黑曲霉酶解提取葛根黄酮的研究[J].饲料工业,2006,27(24):14~18.
14 黄红英,邓斌,蒋刚彪.苦竹叶总黄酮的超声提取及其抗氧化研究[J].时珍国医国药,2009,20(6):1 443~1 445
15 勾明玥,刘梁,张春枝.采用DPPH法测定26种植物的抗氧化活性[J].食品与发酵工业,2010,36(3):148~150
16 任娜,郭丽萍,刘玉环.国产葡萄酒清除自由基作用的研究[J].食品科学,2009,30(15):90~93.
Study on extraction of flavonoids fromdicranopteris linearisassisted withAspergillusniger fermentation and its antioxidant research
ZENG Wei DING Li-jun HUANG Cong-huaLI Yin-zhu
(School of Chemical Engineering and Light Industry,Guangdong University of Technology,Guangzhou,Guangdong510006,China)
The flavonoids ofdicranopteris lineariswas extracted with enzyme-assisted method of fermentation ofAspergillus,the optimum extraction process was determined,and its antioxidant activity was researched. Methods:the mixed enzyme was prepared withAspergillusfermentation,the best extraction conditions were determined by single-factor experiments and orthogonal test,and its antioxidant activity was analyzed.Results:the optimum extraction conditions were the amount of enzyme to 2.5mL,pH value of 5.0,at 70℃for 2h.Aspergillusenzyme-assisted extraction produced the highest rate,increased from 6.66%(without enzyme)to 11.67%,The flavonoids had good scavenging ability to hydroxyl radicals,and had good antioxidant activity and good prospects of development.
dicranopteris linearis;flavonoids;aspergillus;antioxidant
10.3969/j.issn.1003-5788.2012.03.032
广东省自然基金项目(编号:8151009001000029;10151009001000011);广东省科技厅计划项目(编号:2008B021100013)
曾伟(1986-),男,广东工业大学在读硕士研究生。E-mail:f12593006@126.com
丁利君
2012-02-10
