莱克多巴胺荧光微球免疫层析检测方法的建立
2012-12-27刘道峰邓省亮赖卫华夏
刘道峰邓省亮赖卫华夏 骏
(1.南昌大学食品科学与技术国家重点实验室,江西 南昌 330047;2.江西省科学院微生物研究所,江西 南昌 330029;3.江西省兽药饲料监察所,江西 南昌 330029)
莱克多巴胺荧光微球免疫层析检测方法的建立
刘道峰1邓省亮2赖卫华1夏 骏3
(1.南昌大学食品科学与技术国家重点实验室,江西 南昌 330047;2.江西省科学院微生物研究所,江西 南昌 330029;3.江西省兽药饲料监察所,江西 南昌 330029)
以荧光微球作为新型标记物,采用EDC法进行偶联,制备莱克多巴胺抗体荧光微球复合物,复合物粒度均一、性质稳定,并以之为探针建立莱克多巴胺荧光微球免疫层析检测方法,检测限为2.5 ng/m L,且特异性强、检测范围宽。与胶体金免疫层析方法相比,荧光微球免疫层析方法的灵敏度更高,新型的荧光微球可以提高免疫层析方法的灵敏度。
荧光微球;莱克多巴胺;免疫层析;检测
莱克多巴胺(ractopamine,Rac)是一种属于苯胺类的β-受体激动剂,主要以盐酸盐形式存在。其具有重新分配机体营养、抑制脂肪沉积、提高蛋白质含量、增加酮体瘦肉率、改善肉质以及促进动物生长的作用[1-3]。因此,近年来在经济利益的驱使下,大量莱克多巴胺被滥用于畜牧业和养殖业。人体摄入Rac的量过大时,会导致一系列不良反应,主要有肌肉震颤、心跳和呼吸加快等,严重的会危害生命。鉴于此,许多国家已经禁止将莱克多巴胺作为饲料及饲料添加剂使用。如欧盟于1996年便明令禁止在畜牧生产中使用包括莱克多巴胺在内的所有β-肾上腺素兴奋剂类药物,中国农业部亦于2002年明确将其列入《禁止在饲料和动物饮用水中使用的药物品种目录》。
目前,检测莱克多巴胺比较经典的方法有高效液相色谱-质谱联用法(HPLC-MS)[4]、气相色谱-质谱联用法(GC-MS)[5]、高效液相色谱法(HPLC)[6],这些都是比较传统的办法,亦是目前的确证方法[7,8]。另外,目前常用的还有酶联免疫(ELISA)[9]的方法。但由于以上方法均需先进检测仪器、检测费用昂贵、步骤繁琐、耗时,且对操作人员专业性要求较高,不适用于基层企事业单位的大通量快速筛查检测。因此,研究莱克多巴胺的快速筛查方法有重要的意义。
荧光微球(fluorescent microspheres,FMs)是指将荧光染料通过物理和化学等方法吸附或包埋到粒子内而形成的,直径在纳米至微米级(0.01~10μm)范围内,受激发光源激发能发出荧光的固体微粒。相比胶体金等传统标记物(须大量聚集才会被辨别出[10]),它的发光强度可以随激发光的强度增强而增强,所以荧光微球标记有望提高免疫层析技术的检测限。在微球壳结构的作用下,荧光微球具有相对稳定的形态结构,粒度均一、单分散性好、稳定性好、发光效率高、重复性好,有较好的生物相容性[11]。形成微球后染料荧光猝灭大大减少,发射强而稳定,且基本不受外界环境介质变化的影响[12]。因此,荧光微球作为标记物的免疫层析技术有较高的研究价值与前景。本试验以荧光微球作为标记物,初步建立了一种快速、灵敏的现场检测方法。
1 材料与方法
1.1 主要材料
莱克多巴胺、西马特罗、特布他林、克伦特罗、沙丁胺醇、OVA:美国Sigma公司;
BSA:瑞士Roche公司;
1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC):上海国药集团化学试剂有限公司;
NC膜:CN140,德国Sartorious公司;
荧光微球(52.9 mg/m L,表面羧基400 nmol/mg)、Anti-Rac单克隆抗体、Rac全抗原、胶体金、免疫微球复溶液:江西中德生物工程有限公司。
1.2 主要设备
点喷系统:BIO-DOT XYZ-3050,美国BIO-DOT公司;
荧光分光光度计:F4500,日本Hitachi公司;
超细微粒粒度分析仪:ZLS Nicomp380,美国PSS公司;
水处理系统:Milli-Q,美国Millipore公司;
可编程切条机:HGS-201,浙江杭州峰航科技有限公司;
高速冷冻离心机:H-2050R,湖南长沙湘仪离心机仪器有限公司;
磁力搅拌器,HJ-6,江苏金坛吉特仪器厂;
真空干燥箱:DZX-6090B,上海福玛实验设备有限公司。
1.3 方法
1.3.1 免疫微球合成及表征 以5 m L标记体系分别标记30,40,50μg/mg(抗体/微球)的免疫微球,具体方法:烧杯(用前铬酸浸泡3 d,再用蒸馏水洗涤并浸泡1 d,p H 5.0的PB缓冲液润洗30 min)中加入定量的PB缓冲液(p H 5.0,下同),加入荧光微球2.5 mg,快速搅拌下加入相应标记量的抗体(稀释10倍并缓慢加入),再缓慢加入10 mg/m L EDC 19.2μL(与微球表面羧基摩尔量相等),保证最终体系体积为5 m L。室温缓慢搅拌反应2 h,再加入500μL 10% (m/m)BSA 封 闭 30 min。8 000 r/min,10 ℃ 离 心10 min,弃上清,并以PB清洗,相同条件离心,重悬于500μL免疫微球复溶液中,4℃保存备用。
另分别取荧光微球和不同免疫荧光微球,多次清洗,超纯水重悬,以超细微粒粒度分析仪分别测定不同微球粒度及zeta电位,以荧光分光光度计连续扫描各微球荧光光谱。
1.3.2 结合垫制备 以 XYZ3050点喷系统分别将1.3.1步骤中免疫微球复溶液重悬后的3种荧光微球喷涂到结合垫上,喷涂量4μL/cm,得到不同标记量的3种结合垫,30℃真空干燥2 h,干燥保存备用。
1.3.3 Rac NC膜的制备与处理 用XYZ3050点喷系统分别在NC膜的适当位置喷涂Rac全抗原、羊抗鼠二抗形成检测线(T线)和质控线(C线),30℃真空干燥1 h,制成Rac NC膜,干燥环境保存。另取Rac NC膜分别于0.5%BSA(m/m)、0.5%OVA(m/m)中封闭10 min,超纯水漂洗残余封闭剂,沥干水分,30℃真空干燥1 h,干燥保存备用。
1.3.4 荧光微球标记免疫层析试纸条组装 分别取1.3.2步骤得到的30,40,50μg/mg不同标记量结合垫与1.3.3步骤所得的BSA封闭、OVA封闭与未封闭的NC膜,于干燥环境中,依次按聚酯膜、样本垫、结合垫、Rac NC膜、吸水垫的顺序将各部分粘贴于试纸条PVC底板上,用切条机切成4 mm宽的试纸条,组装卡壳,干燥保存。
1.3.5 荧光微球免疫层析检测方法的判定 将试纸条平放,滴加样品待检液80μL于加样孔,5 min后于手持式荧光读取仪中观察。若T线显色(有可见条带)则判读为阴性,样本中不含Rac或低于检测限;T线不显色(无可见条带)则判读为阳性,样本溶液中Rac浓度大于检测限。若C线不显色,则判定为试纸条无效。
1.3.6 荧光微球免疫层析试纸条参数选取与评价
(1)免疫层析最佳参数选取:将Rac标品用甲醇溶解,并用PBS稀释至1 000,100,20,10,5,2.5,1.25 ng/m L。分别向不同组试纸条滴加以上浓度标品80μL,同时以PBS作阴性对照,按1.3.5所述检测方法分别判断不同组试纸条显色情况。择优作为本方法最终条件。
(2)灵敏度及检测范围的测定:Rac标准品以甲醇溶解,PBS调整终浓度为10 000,1 000,100,40,20,10,5,2.5,2,1.25 ng/m L,将优化后试纸条,以1.3.5所述方法在Rac浓度0~10 000 ng/m L间判读结果,每个浓度重复5次。
(3)方法特异性:用甲醇稀释RAC的结构类似物西马特罗、特布他林、克伦特罗、沙丁胺醇至1 mg/m L,再用PBS缓冲液稀释至终浓度为1,5,10,50,100,500 ng/m L。以1.3.5所述的标准方法检测,每个浓度重复5次,判断试纸条的检测特异性。
(4)与胶体金方法的比较:参阅文献[9]将试验所用Anti-Rac单克隆抗体标记到胶体金上,按其相应方法优化工艺参数并组装成胶体金免疫层析试纸条。按1.3.6(2)方法同时将胶体金试纸条与荧光微球试纸条在Rac浓度为0,1.25,2.5,3,4,5,6,7,8,10,20 ng/m L的添加水平上判断试纸条响应情况及灵敏度,每浓度3个平行。
2 结果与分析
2.1 荧光微球的表征
2.1.1 zeta电位及粒度 由图1和图2可知,微球偶联前后在纯水中均带负电荷,zeta电位相对时间均比较稳定;偶联前,微球平均粒径为232.8 nm,颗粒多分散性指数(Variance)为0.167。表明所用微球在溶液中性质稳定,颗粒规则、大小均匀。
偶联后zeta电势有所下降,平均粒径有所增大(316.8 nm),表明由EDC介导的通过表面羧基的偶联方法成功,多分散性指数依然较小(0.275),说明得到的免疫微球颗粒均一,适合作为免疫层析检测探针。

图1 偶联前后微球zeta电位Figure 1 Zeta potential of FMs before and after coupling reaction

图2 偶联前后微球粒度分布Figure 2 Size distribution of FMs before and after coupling reaction
2.1.2 荧光微球光学性质 经荧光分光光度计连续扫描发现所用微球最大激发波长为462.4 nm,最大发射波长为592.8 nm,说明所用荧光微球有较大的Stokes位移,意味着在此微球标记的免疫层析检测中激发光及发射光可以更轻松地被分开,背景干扰较低,故以此微球做免疫层析标记物有较强优势。
由图3可知,经过偶联后,不同抗体标记量的微球发射光谱峰型规则,荧光强度有所降低,但仍与偶联前有相同的峰位,发射谱峰未见漂移。说明偶联后荧光微球的发光颜色与抗体的标记量无关,偶联过程不会造成微球光学性质的改变。
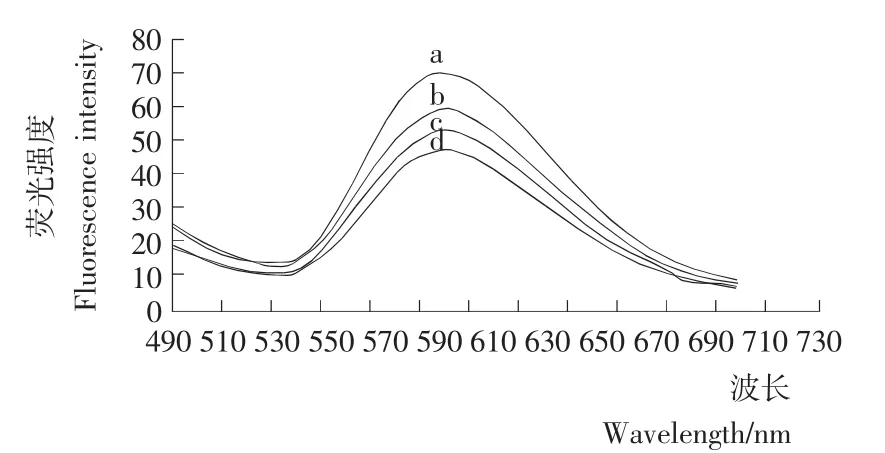
图3 偶联前与不同标记量微球荧光光谱Figure 3 Fluorescence spectra of FMs and FMs coupled with different amount of antibody
综上所述,偶联后的Rac免疫微球性质稳定、颗粒规则、大小均匀,有较好而且稳定的光学特性,适合作为免疫层析的标记物。
2.2 不同免疫层析参数最低检测浓度结果
不同标记量与NC膜不同处理方式的试纸条的最低检测浓度见表1。

表1 不同试纸条最低检测浓度Table 1 LOD of different lateral flow strips/(ng·m L-1)
2.3 标记量的选择
如表1所示,在所测范围内,降低抗体的标记量,检测灵敏度随之提高,但同时相应T线条带的清晰度也会减弱。试验中显示,30μg/mg标记量与40μg/mg标记量检测限差异不显著,但相比之下,30μg/mg标记量阴性(图4(a))与阳性(图4(b))区分性差,40μg/mg标记量的阴性两条带更清晰,阴性与阳性对比明显(图4(c)、图4(d)),判读更容易。
综合考虑,层析方法选择40μg/mg抗体标记量的免疫微球。

图4 不同标记量试纸条对比Figure 4 Strips with different coupling ratio
2.4 NC膜处理方式选择
由于NC膜是多孔性网状结构膜,因此可能与生物大分子及较大颗粒发生不利于层析检测的非特异性吸附。采用封闭剂封闭是降低这种非特异性吸附的有效手段,本试验对比了NC膜不同处理方式(包括不封闭NC膜、BSA封闭NC膜、OVA封闭NC膜)对检测限及荧光微球在NC膜上涌动性能的影响。
由表1可知,在不封闭的情况下采用极高的浓度依然难以阻断,并且阻断的浓度并不完全随抗体标记量的升高而升高,因此,NC膜不封闭条件下的显色是不确定性的、非特异性的。经封闭后,NC膜的非特异性吸附降低,阻断反应正常,免疫层析的检测灵敏度也有相应提高,故NC膜的封闭是十分必要的。此外,在相同标记量下,OVA封闭NC膜后最低检测浓度也低于BSA封闭。
在对荧光微球涌动性影响上,非特异性的吸附会造成荧光微球在NC膜上释放性差,导致NC膜前端有明显荧光微球残留,即存在月牙状荧光亮线(图5(a))。试验中未封闭(a)与BSA封闭(b)试纸条均有不同程度残留,而以0.5%OVA为封闭剂可大大提高微球涌动性能,多次重复未发现残留(图5(c)),未影响T线条带观察。
故OVA体系是较为理想的封闭剂,层析方法中NC膜的封闭选择0.5%的OVA。
2.5 灵敏度及检测范围
由表2可知,优化后(结合垫微球标记量40μg/mg,NC膜以0.5%OVA封闭)该方法有效检测限为2.5 ng/m L,试纸条检测结果在0~10 000 ng/m L浓度范围内有效。
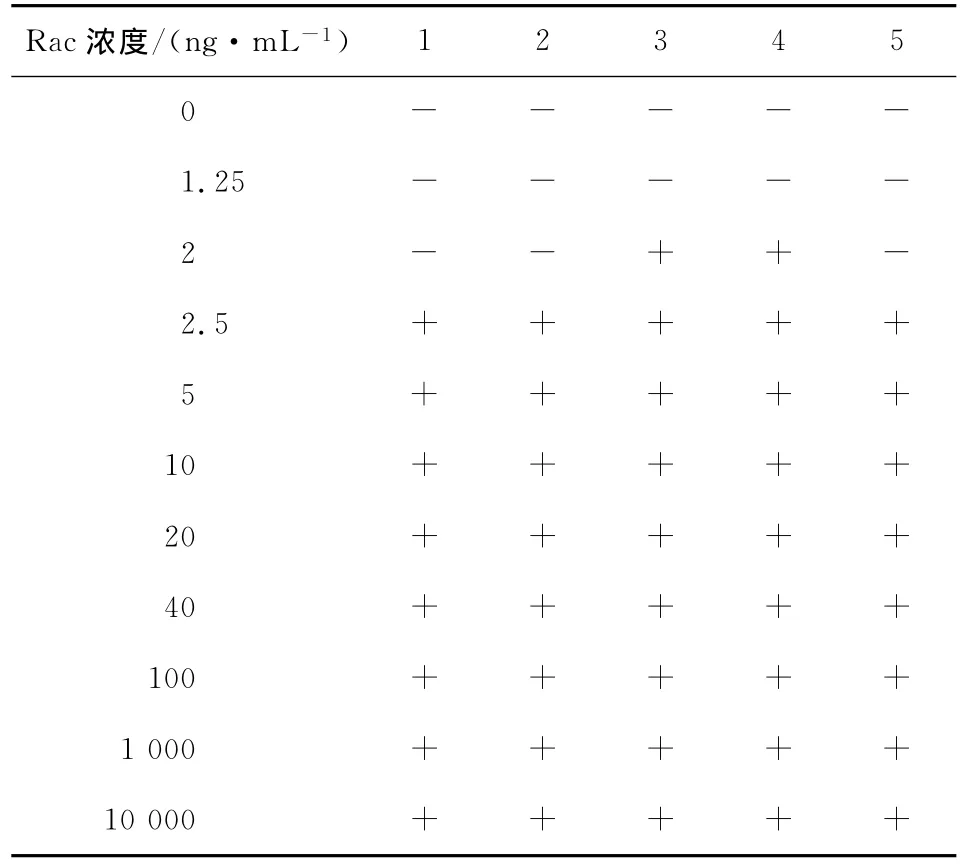
表2 Rac荧光微球标记试纸条检测范围+Table 2 Responses of fluorescent lateral flow strips to different Rac level
2.6 特异性
由表3可知,Rac的几种常见结构类似物沙丁胺醇、西马特罗、克伦特罗、特布他林不会与本免疫层析试纸条发生交叉反应,表明本方法特异性良好。

表3 Rac荧光微球标记试纸条特异性结果+Table 3 Specificity of fluorescent lateral flow strips for detecting Rac
2.7 与胶体金免疫层析方法的比较
由表4可知,相同条件下,选胶体金为标记材料的层析试纸条有效检测限为5 ng/m L,此值高于荧光微球标记的层析试纸条的检测限(2.5 ng/m L)。可见,在竞争模式的层析检测方法中,相比于胶体金,荧光微球可以明显提高免疫层析方法的灵敏度。

表4 荧光微球免疫层析与胶体金免疫层析方法的比较+Table 4 Responses of strips based on FMs and colloidal gold
3 总结与讨论
目前,胶体金标记为代表的免疫层析检测技术已经在食品安全领域有了较多应用,但以胶体金为代表的此类吸收光谱型标记物须大量聚集才会产生肉眼可见信号[10],限制了免疫层析检测技术的检测灵敏度。而荧光微球等发射光谱型标记物因信号强度可随激发光增强而增强,因此在理论上可以有效降低层析方法的检测限。本试验以EDC介导的一步法偶联,合成了适用于免疫层析检测的荧光微球探针,荧光微球粒度均一、化学及光学性质稳定;建立了此荧光探针标记的以莱克多巴胺为目的物的免疫层析检测方法,最终检测限可达2.5 ng/m L,灵敏度高于同条件下胶体金层析检测试纸条及文献[12]报道胶体金免疫层析方法,从而证明了荧光微球等激发光谱型标记物在免疫层析过程中作为标记物有着较强的优势。崔浩等[13]采用物理方法将Rac抗体和荧光乳胶颗粒偶联,得到的免疫层析检测试纸条灵敏度高、效果较好,也可以印证这一结论。另外,经初步探索,本方法Rac完全阻断浓度已为2.5 ng/m L,若采用更高质量的抗体偶联微球并作进一步工艺优化,灵敏度仍有上升的空间。如果结合荧光读取分析仪器使用,灵敏度则会有更高的提升。
1 Carr S N,Hamilton D N,Miller K D,et al.The effect of ractopamine hydrochloride(Paylean?)on lean carcass yields and pork quality characteristics of heavy pigs fed normal and amino acid fortified diets[J].Meat Science,2009,81(3):533~539.
2 López-Carlos M A,Ramírez R G,Aguilera-Soto J I,et al.Effect of ractopamine hydrochloride and zilpaterol hydrochloride on growth,diet digestibility,intake and carcass characteristics of feedlot lambs[J].Livestock Science,2010,131(1):23~30.
3 Xiao R J,Xu Z R,Chen H L.Effects of ractopamine at different dietary protein levels on growth performance and carcass characteristics in finishing pigs[J].Animal Feed Science and Technology,1999,79(1-2):119~127.
4 Dong Y,Xia X,Wang X,et al.Validation of an ultra-performance liquid chromatography-tandem mass spectrometry method for determination of ractopamine:Application to residue depletion study in swine[J].Food Chemistry,2011,127(1):327~332.
5 He L M,Su Y J,Zeng Z L,et al.Determination of ractopamine and clenbuterol in feeds by gas chromatography-mass spectrometry[J].Animal Feed Science and Technology,2007,132(3-4):316~323.
6 程盛华,杨春亮,郑龙,等.高效液相色谱法测定动物组织中的莱克多巴胺残留量[J].分析仪器,2009(4):69~72.
7 中华人民共和国国家质量监督检验总局.GB/T 22147——2008饲料中沙丁胺醇、莱克多巴胺和盐酸克仑特罗的测定 液相色谱质谱联用法[S].北京:中国标准出版社,2008.
8 中华人民共和国国家质量监督检验总局.GB/T 22286——2008动物源性食品中多种β-受体激动剂残留量的测定 液相色谱串联质谱法[S].北京:中国标准出版社,2008.
9 金晶.ELISA法和胶体金免疫层析法检测猪尿样中的莱克多巴胺[D].南昌:南昌大学,2007.
10 吴刚,姜瞻梅,霍贵成,等.胶体金免疫层析技术在食品检测中的应用[J].食品工业科技,2007(12):216~218.
11 吴伟兵,王明亮,景宜,等.单分散荧光微球的制备及其光学性能研究[J].南京林业大学学报(自然科学版),2010,34(3):15~19.
12 郭荷梅,杜红丽,刘文生,等.莱克多巴胺胶体金免疫层析快速检测试纸条的研制[J].广东农业科学,2009(2):82~84.
13 崔浩,陈耀强,唐勇,等.莱克多巴胺荧光胶乳颗粒免疫层析检测法的建立[J].分析测试学报,2011,30(7):764~768.
Development of lateral flow assay of ractopamine based on fluorescent microspheres
LIU Dao-feng1DENG Sheng-liang2LAI Wei-hua1XIA Jun3
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang,Jiangxi330047,China;2.Institute of Microbiology,Jiangxi Academy of Sciences,Nanchang,Jiangxi330029,China;3.Jiangxi Province Institute of Veterinary Drug and Feed Control,Nanchang,Jiangxi330029,China)
A composition,with a stable character and uniform size,and which contains fluorescent microspheres as a novel label,was obtained successfully by a EDC one-step method.A fluorescent lateral flow assay for detecting ractopamine which has high sensitivity(LOD available is 2.5 ng/m L),satisfying specificity and a wide range for detecting was developed based on this composition as probe.The method of fluorescent microspheres lateral flow assay is more sensitive than that of colloidal gold lateral flow assay.The novel fluorescent microspheres do contribute to improve the sensitivity of immunochromatographic assay.
fluorescent microspheres;ractopamine;immunochromatography;detection
10.3969/j.issn.1003-5788.2012.01.019
国家自然科学基金项目(编号:30960301);江西省教育厅科学技术研究项目(编号:GJJ09284)。
刘道峰(1988-),男,南昌大学在读硕士研究生。Email:defoelau@163.com
赖卫华
2011-08-01
