次氯酸钠对葡萄叶片组培褐变率的影响
2012-12-23温鹏飞张建成牛铁泉仓国营邢延富
温鹏飞,王 蓓,张建成,牛铁泉,仓国营,邢延富
(山西农业大学园艺学院,山西太谷030801)
组织培养又称离体培养,狭义地讲,是指用植物各部分组织(如形成层、薄壁组织、叶肉组织、胚乳等)进行培养获得再生植株[1]。组织培养不仅可以快速繁殖优良种苗,而且还可以培育脱毒苗木,保持其优良性状[2-3]。此外,组织培养也为育种提供了许多手段和方法,使育种工作能更有效地进行[4-6]。在组织培养中,外植体灭菌是最关键的一步。大田的园艺作物常常带有各种各样的病菌,因而,在接种前一定要对其进行彻底灭菌才可以保证后续试验的成功。一般生产实践上,多用自来水反复冲洗,之后用不同的灭菌剂进行杀菌,如酒精、次氯酸钠和升汞等[7-9]。药剂的浓度和灭菌时间决定了外植体的感染、褐化和愈伤组织的分化。药剂浓度过大,灭菌时间过长,超过了细胞的忍耐力,细胞就会褐变死亡;但时间和浓度如果过短过轻,则可能无法杀死外植体表面的细菌[10-11]。因而,寻求最佳的药剂及其浓度和时间组合,控制外植体褐变率,是组培成功的关键。
葡萄叶片富含多酚类物质,为避免其褐变率过高,往往需要进行一些药剂处理,如抗坏血酸和PVP 等[12]。在完整植物体的细胞中,酚类化合物和多酚氧化酶分隔存在,因而比较稳定。当外植体切割后,切口附近细胞的分隔效应被打破,酚类化合物被多酚氧化酶氧化形成褐色的醌类化合物,醌类化合物又会在酪氨酸酶的作用下,与外植体组织中的蛋白质发生聚合,进一步引起其他酶系统失活,导致组织代谢紊乱,生长受阻,最终逐渐死亡[13-14]。研究表明,酶促褐变是由多酚氧化酶引起的。次氯酸钠(sodium hypochlorite)是一种强氧化剂和消毒剂,能够使多酚氧化酶在一定程度上失活,且具有较强的消毒能力,因而,常被作为易氧化褐变的外植体的灭菌剂[15-16]。
本研究以美乐葡萄的叶片为外植体,对次氯酸钠浓度和灭菌时间进行梯度设置,在MS 培养基上接种且观察,寻找褐变率最低的组合,以期为葡萄组织培养提供技术支持,并为后续的试验奠定基础。
1 材料和方法
1.1 试验材料
美乐葡萄(Vitis vinifera L. Merlot)叶片采自山西农业大学园艺站。选取面积为5 cm2左右幼嫩叶片[14]进行处理。
1.2 试验方法
全部采用MS 培养基[17],并添加激素4 mol/L 2,4-D 和2 mol/L 6-BA 以及3%蔗糖和7.5 g/L琼脂,pH 值为5.8。
把采好的样品进行预处理,即先用自来水反复冲洗约5 min,洗干净表面的泥土污渍后,再用75%酒精浸泡30 s,之后用灭菌后的蒸馏水冲洗叶片上的酒精,最后用次氯酸钠进行灭菌。次氯酸钠灭菌时间分别为30(A1),60(A2),90(A3)s,浓度(w/V)分别为1%(B1),2%(B2)和3%(B3)。
把处理好的叶片接种在培养基上,贴好标签,放入培养室进行培养(光培养16 h,暗培养8 h),5 d 后观察感染褐变和愈伤情况。
2 结果与分析
2.1 接种后感染及愈伤组织发生情况
从图1 和表1 可以看出,通过自来水冲洗后用酒精进行浸泡,不同浓度次氯酸钠灭菌均能达到满意的效果,各处理接种后均无污染现象发生。此外,次氯酸钠各处理组中均有愈伤组织产生。这表明,次氯酸钠灭菌效果能够满足后续试验要求。

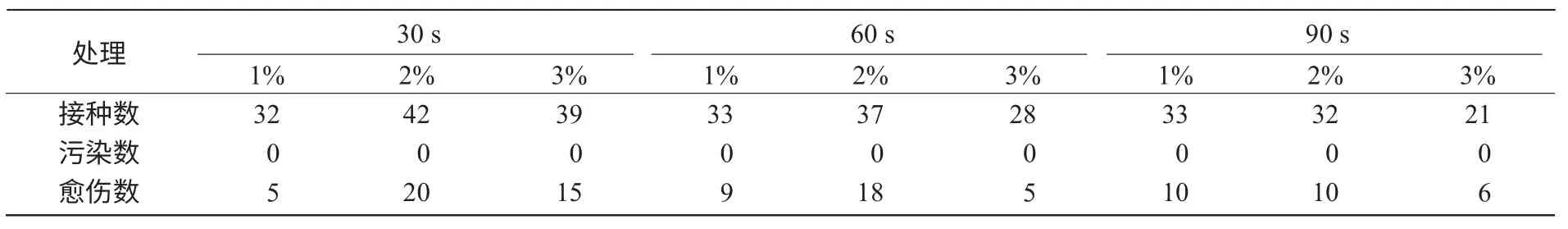
表1 叶片接种后污染及愈伤情况
2.2 次氯酸钠浓度对褐变率的影响
不同浓度次氯酸钠对葡萄叶片组培褐变率的影响如图2 所示。由图2 可知,不同浓度次氯酸钠灭菌后褐变率因灭菌时间不同而存在明显差异,且当灭菌时间不同时,不同浓度次氯酸钠表现出不同的褐变率。当处理时间较短(30 s)时,高浓度次氯酸钠褐变率较低;而当处理时间延长后,较高浓度(2%)则表现较好。这表明,次氯酸钠的灭菌效果与灭菌时间关系密切。方差分析结果表明,1%,3%,2%处理两两之间差异达显著水平。

2.3 次氯酸钠灭菌时间对褐变率的影响
次氯酸钠灭菌时间对褐变率的影响如图3所示。

由图3 可知,当次氯酸钠浓度较低(1%)时,其褐变率随处理时间延长而降低。这表明,低浓度次氯酸钠处理在短时间(30 s)内难以达到最佳的灭菌效果。而当处理时间延长(60 s)后,褐变率因浓度不同而表现不同。当处理时间为60 s 时,2%次氯酸钠处理褐变率最低;而当处理时间为90 s 时,3%浓度的褐变率最低。这表明,次氯酸钠处理时间的延长和使用浓度具有互补性,也就是说,短时间处理应采用高浓度,而长时间处理则应使用低浓度。方差分析结果表明,90,60 s 处理与30 s 处理之间差异达显著水平,90 s 处理与30 s 处理之间差异达极显著水平。
2.4 次氯酸钠浓度和处理时间互作对褐变率的影响
当同时考虑次氯酸钠浓度和处理时间时,二者表现出明显的互作效应(表2)。二因素互作的情况下,褐变率较小的组合为A1B2 和A2B2,且均在0.01 水平上与其他组合差异显著,但二者之间差异不显著。因此,这2 个组合为次氯酸钠对美乐葡萄叶片组培的最优灭菌方案,即用2%的次氯酸钠灭菌外植体叶片30~60 s。

表2 灭菌时间和药剂浓度互作对褐变率影响的多重比较
3 讨论
次氯酸钠(sodium hypochlorite)是一种强氧化剂、漂白剂和消毒剂,其强氧化性可以使多酚氧化酶在一定程度上失活,且具有较强的消毒能力[15-16]。本试验结果表明,次氯酸钠对葡萄叶片组培中褐变率存在明显的抑制作用,且其最佳处理方法为用2%的次氯酸钠处理30~60 s。
前人研究结果表明,褐变的主要原因是由于多酚氧化酶的存在,且多酚氧化酶的活性与多酚浓度有关[18-24]。多酚浓度较低时,随浓度的增加多酚氧化酶活力也增强;而当浓度继续增加时,氧化反应速度上升缓慢,且后期有下降趋势[25]。Yu等[18]对葡萄进行研究发现,从侧生枝切取的茎尖比延长蔓更容易成活,进一步研究还发现,蔓的酚类物质比茎尖高。有研究表明,卡特兰在新茎旺盛生长季节(6—9 月)的褐变率显著增加,在生长较弱的冬春季则显著减少,相反,红豆杉在旺盛的生长季节的幼嫩茎段褐变少,愈伤组织的发生率高,这种季节性差异的主要因素也是由于植物体内酚类物质含量多少造成的[19-20]。
此外,正常组织(如葡萄叶片)虽然含有丰富的多酚类物质但并不发生褐变,则是由于细胞内酚类物质和PPO 的区域性所致[21],细胞室结构的破坏,使底物和酶结合,这是褐变不可或缺的因素[22]。鞠志国等[23]研究发现,液泡是贮存酚类物质的场所且不含PPO,PPO 则主要分布在细胞质中。谢春艳等[26]研究也发现,有活性的PPO 定位于正常细胞的质体中,其他类型的PPO 则存在于各种囊泡中。这表明,正常情况下,细胞内PPO和多酚类物质的分布存在严格的细胞区隔。刘曼西[27]的研究同样也证实,截断酚类物质与多酚氧化酶的接触可以有效地防止褐变。
本试验结果表明,次氯酸钠低浓度(1%)时,其褐变率均较高,这可能是由于浓度较低,难以抑制多酚氧化酶活性而导致褐变发生严重。当浓度为2%时,次氯酸钠的浓度可以与多酚氧化酶发生反应,阻挡了多酚氧化酶与酚类物质的反应,因而,其褐变率下降;当次氯酸钠的浓度继续升高到3%时,不但阻挡了多酚氧化酶与酚类物质的反应,同时由于浓度较高,对植物细胞也造成了严重的影响,导致细胞死亡,因而,其褐变率再次升高。
此外,本试验结果表明,当灭菌时间为30 s时,1%,2%和3%的褐变率依次为84%,52%和62%;当灭菌时间为60 s 时,其褐变率依次为73%,51%和82%,均表现为褐变率随处理时间延长而有所降低。这可能是由于处理时间较短时,次氯酸钠与葡萄叶片里的多酚氧化酶产生反应,低浓度的次氯酸钠(1%)由于没有足够的底物浓度,而无法中和掉叶片中使酚类反应褐变的多酚氧化酶,所以,酚类物质会在和多酚氧化酶的接触中褐化,因而,褐化率较高;当灭菌时间达到90 s 时,3 种浓度的次氯酸钠几乎对褐变率影响不大,均在70%左右。这可能是由于处理时间较长(90 s),次氯酸钠与植物细胞接触时间过长,其含量已不是褐变的决定因素,因此,无论次氯酸钠浓度为多少,其褐变率均变化不大。
[1]林顺权.园艺植物生物技术[M].北京:中国农业出版社,2007.
[2]曹孜义,刘国民.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,1996.
[3]陈振光.园艺植物离体培养学[M].北京:中国农业出版社,1996.
[4]王国平,洪霓.果树的脱毒与组织培养[M].武汉:化学工业出版社,2005.
[5]曹孜义.现代植物组织培养技术教程[M].兰州:甘肃科学技术出版社,2004.
[6]程宗明,徐喜楼.葡萄组织培养的现状及展望[J].果树科学,1992,9(1):50.
[7]刘培德,朱林.葡萄茎尖培养[J].中国果树,1983(2):43.
[8]张福庆,于向君.酒用葡萄组培脱毒快繁技术的研究[J].中外葡萄与葡萄酒,2001(1):14.
[9]朱文勇,毛静琴.瑰宝葡萄新品种单芽茎段培养与增殖的研究[J].山西果树,1991(2):66.
[10]张玉满,田砚亭,罗晓芳.葡萄生物技术研究的进展[J].北京林业大学学报,1997,19(1):71.
[11]沈传进,王利民,张平,等.鲜食葡萄组织培养快速繁育系统的建立[J].河北农业科学,2011,15(7):16-21.
[12]崔唐兵,郭勇,张长远.植物组织培养中褐变现象的产生机理及克服方法[J].广东农业科学,2001(3):16.
[13]李杨昕,张元湖,田淑芬,等.玫瑰香葡萄生长期酚类物质含量及抗氧化性的变化[J].园艺学报,2007,34(5):1093.
[14]叶梅,王伯初,段传人.植物组织培养外植体褐变的研究进展[J].生物技术通讯,2004(15):426.
[15]杨志祥,王军明,牛俊峰,等.次氯酸钠水溶液体系稳定性研究[J].浙江科技学院学报,2007(3):19.
[16]刘积灵,董薇,张玉坤.次氯酸钠水溶液稳定性的研究及应用[J].中国氯碱,2004(6):8.
[17]李克喜,王启凤.夏黑葡萄组织培养和快繁技术[J].中国南方果树,2004(4):38.
[18]Yu D H,Meredith C P J.The influence of explant origin on tissue browning and shoot production in shoot tip culture of grapevine[J].J Amer Hort Sci,1986,111(6):972.
[19]谭文澄,戴策刚.观赏植物组培技术[M].北京:中国林业出版社,1991.
[20]夏铭,吴降云,张丽梅.红豆杉组织培养中褐变问题的研究[J].生物技术,1996,6(3):18.
[21]Mager A M,Harel E. Polyphenol oxidase in plants [J]. Phytochemistry,1979,18:193.
[22]王慧.香梨果实的褐变与多酚氧化酶及酚类物质区域化分布关系[J].干旱区研究,1995,12(2):27.
[23]鞠志国,朱广廉.莱阳梨果实褐变与PPO 及酚类物质区域化分布的关系[J].植物生理学报,1988,14(4):256.
[24]张振霞,洪平.橄榄总多酚含量及多酚氧化酶活性与组培褐变的关系[J].中国农学通报,2010,26(22):54-57.
[25]刘树文,陈锦屏,王仲孚. 菊芋多酚氧化酶活性的研究[J].中国农学通报,1998(6):11.
[26]谢春艳,宾金华,陈兆平.多酚氧化酶及其生理功能[J].生物学通报,1999,34(6):11.
[27]刘曼西.有机酸对马铃薯PPO 活性的影响[J].植物生理学通讯,1991,27(5):350.
