镁对哮喘患者外周血CD4 + CD25 + 调节性T 细胞凋亡及Foxp3 表达的影响*
2012-12-23梁瑞韵江山平黄林洁李依群
梁瑞韵, 伍 卫, 黄 瑾, 江山平, 黄林洁, 李依群
(1中山大学孙逸仙纪念医院呼吸内科,广东 广州510120;中山大学附属第五医院2心内科,3呼吸内科,广东 珠海519000)
支气管哮喘(哮喘)是一种免疫失衡性疾病,既往观点认为Th1/Th2 失衡在哮喘的发病机制中扮演着重要角色。但近年来研究发现CD4+T 细胞的其中一个亚群具有调节功能并参与哮喘的免疫调节,其中,CD4+CD25+T 细胞的作用受到很大的关注。尤其是CD4+CD25+调节性T 细胞(regulatory T cells,Treg)紊乱导致的免疫耐受破坏在哮喘的发病机制中起着重要作用。CD4+CD25+T 细胞在哮喘发病中的作用引起了人们的广泛关注,其作为一群调节机体免疫应答的重要细胞,本身也应存在一个被调节的过程,在人体微环境改变的情况下,CD4+CD25+T 细胞能否被调控呢?
众所周知,镁能缓解气道平滑肌痉挛,使支气管扩张。由于其有效、使用安全、副作用少,镁剂在哮喘的应用已得到广泛推广。而镁能否调节CD4+CD25+T 细胞的凋亡情况及其特殊的转录因子叉头框蛋白3(forkhead box protein 3,Foxp3)的表达,目前未见相关报道。本实验拟通过分离纯化并培养健康人及哮喘患者外周血中CD4+CD25+T 细胞,以镁剂干预后,再检测CD4+CD25+T 细胞的凋亡情况及其Foxp3的表达情况,了解镁对哮喘患者CD4+CD25+T 细胞的影响,以更深入地了解支气管哮喘的发病机制,从而为支气管哮喘的防治提供新的思路。
材 料 和 方 法
1 研究对象
健康成年人16 人,平均年龄(25 ±13)岁,男6 名,女10名,为本院健康志愿者。哮喘患者16 人,平均年龄(33 ±12)岁,男10 名,女6 名,符合《支气管哮喘防治指南》诊断标准,为本院门诊及住院病人,均未使用镁剂或影响镁排泄的药物(如利尿剂)2 周以上,未使用糖皮质激素类药物或停用1 周以上;其中8 例为支气管哮喘急性发作患者。
2 主要试剂和仪器
完全培养基包括RPMI-1640(Gibco)、10% 小牛血清(杭州四季清公司)、2 mmol/L L-谷氨酰胺、10 mmol/L HEPES、1 ×105U/L 青霉素和100 mg/L 链霉素;淋巴细胞分离液(1 073 g/L,上海恒信化学试剂有限公司);注射用硫酸镁(2.5 g∶10 mL,广州化学试剂厂,批号070402);碘化丙啶(propidium iodide,PI;Sigma);核糖核酸酶A(RNaIse A,25 mg;Sigma);鼠抗人IgG1-FITC/IgG1-PE (Becton Dickinson);CD25-FITC/CD4-PE (Becton Dickinson);鼠抗人CD8纯化抗体(Becton Dickinson);Phycoerythrin-Cy5(PE-Cy5);抗人Foxp3 抗体(eBioscience);羊抗鼠IgG 免疫磁珠(goat anti-mouse IgG immunomagnetic beads,晶美生物工程有限公司);FACSCalibur 型流式细胞仪(Becton Dickinson);HERAcell CO2培养箱(Heraeus)。
3 方法
3.1 健康人及哮喘患者外周血CD4+CD25+T 细胞的分离及培养 按说明书进行,具体如下:(1)所有受试者无菌取外周静脉血15 mL,分离、洗涤外周血单核细胞,并分离出T 淋巴细胞。(2)按2 μg∶107cells 加入鼠抗人CD8 纯化抗体,反应后离心弃上清中未结合的抗体,按60 μg∶107cells 加入羊抗鼠IgG 免疫磁珠,反应后加入RPMI-1640 完全培养基重悬细胞,磁分离器分离,收集未被免疫磁珠结合的细胞悬液(即CD4+T 细胞)至另一干净管中。(3)按2 μg∶107cells 加入鼠抗人CD25 纯化抗体,反应、离心后弃上清中未结合的抗体,按60 μg∶107cells 加入羊抗鼠IgG 免疫磁珠,反应后加入RPMI-1640 完全培养基重悬细胞,磁分离器分离,收集被免疫磁珠结合的细胞悬液(即CD4+CD25+T 淋巴细胞)至另一干净管中。(4)用24 孔板培养,分空白组和镁剂干预组(镁离子终浓度为10 mmol/L),以RPMI-1640 完全培养基调整细胞终浓度,使每孔5 ×105cells∶1.5 mL,置37 ℃、5%CO2培养箱中培养72 h,收集0 和72 h 细胞进行相关检测。
3.2 外周血CD4+CD25+T 细胞纯度的检测 (1)取100 μL CD4+CD25+T 细胞悬液,洗涤后在各测定管中加入CD25-FITC/CD4-PE 各20 μL,向阴性对照管中加入小鼠IgG1-FITC/IgG1-PE 单抗各20 μL,避光孵育并离心2 次。(2)于流式细胞仪(CellQuest 程序)中检测10 000 个细胞,于FSC-SSC点图设矩形门R1 排除碎屑,再作IgG1-FITC/IgG1-PE 点图,设阴性对照十字门使包括左下象限95%细胞,将阴性对照图中的十字门复制、粘贴于CD25-FITC/CD4-PE 点图中,统计分析CD4+CD25+T 细胞阳性率。
3.3 CD4+CD25+T 细胞占CD4+T 细胞的比例检测 (1)取100 μL CD4+T 细胞悬液(1 ×105细胞)加入抗CD4-PE/CD25-FITC 单抗各20 μL,避光孵育。(2)向阴性对照管中加入小鼠IgG1-FITC/IgG1-PE 单抗各20 μL,避光孵育。(3)调整细胞浓度,于流式细胞仪(CellQuest 程序)中检测,统计分析CD4+CD25+T 细胞阳性率。
3.4 DNA 含量分布的流式细胞仪检测 (1)收集细胞并离心,70%乙醇500 μL 4 ℃固定24 h 以上,以PBS 洗涤后离心2 次,加入5 g/L RNase A 10 μL,室温避光反应后加入10 mg/L PI 染液10 μL,4 ℃避光染色。(2)调整细胞浓度,以488 nm 激发波长,于流式细胞仪(CellQuest 程序)中检测细胞,于FSC-SSC 点图设矩形门R1 排除碎屑,再作FL2W-FL2A 点图及FL2A-counts 直方图,统计亚二倍体峰比例变化。
3.5 Foxp3 在CD4+CD25+T 细胞表达强度的流式细胞术检测 (1)分离外周血CD4+CD25+T 细胞后,调整细胞浓度为1 ×109/L,取100 μL 细胞悬液(1 ×105细胞)加入新配制的固定/透膜液1 mL,4 ℃避光反应60 min,洗涤2 次,离心后弃上清。(2)加入PE-Cy5 标记抗人Foxp3 抗体20 μL,4 ℃避光孵育30 min,洗涤后离心弃上清。(3)调整细胞浓度,用流式细胞仪检测,于FSC-SSC 点图设矩形门R1 排除碎屑,做Foxp3 直方图并记录其均值,CellQuest 软件获取并分析数据。
4 统计学处理
采用SPSS 13.0 软件进行独立样本t 检验。数据以均数±标准差(±s)表示,以P <0.05 为差异有统计学意义。
结 果
1 外周血CD4 +CD25 +T 细胞的纯度检测
健康人外周血CD4+CD25+T 细胞的纯度为77.4% ~92.3%,哮喘患者CD4+CD25+T 细胞的纯度为75.2% ~93.8%,见图1。

Figure 1. Purity of CD4 +CD25 +T cells detected by flow cytometry. A,B:heath group;C,D:asthma group.图1 外周血CD4 +CD25 +T 细胞纯度的流式细胞仪检测
2 CD4 +CD25 +T 细胞占外周血CD4 +T 细胞的比例
在健康人中的比例为4.12% ~7.98%,在哮喘患者中的比例为4.51% ~8.68%,流式细胞术检测见图2,两者相比,差异没有统计学意义(P >0.05)。

Figure 2. Ratio of CD4 +CD25 +T of CD4 +T cells detected by flow cytometry.A,B:health group;C,D:asthma group.图2 外周血CD4 +CD25 +T 占CD4 +T 细胞比例的流式细胞术检测
3 镁(10 mmol/L)对健康人及哮喘患者外周血CD4 +CD25 +T 细胞Foxp3 表达的影响
经镁(10 mmol/L)干预后,哮喘组CD4+CD25+T 细胞培养72 h,Foxp3 表达强度与健康对照组相比,P >0.05,提示镁(10 mmol/L)对哮喘组外周血CD4+CD25+T 细胞的Foxp3 表达无影响,见图3。
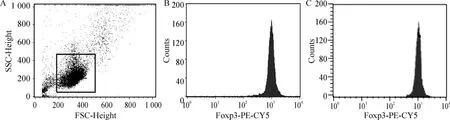
Figure 3. Foxp3 expression in CD4 +CD25 + T cells after magnesium treatment detected by flow cytometry.A:evacuation of the debris;B:Foxp3 expression in asthma group;C:Foxp3 expression in health group.图3 镁处理后外周血CD4 +CD25 + T 细胞Foxp3 表达的流式细胞术检测
4 镁(10 mmol/L)对外周血CD4 +CD25 +T 细胞凋亡的影响
经镁(10 mmol/L)干预后,CD4+CD25+T 细胞培养72 h,流式细胞术检测凋亡率见图4,健康组与哮喘组分别与阴性对照组相比,P <0.05,提示镁(10 mmol/L)可以诱导健康人及哮喘患者外周血CD4+CD25+T 细胞凋亡率增加,见表1,而镁(10 mmol/L)干预组的72 h 外周血CD4+CD25+T 细胞的凋亡率在哮喘组与健康组中没有显著差异(P >0.05)。

Figure 4. Apoptosis of CD4 +CD25 + T cells after magnesium treatment detected by flow cytometry.A,B:evacuation of the debris;C:asthma group;D:health group.图4 镁处理后外周血CD4 +CD25 + T 淋巴细胞凋亡的流式细胞术检测
表1 镁对外周血CD4 +CD25 +T 细胞凋亡率的影响Table 1. Effects of magnesium (10 mmol/L)on apoptotic rate of CD4 +CD25 +T cells (%. ±s.n=12)

表1 镁对外周血CD4 +CD25 +T 细胞凋亡率的影响Table 1. Effects of magnesium (10 mmol/L)on apoptotic rate of CD4 +CD25 +T cells (%. ±s.n=12)
* P <0.05,**P <0.01 vs blank.
Group Asthma Health Magnesium 11.68 ±4.91** 10.76 ±3.77*Blank 8.07 ±4.90 8.83 ±4.25
讨 论
镁离子(magnesium ion,Mg2+)抑制钙内流,减少细胞内钙离子浓度,拮抗钙离子对支气管平滑肌的作用,从而使支气管扩张;镁离子使运动神经末梢乙酰胆碱的释放量减少,对抗乙酰胆碱对平滑肌细胞的兴奋作用,直接舒张平滑肌,改善气道狭窄,从而改善肺的通气和换气功能;临床实验证明硫酸镁还可降低气道高反应性,抑制非特异性炎症反应,预防及改善哮喘患者的气道重塑,提高其气流受限的可逆化程度,从而预防和缓解哮喘症状[1-2]。在本课题组的前期研究中,亦证实应用镁剂可明显改善哮喘患者的肺功能[3],细胞内镁缺乏的C57BL/6 哮喘小鼠肺组织β2受体表达减少,在激动剂作用下更易发生β2受体低调节[4]。
目前对支气管哮喘免疫调节方面的研究已成为热点,近年来认为CD4+T 细胞除了Th1、Th2 等外还包括多种调节性T 细胞亚群,均在哮喘患者的免疫调节中起重要作用。Treg是指能够控制或抑制其它细胞功能的T 细胞群体,其中CD4+CD25+Treg 最受关注,是通过胸腺产生的功能成熟的T细胞亚群,约占外周血中CD4+T 细胞的5% ~10%[5],是Treg 的主要组成部分。目前多个研究表明,CD4+CD25+Treg的数量或功能异常有可能导致多种自身免疫性疾病的发生[6-7],因此对CD4+CD25+Treg 的研究有重要意义。然而对CD4+CD25+Treg 还缺乏足够的认识,其作用机制及免疫生物学特性尚有许多不明之处,如能在体内外有效诱导、扩增和控制CD4+CD25+Treg 数量或调节其细胞功能,将会为支气管哮喘的治疗提供新思路。
本实验中,CD4+CD25+T 细胞占外周血CD4+T 细胞的比例在健康人和哮喘患者中的比例无统计学差异,可能与本文选用的哮喘患者部分为非急性发作患者有关,但经镁剂处理后,健康组和哮喘组的CD4+CD25+Treg 凋亡均增加,哮喘组的凋亡率高于健康组,但由于哮喘急性发作者数量少(只有8 例),故差异不显著,但仍然提示适当补充镁剂对于CD4+CD25+Treg 的凋亡有正调节作用,可能对于哮喘急性发作患者作用尤为明显。
近年研究认为转录因子Foxp3 是CD4+CD25+Treg 的一个相对特异性标记,与其的发育和功能有关[8],Foxp3 作为一特殊的转录因子特异地高表达于CD4+CD25+T 细胞,有研究认为其数量可以反映CD4+CD25+T 细胞的水平和功能活性[9]。但也有研究认为Foxp3 对于CD4+CD25+Treg 的产生或活化是必需的,但不足以影响其功能,可能还存在其它因素的调节[10]。
本实验中,硫酸镁可以诱导健康人及哮喘患者外周血CD4+CD25+T 细胞72 h 的凋亡率增加,但不影响Foxp3 的表达,表明硫酸镁调节凋亡的作用与机体的疾病状态(哮喘)不相关,具有广泛调节作用,有可能应用于其它免疫相关疾病,而且与Foxp3 的表达不相关。本文进行了离体细胞镁剂共培养的实验,但未进行镁剂治疗哮喘的人体试验以及动物实验,有待下一步的研究以证实镁剂治疗哮喘的作用机制之一为调节CD4+CD25+T 细胞的凋亡。
[1] Jones LA,Goodacre S. Magnesium sulphate in the treatment of acute asthma:evaluation of current practice in adult emergency departments[J]. Emerg Med J,2009,26(11):783-785.
[2] Bichara MD,Goldman RD. Magnesium for treatment of asthma in children[J]. Can Fam Physician,2009,55(9):887-889.
[3] 江山平,李依群,曾志勇,等.以等渗硫酸镁溶液为溶媒吸入沙丁胺醇对哮喘发作期患者肺功能的影响[J].中华内科杂志,2002,41(1):54-55.
[4] 张 蔚,江山平,李元广,等.C57BL/6 哮喘小鼠细胞内镁含量与肺组织β2受体mRNA 表达的相关性研究[J].中国病理生理杂志,2008,24(7):1394-1398.
[5] Picca CC,Caton AJ.The role of self-peptides in the development of CD4+CD25+regulatory T cells[J]. Curr Opin Immunol,2005,17(2):131-136.
[6] 庄 鹏,王湘郴,罗国辉,等. 慢性乙肝患者外周血CD4+CD25+FOXP3+Tregs 及HBV 抗原特异性CTLs 的检测和分析[J]. 中国病理生理杂志,2011,27(9):1786-1789.
[7] 汪礼坤,匡 铭,彭宝岗,等. Tregs 调节小鼠肝癌局部引流淋巴结内免疫效应细胞的功能[J]. 中国病理生理杂志,2010,26(5):922-927.
[8] Yi H,Zhen Y,Jiang L,et al. The phenotypic characterization of naturally occurring regulatory CD4+CD25+T cells[J]. Cell Mol lmmunol,2006,3(3):189-195.
[9] 陈莉娟,周 浩,朱剑文,等. Foxp3 转染小鼠CD4+CD25-T 细胞抑制NK 细胞活性[J]. 中国病理生理杂志,2009,25(6):1151-1155.
[10] Brunkow ME,Jeffery EW,Hjerrild KA,et al. Disruption of a new forkhead/winged-helix protein,scurfin,results in the fatal lymphoproliferative disorder of the scurfy mouse[J]. Nat Genet,2001,27(1):68-73.
