α-羟基酸类物质的酶法还原
2012-12-22吕丹青张朝晖陈振明
吕丹青,张朝晖,陈振明
(1.杭州师范大学生物催化研究室,浙江杭州 311121;2.浙江工业大学生物与环境工程学院,浙江杭州 310032)
α-羟基酸类物质的酶法还原
吕丹青1,2,张朝晖2,陈振明1
(1.杭州师范大学生物催化研究室,浙江杭州 311121;2.浙江工业大学生物与环境工程学院,浙江杭州 310032)
手性纯α-羟基酸类化合物是合成手性药物和农药的重要中间体.多种酶催化过程都能用于α-羟基酸类物质的合成.酮还原酶是最有应用价值的工具酶之一.文章对酮还原酶还原合成α-羟基酸类物质进行综述.
α-羟基酸;酮还原酶;手性合成
α-羟基酸类物质是化学和制药工业中的重要手性中间体,其不对称合成路线的研究得到了很大关注.用金属复合物等纯化学法进行有机合成往往需要强酸、高温等条件,对环境不友好,或存在转化率和选择性低等缺点.酶催化可在水溶液中反应,所需条件温和,环境和经济问题都能得到有效解决,而且能产生更高化学、立体和区域选择性的产物.近年来,随着制药工业对包括α-羟基酸类物质在内的手性化合物需求的日益增长和人类环保意识的增加,酶催化工艺作为一种绿色的手性技术,已成为化学制药领域中研究和应用的热点之一[1].
多种酶催化过程都能用于α-羟基酸类物质的合成.以合成(R)-扁桃酸为例,可采用酶法拆分、不对称转化和手性还原等方法[2].酮还原酶作为一种工具酶,已经在很多手性醇的工业合成中得到了应用[3].文章拟对利用酮还原酶还原合成α-羟基酸类物质进行综述.
1 酮还原酶的来源
一个方便易用的酶库及相应的高效筛选方法是生物催化得以大规模工业化应用的前提条件之一.Saccharomycescerevisiae[4],Candidamagnoliae(酵母)[5],Thermoanaerobactorbrockii(厌氧细菌)[6],Geotrichumcandidum(真菌)[7],放线菌[8]以及多种植物(胡萝卜、马铃薯、甘薯等)[9]和红藻[10]、小球藻[11]中都已经发现有酮还原酶能用于手性羟基酸类物质的制备.
由于热稳定性是衡量生物催化剂的关键指标,嗜热微生物将成为酮还原酶的重要来源.
1.1 产酶微生物的筛选和酶基因的克隆表达
利用传统的方法进行微生物筛选仍是得到酮还原酶的主要途径之一.例如,通过对191种细菌、59种放线菌、230种酵母、81种霉菌和42种担子菌的筛选,得到三株菌(Rhodotorulaminuta、Candidaparapsilosis和Aspergillusniger)能高选择性地不对称还原二氢-4,4-二甲基-2,3-呋喃二酮,生成D-(—)-泛酰内酯[12-13].Candidaparapsilosis可以不对称还原产生S型的β,γ-不饱和/饱和α-羟基酯(图1),反应具有高选择性(ee值为93%~99%)和高产率(58%~71%)[14].
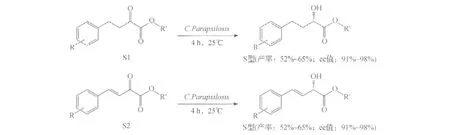
图1 Candidaparapsilosis对α-酮酸类物质的手性还原Fig.1 The asymmetric reductions ofα-hydroxy acids by Candidaparapsilosis
1.2 Genome mining
随着基因组信息的指数增长,数据库挖掘正成为生物催化剂的一个重要来源,即通过研究比较在线数据库的信息发现新酶,包括基因信息(核酸序列为基础)和酶(通常根据测到的活性分析).原先,遗传信息和酶活性多为独立收集的,但现在的资源都是综合交叉的.蛋白(酶)和核酸序列间的信息关联,说明生物信息学(应用数学和计算机技术进行序列信息分析)的日益重要.
R.Machielsen[15]根据3条已发现的Pyrococcusfuriosus来源的酮还原酶,分析P.furiosus的基因组,从中找到了16条可能表达酮还原酶的基因.其中AdhD在E.coli中表达,研究其酶学性质,发现AdhD具热稳定性(活性随温度升高而增强,100℃下半衰期为130min),具广谱底物活性,能选择性还原包括α-酮酯在内的多种酮类物质[16].
1.3 宏基因组研究
环境样品中不到1%的微生物能利用传统微生物培养技术实现纯培养.随着分子生物学技术的进步,各种高通量筛选方法的建立,宏基因组研究逐渐成为新酶发现的重要工具.
在构建宏基因组DNA文库的基础上进行筛选可比较容易地筛选到新酶.如在一个以筛选能催化短链多元醇氧化形成羰基的氧化还原酶为目的的研究中[17],以3种土样(草地、甜菜场、农田)的宏基因组建立文库,得到约1 267 000个克隆(DNA大小约为4.05Gbp),筛选得到6个克隆能催化形成羰基,也能还原二羟基丙酮、乙醇醛、丙酮醛等羰基.但是,可用于酮酸类化合物还原的酶还没有文献报道.
2 酶催化反应的进一步优化
在筛选获得适于催化反应的某个酶后,往往还需要进一步改造.改造可从催化剂本身、反应底物和反应环境等方面来考虑.
2.1 酶改造
通过突变改进酶性能主要有两种策略[18]:1)理性突变,如点突变和定点饱和突变;2)随机突变,如定向进化(模拟自然进化过程,随机改变氨基酸,构建酶库,从中选择所需蛋白).当酶的结构未知或无法预测,随机突变是唯一的选择.
Candidatenuis来源的木糖还原酶对多种芳香族α-酮酯具选择性还原能力,ee值大于99%,但是活性较低.为了提高活性,将其23位的Trp突变为Phe和Tyr,得到突变体W23F和W23Y.检测显示突变体具有比野生型高8倍的还原能力,同时选择性和ee值不变[19].
Bacillusstearothermophillus来源的乳酸脱氢酶(bsLDH)对α-酮酸类物质有手性还原能力,在存在激活剂果糖-1-6-二磷酸(FBP)时其Km为0.05mM,而无FBP时Km为5mM.FBP价格昂贵,难以放大工艺.定向进化bsLDH,经过三轮随机突变后得到一突变体6A,其在无FBP的条件下Km为0.07mM.分析发现,6A有3个非活性位点的突变(R118C,Q203L和N307S),这三点突变使酶对底物的亲和力大大增强,摆脱酶对激活剂的依赖[20].
另外,由于NADH价格相比NADPH更为便宜,可将NADPH依赖的酮还原酶经点突变改造成对NADH依赖,使反应更经济[21].
2.2 酶固定化
酶的固定化是改进酶的可操作性和回收利用的最有效的方法之一.Yunling Bai等[22]将D-乳酸脱氢酶(LDH)与Candidaboidinii细胞同时固定于聚乙烯亚胺,手性还原2-氧代-4-苯基丁酸(OPBA)生成R-2-羟基-4-苯基丁酸(R-HPBA).反应中由C.boidinii细胞内的甲酸脱氢酶提供NADH循环,比游离甲酸脱氢酶更稳定,制备更方便.R-HPBA的时空产率可达到9g/L·h,产物产率有0.95mol/mol OPBA.
2.3 介质工程
生物催化剂能在多种介质中催化反应.非水介质(CO2、离子流等)能控制选择性,也能改进反应体系的环境友好程度.在某些情况下,有机溶剂也能改变反应的立体选择性.如图2所示,面包酵母在水相中还原2-氧代己酸乙酯,能得到相应的R-和S-醇产物,由于R-产物的进一步不对称分解,最后得到的主要产物是S-产物.但是,当反应体系为苯时,底物高产地被还原为R-产物.这是因为底物在苯层中溶解良好,使得酶周围水层中的有效底物浓度降低了.所以,当细胞中有多种酶具有重叠的底物特异性,但却是不同的选择性时,就可以通过改变底物浓度来选择由哪种酶催化反应,因为酶反应遵循米氏方程:具有低Km的酶选择催化低浓度的底物,反之高Km、高Vmax的酶催化高浓度的底物[23].

图2 面包酵母在水相和苯中的还原反应Fig.2 The asymmetric reduction of ketones by baker's yeast in water and in benzene
2.4 底物修饰
一个生物催化还原反应的选择性可以通过改变底物而改变,因为还原反应很大程度上受到底物结构的影响.以面包酵母还原4-氯乙酰乙酸酯为例,酯基的长度决定了还原反应的选择性.当底物的酯基小于丁基时得到的是S型底物,大于戊基时得到的是R型产物.所以只要在还原反应后对酯基进行改造,就可以得到任何一种手性的4-氯乙酰乙酸酯[24-26].
3 酮还原酶在α-羟基酸类物质合成中的应用
近年来,随着对酮还原酶多功能催化作用的深入研究,已开发了多种α-羟基酸类物质的酶法合成工艺.
R-邻氯扁桃酸甲酯是合成血小板凝集抑制剂氯吡格雷的重要中间体,Tadashi Ema等[27]将Saccharomycescerevisiae来源的羰基还原酶SCR和葡萄糖脱氢酶在E.coli中共表达构建重组菌,还原产生R-邻氯扁桃酸甲酯.20℃,2g底物(1.0M)得到产物质量浓度高达178g/L,ee>99%.此工艺易放大,100mL反应体系中含20g底物,20℃反应24h能得到15g手性纯R-邻氯扁桃酸甲酯.
紫杉酚(taxol)是抗有丝分裂抑制剂,是治疗癌症的有效、常用药物.其合成过程中的一个关键前体是手性C13侧链紫杉醇.可用酵母Hansenulapolymorpha和Hansenulafabianii对酮酯a进行选择性还原(图3)[28],其产率都大于80%(ee>94%).H.polymorpha催化得到20%的非对映体产物,而H.fabianii的是10%.但是H.polymorpha催化的ee有99%,而H.fabianii的是94%.已用H.fabianii建立了15L级的单级发酵/生物还原工艺.

图3 酵母催化生成手性C13侧链紫杉酚Fig.3 Enzymatic synthesis of chiral C-13side-chain paclitaxel by yeast
4 结 论
酶制剂是生物技术领域最重要的产品之一,在制药、农业、食品等产业中的应用广泛.随着基因组信息的指数增长,生物催化的应用潜力正在迅速实现.手性α-羟基酸类化合物是化学和制药业中重要的结构单位,利用酮还原酶合成这类化合物的研究已成为近几年来生物催化领域一个备受瞩目的焦点.
[1]卢小春,赖敦岳,裴曾飞,等.α-苯乙醇的酶法拆分工艺优化[J].杭州师范大学学报:自然科学版,2010,9(4):252-256.
[2]Gröger H.Enzymatic routes to enantiomerically pure aromatic alpha-hydroxy carboxylic acids:A further example for the diversity of biocatalysis[J].Adv Synth Catal,2001,343:547-558.
[3]Chen Zhenming,Tao Junhua(Alex).Emerging enzymes and their synthetic applications[M]//Tao Junhua(Alex),Kazlauskas R.Biocatalysis for Green Chemistry and Chemical Process Development.New York:John Wiley &Sons,Inc,2011:45-65.
[4]Jung J,Park H J,Uhm K,etal.Asymmetric synthesis of(S)-ethyl-4-chloro-3-hydroxy butanoate using aSaccharomycescerevisiaereductase:Enantioselectivity and enzyme-substrate docking studies[J].Biochimica et Biophysica Acta,2010,1804(9):1841-1849.
[5]Wada M,Kataoka M,Kawabata H,etal.Purification and characterization of NADPH-dependent carbonyl reductase,involved in stereoselective reduction of Ethyl 4-Chloro-3-oxobutanoate,fromCandidamagnolia[J].Biotechnol Biochem,1998,62(2):280-285.
[6]Sonnleitner B,Fiechter A.Application of immobilized cells ofThermoanaerobiumbrockiifor stereoselective reductions of oxo-acid esters[J].Appl Microbiol Biotechnol,1986,23(6):424-429.
[7]Chen Yongzheng,Xu Jinggang,Xu Xiaoyng,etal.Enantiocomplementary preparation of(S)-and(R)-mandelic acid derivatives viaαhydroxylation of 2-arylacetic acid derivatives and reduction ofα-ketoester using microbial whole cells[J].Tetrahedron:Asymmetry,2007,18(21):2537-2540.
[8]Ishihara K,Yamaguchi H,Omori T,etal.A novel zinc-containingα-keto ester reductase from actinomycete:an approach based on protein chemistry and bioinformatics[J].Biotechnol Biochem,2004,68(10):2120-2127.
[9]Utsukihara T,Watanabe S,Tomiyama A,etal.Stereoselective reduction of ketones by various vegetables[J].Journal of Molecular Catalysis B:Enzymatic,2006,41(3/4):103-109.
[10]Utsukihara T,Misumi O,Kato N,etal.Reduction of various ketones by red algae[J].Tetrahedron:Asymmetry,2006,37(44):1179-1185.
[11]Ishihara K,Iwai R,Yoshida M,etal.Purification and characterization of a novel keto ester reductase from the green alga,Chlorella sorokiniana:comparison of enzymological properties with other microbial keto ester reductases[J].World Journal of Microbiol Biotechnol,2011,27(1):17-24.
[12]Shimizu S,Hata H,Yamada H.Reduction of ketopantoyl lactone to D-(—)-pantoyl lactone by microorganisms[J].Agric Biol Chem,1984,48:2285-2291.
[13]Kataoka M,Shimizu S,Doi Y,etal.Microbial production of chiral pantothenonitrile through stereospecific reduction of 2′-ketopantothenonitrile[J].Biotechnol Letters,1990,12:357-360.
[14]Baskar B,Pandian N G,Priya K,etal.Asymmetric reduction of alkyl 2-oxo-4-arylbutanoates and-but-3-enoates byCandida parapsilosisATCC7330:assignment of the absolute configuration of ethyl 2-hydroxy-4-(p-methylphenyl)but-3-enoate by1H NMR[J].Tetrahedron:Asymmetry,2004,15(24):3961-3966.
[15]Machielsen R,Uria A,Kengen S,etal.Production and characterization of a thermostable alcohol dehydrogenase that belongs to the aldo-keto reductase superfamily[J].Applied and Environmental Microbiology,2006,72(1):233-238.
[16]Zhu Dunming,Malik H,Hua Ling.Asymmetric ketone reduction by a hyperthermophilic alcohol dehydrogenase.The substrate specificity,enantioselectivity and tolerance of organic solvents[J].Asymmetry,2006,17(21):3010-3014.
[17]Knietsch A,Waschkowitz T,Bowien S,etal.Construction and screening of metagenomic libraries derived from enrichment cultures:generation of a gene bank for genes conferring alcohol oxidoreductase activity onEscherichiacoli[J].Applied and Environmental Microbiology,2003,69(3):1408-1416.
[18]Chen R.Enzyme engineering:rational redesign vs.directed evolution[J].Trends in Biotechnology,2001,19(1):13-14.
[19]Kratzer R,Nidetzky B.Identification ofCandidatenuisxylose reductase as highly selective biocatalyst for the synthesis of aromatic alpha-hydroxy esters and improvement of its efficiency by protein engineering[J].Chem Commun,2007(10):1047-1049.
[20]Allen S,Holbrook J.Production of an activated form ofBacillusstearothermophilusL-2-hydroxyacid dehydrogenase by directed evolution[J].Protein Engineering,2000,13(1):5-7.
[21]Morikawa S,Nakai T,Yasohara Y,etal.Highly active mutants of carbonyl reductase S1with inverted coenzyme specificity and production of optically active alcohols[J].Biotechnol Biochem,2005,69(3):544-552.
[22]Bai Yunling,Yang Shangtian.Biotransformation of R-2-hydroxy-4-phenylbutyric acid by D-lactate dehydrogenase andCandidaboidiniicells containing formate dehydrogenase coimmobilized in a fibrous bed bioreactor[J].Biotechnol and Bioengineering,2005,92(2):137-146.
[23]Nakamura K,Yamanaka R,Matsuda T,etal.Recent developments in asymmetric reduction of ketones with biocatalysts[J].Tetrahedron:Asymmetry,2003,14(18):2659-2681.
[24]Zhou Bingnan,Gopalan A,VanMiddlesworth F,etal.Stereochemical control of yeast reductions.1.Asymmetric synthesis of L-carnitine[J].J Am Chem Soc,1983,105(18):5925-5926.
[25]Chen C,Zhou Bingnan,Girdaukas G,etal.Stereochemical control of yeast reductions.2.Quantitative treatment of the kinetics of competing enzyme systems for a single substrate[J].Bioorg Chem,1984,12(2):98-117.
[26]Shieh W,Gopalan A,Sih C.Stereochemical control of yeast reductions.5.Characterization of the oxidoreductases involved in the reduction of beta.-keto esters[J].J Am Chem Soc,1985,107(10):2993-2994.
[27]Ema T,Ide S,Okita N,etal.Highly efficient chemoenzymatic synthesis of methyl(R)-o-chloromandelate,a key intermediate for clopidogrel,viaasymmetric reduction with RecombinantEscherichiacoli[J].Advanced Synthesis &Catalysis,2008,350(13):2039-2044.
[28]Patel R,Banerjee A,Howell J,etal.Stereoselective microbial reduction of 2-keto-3-(N-benzoylamino)-3-phenyl propionic acid ethyl ester[J].Annals of the New York Academy of Sciences,1995,750(1):166-174.
Enzymatic Reduction ofα-Hydroxy Acids
LÜDan-qing,ZHANG Zhao-hui,CHEN Zhen-ming
(1.Lab of Biocatalysis,Hangzhou Normal University,Hangzhou 311121,China;
2.College of Biological &Environmental Engeering,Zhejiang University of Technology,Hangzhou 310032,China)
Chiralα-hydroxy acids are important intermediate for the synthesis of drugs and pesticides.Various enzymatic processes can be used into the synthesis ofα-hydroxy acids.Ketoreductase is the most useful enzymes.This paper summarized the synthesis ofα-hydroxy acids by ketoreductase.
α-hydroxy acids;ketoreductase;chiral synthesis
Q814.9
A
1674-232X(2012)01-0033-05
11.3969/j.issn.1674-232X.2012.01.007
2011-03-22
陈振明(1971—),男,副教授,主要从事生物催化和绿色化学研究.E-mail:zmchen05@gmail.com
