腐殖质AQS存在条件下腐败希瓦氏菌还原U()Ⅵ的特性
2012-12-14谢水波张亚萍刘金香刘迎九李仕友王劲松刘海燕
谢水波 ,张亚萍,刘金香,刘迎九,李仕友,王劲松,刘海燕
(1.南华大学 城市建设学院,衡阳 421001;2.南华大学 铀矿冶生物技术国防重点学科实验室,衡阳 421001)
我国铀矿冶普遍采用溶浸采矿工艺,产生了大量的尾矿砂和尾矿水。铀矿冶废水中常存在大量的235U、238Pu等放射性核素,Cr、Mn、Fe以及取代苯、氯化烃类天然有机物等[1-3],同时存在大量细菌等微生物。环境中的铀以难溶性的U(Ⅳ)和水溶性的U(Ⅵ)为主,U(Ⅵ)多以铀酰离子(UO22+)的形式在环境中迁移。在尾矿库微环境中,残余的 U(Ⅵ)、有机物、尾矿微生物等通过溶解、转化水动力作用等迁移,构成持久性、潜在的放射性污染和重金属毒害[4]。溶浸采矿理论的发展使铀的化学释放原理比较清晰,但微生物对铀的直接或间接影响比较复杂,许多问题尚不清楚。
在自然界中,腐败希瓦氏菌(Shewanella putrefaciens,S.putrefaciens)广泛分布,常见于铀尾矿地区有机质含量丰富的沉积底泥环境与地下厌氧环境中。LOVLEY等[5]发现了微生物呼吸的新模式—腐殖质呼吸,即呼吸链上的电子传递过程:在厌氧条件下,腐殖质还原菌通过氧化电子供体,偶联腐殖质或腐殖质模型物还原,从电子传递过程中贮存生命活动需要的能量。在厌氧环境中,腐败希瓦氏菌利用腐殖质作为电子穿梭体,使可还原态物质还原,如Fe(Ⅲ)[6-10]、Mn(Ⅳ)[9]、Cr(Ⅵ)[11]等重金属、硝酸盐[8]、有机污染物[8,10,12-15]等,且能促进U(Ⅵ)的生物还原[11-12,16]。上述发现对进一步研究铀矿冶中微生物对铀浸出的阻滞机理及含铀废水的生物处理具有重要意义。现有报道中,关于腐败希瓦氏菌降解偶氮类[10,14-16]有机物的较多,对其与U(Ⅵ)等放射性金属的作用机理报道较少。
本文作者以腐败希瓦氏菌为研究对象,探讨重金属及有毒有机物对其还原 U(VI)的影响,以及还原U(VI)的因素与机理,为揭示微生物对铀浸出的阻滞机理及铀矿冶废水的生物处理提供技术支持。
1 实验
1.1 材料
腐败希瓦氏菌:购自中国工业微生物菌种保藏管理中心,CICC编号为22940。
培养基:NH4Cl 0.3 g/L,NaHCO32.5 g/L,MgSO40.025 g/L,MgCl2·6H2O 0.4 g/L,KH2PO4· 7H2O 0.02 g/L,酵母抽提物0.01 g/L(提供少量维生素和微量无机盐)。
主要试剂:腐殖质模式物蒽醌-2-磺酸钠(Anthraquinone-2-sulfonate,AQS),分析纯,购自 Sigma公司;U3O8(分析纯),标准铀溶液采用 GBW04201方法配制;其他试剂均为分析纯。
仪器设备:T6紫外可见分光光度计(北京普析通用仪器有限责任公司生产)。
1.2 菌株的厌氧培养
实验装置如图1所示。在厌氧培养反应器中,用丁基橡胶塞密封培养瓶口,高纯氮气和二氧化碳混合气(V(N)2:V(CO)2=4:1)经过装有细菌过滤器的进气橡胶管充入到培养瓶中,此时出气管打开,充气时间≥15 min。充气完毕后,用夹子封住所有橡胶管,使瓶口的剩余空间充满混合气体。水封,快速将其密封,于 30 ℃在生化培养箱中静置培养。每次取样后,重新通气,以确保厌氧环境。

图1 厌氧培养装置Fig.1 Anaerobic culture device
1.3 U()Ⅵ的测定
样液预处理:用注射器从取样管抽取适量体积菌体样液,用细菌过滤器过滤,去除样液中悬浮菌体。
U(Ⅵ)的测定:采用国家标准GB6768-86分光光度法测定微量铀。
1.4 腐败希瓦氏菌还原U()Ⅵ实验
向 500 mL锥形瓶中分别加入上述培养液 400 mL、5 mmol/L乙酸钠和1 mmol/L AQS;用NaOH和HCI调节pH值,控制悬浮菌液OD600≈0.700 (约2.3 g/L,OD600指细菌悬浮液在600 nm波长处的吸光值),接种定量菌液到培养液中。
按1.2节操作后,定时取样分析,测定培养液中剩余U(Ⅵ)浓度。
U(Ⅵ)初始浓度影响实验:U(Ⅵ)的初始浓度为10~80 mg/L,设有浓度梯度。
她望着火苗,气得直跺脚,一边打自己的耳光,一边咒骂自己:“我真该死,我真该死哇,我为什么不清理灶门……”
菌体投加量影响实验:以悬浮菌液量表示,在0.50~10.0 mL的范围内,设置体积梯度。
AQS用量影响实验: AQS浓度为0~10 mmol/L,设置浓度梯度。
电子供体影响实验:以5 mmol/L的甲酸钠、乙酸钠、乳酸钠为外加电子供体,以无外加电子供体作空白。
在单因素实验中,研究确定 pH值对腐败希瓦氏菌腐殖质还原 U(Ⅵ)的影响,结果表明,pH 值约为7.0时,U(Ⅵ)还原效率较高。因此,在本研究中,主要实验均在初始pH值约为7.0条件下完成。
1.5 有毒物质对腐败希瓦氏菌还原U()Ⅵ的影响
有毒有机物对 U(Ⅵ)还原的影响:分别以 5 mmol/L甲苯、三氯乙酸和对硝基苯酚 3种有毒有机物作为电子供体,无外加电子供体作为空白,进行实验。
金属离子对 U(Ⅵ)还原的影响:分别加入一定浓度的Mn2+、Cr6+、Cu2+和Ca2+,以无外加金属离子培养液作为对照,进行实验。
其他实验操作同1.2节。
2 结果与分析
2.1 U()Ⅵ初始浓度对腐败希瓦氏菌还原U()Ⅵ的影响
目标菌株对U(Ⅵ)耐受性实验结果表明:当U(Ⅵ)的浓度为20 mg/L时,菌株的耐受性较好;当浓度为50 mg/L时,其生长受到较大抑制。当U(Ⅵ)初始浓度为50 mg/L时,仍具有一定的还原效果,这是因为培养基中微量的H2PO4-与U(Ⅵ)结合,起缓冲作用,降低了 U(Ⅵ)对菌体的生物毒性。当 U(Ⅵ)初始浓度为10 mg/L时,24 h内U(Ⅵ)的还原效率缓慢增加,推断该过程是磷酸铀酰分子缓慢被腐殖质还原的过程。LING 和SZYMANOWSKT[17]报道,在培养液中加入一定量EDTA后,吸附在菌体表面的U(Ⅵ)浓度升高,促进了U(Ⅵ)的还原。这也可以用来解释微量H2PO4-对U(Ⅵ)还原的促进作用。
当U(Ⅵ)的初始浓度为30 mg/L时,在24 h内,U(Ⅵ)的还原效率可达96%,具有较高的还原效率,以下实验均在此初始浓度条件下进行。

图2 U(Ⅵ)初始浓度对U(Ⅵ)还原的影响Fig.2 Effect of initial concentration of U(Ⅵ)on U(Ⅵ)reduction by S.putrefaciens
2.2 菌体投加量对腐败希瓦氏菌还原U()Ⅵ的影响

图3 菌体投加量对U(Ⅵ)的还原影响Fig.3 Effect of bacteria volume on U(Ⅵ)reduction by S.putrefaciens
图3所示为菌体投加量的实验结果。结果表明,在前10 h,U(Ⅵ)的还原效率随菌体投加量的增加均显著增大。当菌体投加量为2 mL时,U(Ⅵ)的还原效率达到最高,超过阈值,U(Ⅵ)还原效率随着菌体浓度的增加而略有降低。分 析认为,在腐败希瓦氏菌还原U(Ⅵ)的过程中,需要一定的营养物质、电子供体、AQS等,在适当的环境(配比)下,将出现较高还原效率。在最初阶段中,随着菌体量的增加,菌株间对营养物质的竞争作用增加,使得U(Ⅵ)的还原效率略有下降。24 h后,菌体投加量对U(Ⅵ)的还原效率的影响不大。
2.3 AQS用量对腐败希瓦氏菌还原U()Ⅵ的影响
AQS对腐败希瓦氏菌还原U(Ⅵ)的实验结果如 4和5所示。结果表明,不同浓度的AQS对腐败希瓦氏菌还原U(Ⅵ)的影响存在差异。

图4 AQS浓度对U(Ⅵ)还原的影响Fig.4 Effect of AQS concentration on U(Ⅵ)reduction by S.putrefaciens
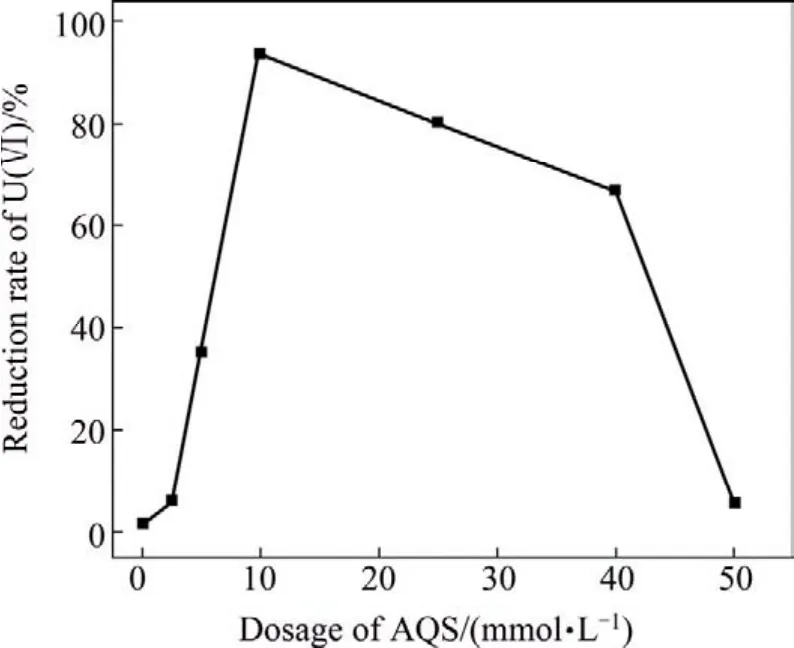
图5 12 h时AQS浓度对U(Ⅵ)的还原效率的影响Fig.5 Effect of AQS concentration on reduction of U(Ⅵ)in 12 h by S.putrefaciens
当AQS浓度在0~2 mmol/L范围时,能显著加速U(Ⅵ)的还原;当 AQS浓度为2 mmol/L时,在12 h内,可将溶液中U(Ⅵ)浓度从30 mg/L降至1.91 mg/L,U(Ⅵ)还原效率达90%以上;当其浓度高于2 mmol/L时,随着AQS浓度的增加,U(Ⅵ)还原效率下降,AQS对 U(Ⅵ)还原存在较强的抑制作用。这一结果表明,腐殖质的确可作为氧化还原中间体穿梭于电子供体与U(Ⅵ)之间,促进U(Ⅵ)的还原。但当其浓度达到某一阈值时,它与U(Ⅵ)存在电子竞争,使U(Ⅵ)还原效率反而下降。其原因在于其氧化还原电势存在差异,细菌呼吸链的电子载体对AQS和U(Ⅵ)的亲和力不同,使AQS浓度对U(Ⅵ)还原产生影响。
2.4 电子供体对腐败希瓦氏菌还原U()Ⅵ的影响
外加电子供体对腐败希瓦氏菌还原U(Ⅵ)的影响如图6所示。由图6可知,外加电子供体是影响腐败希瓦氏菌还原U(Ⅵ)的另一个重要因素。在12 h内,加入甲酸钠、乙酸钠和乳酸钠等外加电子供体的培养液,U(Ⅵ)的还原效率均在80%以上,与无外加电子供体的培养液相比,U(Ⅵ)的还原效率更高。外加电子供体不同,U(Ⅵ)的还原效率也略有差异。其原因如下:乳酸钠、甲酸钠和乙酸钠的氧化还原电势不同,如φΘ(乙酸钠)= -120 mV,φΘ(甲酸钠)=-430 mV[10],甲酸钠的失电子能力较乙酸钠的更强,细菌对甲酸钠的利用效率更高,因此,含甲酸钠的培养液中 U(Ⅵ)的还原效率也更高。在无外加电子供体培养液中也观测到一定的 U(Ⅵ)被还原,可能是溶液中存在的微量酵母菌膏充当了电子供体。

图6 电子供体对腐败希瓦氏菌还原U(Ⅵ)的影响Fig.6 Effect of electron donors on U(Ⅵ)reduction by S.putrefaciens
3 环境有毒物质对腐败希瓦氏菌还原U(Ⅵ)的影响
3.1 有毒有机物对腐败希瓦氏菌还原U(Ⅵ)的影响
在本实验中,分别以甲苯、三氯乙酸和对硝基苯酚为电子供体,考察其对腐败希瓦氏菌还原 U(Ⅵ)的影响,实验结果如图7所示。从图7可以看出,3种物质均可以作为电子供体支持 U(Ⅵ)的高效还原。在12 h内,菌体利用甲苯、三氯乙酸和对硝基苯酚腐殖质还原 U(Ⅵ)的效率分别达到 76.80%、94.89%和96.59%。与未加电子供体的培养液相比,显著地促进了U(Ⅵ)的还原。
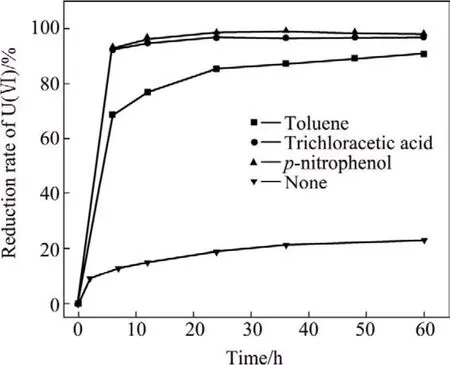
图7 有毒有机物对U(Ⅵ)还原的影响Fig.7 Effect of toxic organic compounds on U(Ⅵ)reduction by S.putrefaciens
图8所示为有毒有机物作为电子供体促进 U(Ⅵ)还原的原理图。腐败希瓦氏菌通过酶促反应氧化甲苯等有机物,AQS作为氧化还原中间体接受来自甲苯等提供的电子,其自身被还原,生成羟醌。还原态的AQS再将电子传递给U(Ⅵ),完成还原过程。随着AQS 氧化态与还原态形式的循环转换,对 U(Ⅵ)还原起明显的促进作用。同时, 甲苯失去电子被氧化降解为CO2[10]。许志诚等[15]在利用希瓦氏菌还原偶氮染料的实验中也有类似报道,推测存在更多有毒有机物质可以作为电子供体支持腐败希瓦氏菌腐殖质还原U(Ⅵ),但有待进一步的实验证明。这一工作对修复铀尾矿库区域的复合型污染具有一定的实用价值,对有毒有机物的降解具有重要的环境学意义。

图8 有毒有机物作为电子供体促进U(Ⅵ)还原的原理图Fig.8 Mechanism of AQS mediated reduction of U(Ⅵ)with exogenous carbon as electron donors
3.2 金属离子对腐败希瓦氏菌还原U()Ⅵ的影响
考察 Cu2+、Ca2+、Cr6+和 Mn2+对 U(Ⅵ)还原的影响,且研究菌株对各种离子的耐受性。结果表明,浓度为2.0 mmol/L的Cr6+、Cu2+和Mn2+均在菌株的耐受范围内。图9~11所示为金属离子作用下腐败希瓦氏菌还原 U(Ⅵ)的结果。结果表明,在 4种金属离子中,Ca2+和 Cu2+对 U(Ⅵ)的还原影响显著。与无外加金属离子相比,60 h内,2 mmol/L Ca2+使U(Ⅵ)的还原效率由97%降至42%。这可能是因为在水溶液中,Ca2+与U(Ⅵ)生成钙铀碳酸盐络合物,使U(Ⅵ)的活性键被占用。钙铀碳酸盐络合物稳定性较高,在 U(Ⅵ)接受电子时,U(Ⅵ)的活性键不易重新释放,从而降低了U(Ⅵ)的氧化还原活性,影响了U(Ⅵ)的生物还原[17-18]。

图9 重金属离子对U(Ⅵ)还原的影响Fig.9 Effect of heavy metal ions on U(Ⅵ)reduction by S.putrefaciens
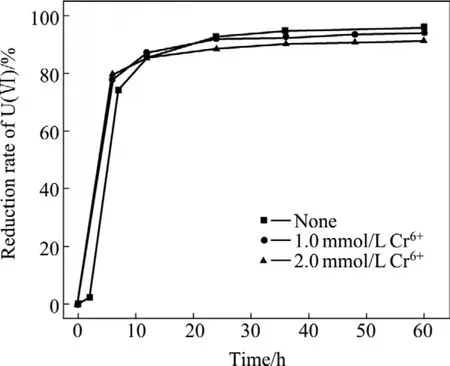
图10 Cr6+浓度对U(Ⅵ)还原的影响Fig.10 Effect of Cr6+ concentration on U(Ⅵ)reduction by S.putrefaciens

图11 Cu2+浓度对U(Ⅵ)还原的影响Fig.11 Effect of Cu2+ concentration on U(Ⅵ)reduction by S.putrefaciens
从图9和10可以看出,Mn2+和Cr6+对腐殖质还原U(Ⅵ)的影响较小。在60 h内,与没有外加重金属离子的实验样液对照,添加 1.0 mmol/L Cr6+、2.0 mmol/L Cr6+、2.0 mmol/L Mn2+于培养液中,U(Ⅵ)的还原效率分别降低了 1.85%、4.38%和 9.31%左右。VERRAMANI等[19]发现 Mn2+对微生物还原 U(VI)的成矿作用和反应生成的沥青铀矿结构均有一定影响。本研究采用二苯碳酰二肼法测定了培养液中Cr6+的浓度,未观察到Cr6+浓度的明显变化。这是因为在中性环境中,φΘ(Mn(Ⅱ)/Mn(s))=-1 029 mV、φΘ(Cr(Ⅵ)/Cr(Ⅲ))=-130 mV[11],而φΘ(U(Ⅵ)/U(Ⅳ))= +273 mV,Cr(Ⅵ)和 Mn(Ⅱ)的得电子能力远弱于 U(Ⅵ)的得电子能力。因此,在电子传递过程中,Cr6+和Mn2+对U(Ⅵ)还原影响较小。GU和 CHEN[11]研究结果表明,在pH=3的酸性环境中,Cr6+被AQS化学还原;但在中性环境中,Cr6+生物还原作用不明显,还原过程缓慢[20],与本研究结果基本一致。当环境变化时,Cr6+、Mn2+及 U(Ⅵ)的氧化还原电位也发生变化,可能会得到不同的实验结果。
当 Cu2+存在时,腐败希瓦氏菌对 U(Ⅵ)的还原结果如图11所示。从图11可以看出,Cu2+对U(Ⅵ)的还原具有强烈的抑制作用。当Cu2+浓度为2 mmol/L时,在60 h内,U(Ⅵ)的还原效率仅为12.7%。本课题组也研究了 Cu2+对硫酸盐还原菌(SRB)还原 U(Ⅵ)的影响[18,21],实验结果证明,Cu2+与呼吸链始端脱氢酶的FeS蛋白的活性中心相结合,破坏了蛋白的活性中心,从而使该蛋白质失去氧化电子供体的能力,降低了U(Ⅵ)的生物还原效率[22]。本研究更进一步证明了腐败希瓦氏菌腐殖质还原U(Ⅵ)的过程与电子传递链密切相关。
4 结论
1)在浓度为0~2 mmol/L范围内,AQS能显著加速菌体对U(Ⅵ)的还原。当AQS浓度为2 mmol/L 时,U(Ⅵ)的还原效率达到最大值,在12 h内,U(Ⅵ)还原效率可达90%以上;当AQS浓度高于2 mmol/L的浓度阈值时,随着AQS浓度的增加,U(Ⅵ)的还原效率逐步降低。
2)在厌氧条件下,腐败希瓦氏菌能利用多种有机酸盐作为电子供体,以AQS作为电子穿梭载体,高效还原U(Ⅵ)。当分别以5 mmol/L的甲酸钠、乙酸钠和乳酸钠作为腐败希瓦氏菌的外加电子供体时, U(VI)的还原效率由高到低的顺序为乳酸钠、甲酸钠、乙酸钠。
3)甲苯、三氯乙酸和对硝基苯酚3种物质均可以作为腐败希瓦氏菌还原 U(Ⅵ)的电子供体,且具有较高U(Ⅵ)还原效率。腐败希瓦氏菌还原U(Ⅵ)的同时,可将甲苯、三氯乙酸和对硝基苯酚氧化降解。
4)环境有毒物质对腐败希瓦氏还原U(Ⅵ)的影响较大。Cr6+、Mn2+、Cu2+和Ca2+4种金属离子对腐败希瓦氏菌还原 U(Ⅵ)的影响存在较大差异。Cu2+和 Ca2+对腐败希瓦氏菌还原U(Ⅵ)存在较强的抑制作用;Cr6+和 Mn2+对还原 U(Ⅵ)的影响相对较小。金属离子对U(Ⅵ)还原的影响强弱与其离子浓度正相关。
[1]徐乐昌, 薛建新, 高尚雄.铀矿冶设施退役治理中若干问题的探讨[J].辐射防护, 2007, 27(2): 111-118.XU Le-chang, XUE Jian-xin, GAO Shang-xiong.Several issues on the decommissioning of uranium mining/milling facilities[J].Radiation Protection, 2007, 27(2): 111-118.
[2]吕俊文, 杨 勇, 徐乐昌.我国西南某铀矿水冶尾矿库的退役治理[J].金属矿山, 2007, 7: 83-86.LUE Jun-wen, YANG Yong, XU Le-chang.Remediation of out-of-service tailing reservoir of a uranium mill in southwest China[J].Metal Mine, 2007, 7: 83-86.
[3]BLEISE A, DANESI P R, BURKART W.Properties, use and health effects of depleted uranium (DU): A general overview[J].Environmental Radioactivity, 2003, 64: 93-112.
[4]GAVRILESCU M, PAVEL L V, CRETESCU I.Characterization and remediation of soils contaminated with uranium[J].Hazardous Materials, 2009, 163: 475-510.
[5]LOVLEY D R, COATES J D, BLUNT HARRIS E L.Humic substances as electron acceptors for microbial respiration[J].Nature, 1996, 382: 445-448.
[6]EDWARD J, LOUGHLIN O.Effects of electron transfer mediators on the bioreduction of lepidocrocite(γ-FeOOH)byShewanella putrefaciensCN32[J].Environmental Science and Technology, 2008, 42: 6876-6882.
[7]CROSBY H, RODEN E.The mechanisms of iron isotope fractionation produced during dissimilatory Fe(Ⅲ)reduction byShewanella putrefaciensandGeobacter sulfurreducens[J].Geobiology, 2007, 5: 169–189.
[8]LUAN F, BURGOS W D.Bioreduction of nitrobenzene, natural organic matter, and hematite byShewanella putrefaciensCN32[J].Environmental Science and Technology, 2010, 44:184-190.
[9]DOLLHOPF M E, NEALSON K H, SIMON D M, LUTHER G W.Kinetics of Fe(Ⅲ)and Mn(Ⅳ)reduction by the Black Sea strain ofShewanella putrefaciensusing in situ solid state voltammetric Au/Hg electrodes[J].Marine Chemistry, 2000, 70:171–180.
[10]RAU J, KNACKMUSS H J, STOLZ A.Effects of different quinoid redox mediators on the anaerobic reduction of azo dye by bacteria[J].Environmental Science and Technology, 2002, 36:1497-1504.
[11]GU B H, CHEN J.Enhanced microbial reduction of Cr(Ⅵ)and U(Ⅵ)by different natural organic matter fractions[J].Geochimicaet Cosmochimica Acta, 2003, 63(19): 3575-3582.
[12]YOSHINORI S, KAZUYA T, NAOFUMI K, TOSHIHIKO O.Effects of citrate, NTA, and EDTA on the reduction of U(VI)byShewanella putrefaciens[J].Geomicrobiology Journal, 2010, 27:245-250.
[13]LUO Wen-sui, GU Bao-hua.Dissolution and mobilization of uranium in a reduced sediment by natural humic substances under anaerobic conditions[J].Environmental Science &Technology, 2009, 43: 152-156.
[14]LI T, GUTHRIE J T.Colour removal from aqueous solutions of metal-complex azo dyes using bacterial cells ofShewanella strainJ18-143[J].Bioresource Technology, 2010, 101: 4291-4295.
[15]许志诚, 洪义国, 罗 微, 陈杏娟, 孙国萍.中国希瓦氏菌D14T的厌氧腐殖质呼吸[J].微生物学报, 2006, 46(6):973-978.XU Zhi-cheng, HONG Yi-guo, LUO We, CHEN Xing-juan,SUN Guo-ping.Anaerobic humus respiration byShewanella cinicaD14T[J].Acta Microbiologica Sinica, 2006, 46(6): 973-978.
[16]许志诚, 洪义国, 罗 微, 许玫英, 孙国萍.厌氧条件下希瓦氏菌腐殖质还原对偶氮还原的影响[J].微生物学报, 2006,46( 4): 591-597.XU Zhi-cheng, HONG Yi-guo, LUO We, XU Mei-ying, SUN Guo-ping.The effects of the humic substances on azoreduct ion by Shewanella spp[J].Acta Microbiologica Sinica, 2006, 46(4):591- 597.
[17]LING Sheng, SZYMANOWSKI J.The effects of uranium speciation on the rate of U(Ⅵ)reduction byShewanella oneidensisMR-1[J].Geochimicaet Cosmochimica Acta, 2011,75: 3558-3567.
[18]谢水波, 王水云, 张浩江, 刘迎九, 王劲松.硫酸盐还原菌还原 U(Ⅵ)的影响因素与机制[J].环境科学, 2009, 30(7):1962-1967.XIE Shui-bo, WANG Shui-yun, ZHANG Hao-jiang, LIU Ying-jiu, WANG Jin-song.Efficiency and mechanism on reduction of U(Ⅵ)by sulfate reducing bacteria[J].Environmental Science, 2009, 30(7): 1962- 1967.
[19]VERRAMANI H, SCHOFIELD E J, SHARP J O, SUVOROVA E I, ULRICH K U, MEHTA A, GIAMMAR D E, BARGAR J R,BERNIER-LATMANI R.Effect of Mn(II)on the structure and reactivity of biogenic uraninite[J].Environmental Science and Technology, 2009, 43: 6541-6547.
[20]CHEN Hong, LI Xiao-juan, XU Zhi-wei.Cr(VI)remediation by enriched sediment with anthraquinone-2, 6-disulfonate as electron shuttles[J].Physics and Chemistry of the Earth, 2011,36: 451-454.
[21]LIU Yue-lin, XIE Shui-bo, LING Hui, WANG Wen-tao, LI Shi-you, LIU Ying-jiu.Influence and mechanism of Cu2+on removal of U(VI)by sulfate reducing bacteria[J].Advanced Materials Research, 2011, 236/238: 903-908.
[22]SANI R K, PEYTON B M, BROWN L T.Copper-induced inhibition of growth ofDesulfovirio desulfuricansG20:Assessment of its toxicity and correlation with those of zinc and lead[J].Applied and Environmental Microbiology, 2001, 67(10):4765-4772 .
