不同程度间歇性低氧大鼠海马区磷酸化JNK的表达及其意义
2012-12-06赵雅宁王红阳韩晓庆张盼盼
赵雅宁,王红阳,郭 霞,李 琳,韩晓庆,张盼盼
(1.河北联合大学康复医学院,河北 唐山063000;2.河北联合大学附属医院,河北 唐山063000)
不同程度间歇性低氧大鼠海马区磷酸化JNK的表达及其意义
赵雅宁1,王红阳2,郭 霞2,李 琳2,韩晓庆2,张盼盼2
(1.河北联合大学康复医学院,河北 唐山063000;2.河北联合大学附属医院,河北 唐山063000)
目的:探讨不同程度间歇性低氧大鼠海马区磷酸化JNK表达水平变化,阐明低氧大鼠认知功能障碍的发生机制。方法:96只雄性SD大鼠随机分成对照组和轻、中、重度间歇低氧组,每组24只。对照组大鼠暴露于空气中,不同程度间歇低氧组大鼠分别暴露于不同低氧条件(100、75和50 m L·L-1,暴露时间每天8 h,持续8周)。采用Western blotting和免疫组织化学法检测大鼠海马区磷酸化JNK蛋白表达水平;采用原位缺口末端标记(TUNEL)法检测各组大鼠凋亡细胞数量;采用Morris水迷宫法检测各组大鼠学习记忆功能。结果:与对照组比较,随低氧时间的延长,轻、中、重度间歇性低氧组大鼠海马区磷酸化JNK阳性细胞数和JNK蛋白表达水平均增加(P<0.05),TUNEL阳性细胞增多(P<0.05);水迷宫法检测,轻、中、重度间歇性低氧组大鼠逃避潜伏期时间延长和穿台次数减少(P<0.05)。与轻、中度间歇性低氧组比较,在重度间歇性低氧组TUNEL阳性细胞数增多,JNK蛋白表达水平和大鼠逃避潜伏期延长,穿台次数减少(P<0.05);轻、中度间歇性低氧组磷酸化JNK表达水平和TUNEL阳性细胞6周时达高峰,8周时降低,但组间各时间点比较差异无统计学意义(P>0.05);重度间歇性低氧组磷酸化JNK表达水平和TUNEL阳性细胞8周时达高峰,组间各时间点比较差异有统计学意义(P<0.05)。结论:不同程度间歇性低氧可导致大鼠认知功能损伤,其机制与激活大鼠海马区JNK、调控神经细胞凋亡有关。
有丝分裂原活化蛋白激酶;细胞凋亡;免疫组织化学;免疫印迹法;大鼠,SD;间歇性低氧
c-Jun氨基末端激酶(JNK)是有丝分裂原活化 蛋 白 激 酶(mitogen-activated protein kinase,MAPK)家族重要组成成员,活化后经多级激酶的级联反应将细胞外刺激信号向细胞内传递至细胞核,激活下游的激酶或多种转录因子,从而参与细胞各种生物化学反应。现已证实JNK信号活化在多种疾病,如动脉粥样硬化、脑卒中和神经退行性疾病等病理过程中起关键作用[1]。阻塞性睡眠呼吸暂停低通气 综 合 征(obstructive sleep ap1neahypopnea syndrome,OSAHS)是反复发生的低氧/再复氧为特征的慢性睡眠呼吸疾患,流行病学调查[2-3]显示:OSAHS可造成心脏、脑和肾脏等重要器官的损伤。本研究采用实时氧监测的反馈信号,以浓度结合时间切换的方式,模拟临床呼吸暂停事件的真实状态,研究不同间歇性低氧状态对海马区活化状态JNK(磷酸化JNK)表达、神经细胞凋亡和认知功能的影响,探讨JNK激活在OSAHS后认知功能损害中的作用,旨在为临床早期干预提供新思路。
1 材料与方法
1.1 实验动物、试剂及仪器 雄性SD大鼠96只(北京维通利华公司,合格证号:SCXK(京)2002-003),体质量310~350 g;多克隆磷酸化JNK抗体和内参β-actin购自Cell Signaling公司(美国),TUNEL试剂盒购自中杉生物有限公司(北京);H-7650透射电镜购自日本日立公司,Morris水迷宫视频跟踪分析系统购自中国医学科学研究院药物研究所,测氧仪购自建德市梅城电化分析仪器厂,低氧控制程序购自天津医科大学总医院呼吸科;纯氮购自天津六方气体高科技有限公司;低氧舱由天津医科大学研制。
1.2 动物分组及模型制备 96只雄性SD大鼠随机分为对照组和轻、中、重度间歇低氧组,每组24只。分别暴露低氧条件为100、75和50 mL·L-1。每天8:00~16:00将间歇低氧组实验动物置于模型舱内,向舱内循环充入氮气和空气,每次循环2 min,连续给予氮气30 s,分别维持舱内氧浓度最低至100、75和50 m L·L-1,随后均复氧至氧浓度为21%。对照组大鼠给予持续充入压缩空气。实验过程中以数字测氧仪监测舱内氧浓度变化,舱内氧浓度维持在各自的氧浓度内,使其氧浓度波动范围在±0.5%以内。实验结束将大鼠取出,送入常规饲养箱内自由饮水与摄食,生活环境和饲养条件相同。各组大鼠每天进行实验8 h,实验持续时间为8周;对照组大鼠暴露于正常空气中。分别在实验第2、4、6和8周进行Morris水迷宫测试和所设指标检测。
1.3 免疫组织化学法检测大鼠磷酸化JNK水平每组各时间点取3只动物,以0.4%戊巴比妥钠麻醉大鼠,开胸暴露心脏,4%多聚甲醛行心脏灌流,断头取脑,在视交叉后1和6 mm处冠状面切开,取中间块置4%多聚甲醛固定液固定,石蜡包埋,切片(片厚5μm)。切片常规脱蜡至水,枸橼酸盐微波修复,滴加磷酸化JNK抗体(1∶150),湿盒中4℃过夜,IgG抗体-HRP多聚体(PV二步法),置于37℃温箱30 min,DAB显色,脱水、透明、封片。以PBS代替一抗作阴性对照。镜下观察并摄片观察。
1.4 Western blotting法测定大鼠磷酸化JNK水平 每组各时间点取3只大鼠,致死后迅速取双侧海马区组织,称质量0.6 g,以4℃PBS充分洗涤,加入3倍体积4℃全细胞裂解液,冰浴中匀浆;4℃、12000 r·min-1离心5 min,取上清贮存于-80℃备用。考马斯亮蓝法检测各样本的JNK蛋白表达水平。检测步骤:40μg蛋白样品与等体积上样缓冲液混合,煮沸10 min,100 g·L-1十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭液室温下震荡2~3 h,加入磷酸化JNK抗体(1∶1500),4℃孵育过夜,TBST洗膜,37℃孵育1 h,TBST洗膜,ECL显色,以图像分析仪测定光密度,作定量分析。
1.5 TUNEL法检测大鼠原位细胞凋亡 标本以多聚甲醛固定,经过脱水、透明、浸蜡、包埋和切片,按TUNEL检测试剂盒说明书操作,DAB显色,苏木精复染。阳性率的定量分析:每个标本取4张切片,每张切片在海马区随机选取4个视野,在200倍光镜下应用目镜网格测试系统,计数阳性细胞,取均值。
1.6 大鼠学习和记忆功能检测 Morris水迷宫检测按照Smith等[4]报道的方法。每只大鼠晨起训练5次后分别在上午、下午各测试6次,分别记录各组大鼠逃避潜伏期时间和撤去平台后大鼠穿越原平台位置的次数,取检测记录的总均值。
1.7 统计学分析 应用SPSS 16.0统计软件对数据进行分析。各组大鼠JNK蛋白表达水平、TUNEL阳性细胞数量、逃避潜伏期和穿台次数以±s表示,多组间比较采用析因设计资料的方差分析,组内比较采用SNK-q分析。
2 结 果
2.1 各组大鼠磷酸化JNK蛋白表达水平 免疫组织化学分析:磷酸化JNK阳性表达产物主要位于细胞核,少量表达在细胞浆。对照组大鼠海马区只有极少量的阳性细胞,染色较淡。轻、中、重度间歇性低氧组大鼠海马区磷酸化JNK表达阳性细胞均呈不同程度增加,阳性细胞主要分布在海马易敏感区CA1区、其次在CA2、CA3区,齿状回也有少量分布。重度间歇低氧组大鼠磷酸化JNK阳性反应最强,染色最深;免疫印迹分析:与对照组比较,轻、中和重度间歇性低氧组海马区磷酸化JNK在各时间点均有不同程度增加(P<0.05);轻、中度间歇性低氧组磷酸化JNK表达水平在6周时达高峰,8周时表达水平降低,轻、中度间歇性低氧组内各时间点JNK蛋白表达水平比较差异有统计学意义(P<0.05);但轻、中度间歇性低氧组各时间点比较差异无统计学意义;重度间歇低氧组JNK表达8周达高峰,组内各时间点比较差异有统计学意义(P<0.05)。与轻、中度间歇低氧组比较,各时间点磷酸化JNK水平均显著增多(P<0.05)。见图1(插页三)、2和表1。
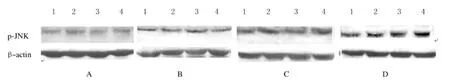
图2 各组大鼠海马区磷酸化JNK蛋白表达电泳图Fig.2 Electrophoretogram of expression levels of phosphorylated JNK protein in hippocampal region of rats in various groups
2.2 各组大鼠海马区神经细胞凋亡 TUNEL阳性产物主要位于细胞核。对照组大鼠海马区只有极少数阳性细胞,阳性细胞主要分布在海马易敏感区CA1区、其次在CA2、CA3区,齿状回也有少量分布。与对照组比较,轻、中、重间歇性低氧组大鼠海马区TUNEL阳性细胞在各时间点均不同程度增加(P<0.05);轻、中度间歇性低氧组TUNEL阳性细胞数量6周达高峰,8周时减少,轻、中度组组内各时间点比较差异有统计学意义(P<0.05);两组间比较差异无统计学意义;重度间歇低氧组TUNEL阳性细胞数量8周达高峰,组内各时间比较差异有统计学意义(P<0.05);与轻、中度间歇低氧组比较,重度间歇低氧组各时间点TUNEL阳性细胞数量均显著增多(P<0.05)。见图3(插页三)和表2。
表1 各组大鼠海马磷酸化JNK蛋白表达水平比较Tab.1 Comparison of the expression levels of JNK protein in hippocampus of rats between various groups (n=12,±s)

表1 各组大鼠海马磷酸化JNK蛋白表达水平比较Tab.1 Comparison of the expression levels of JNK protein in hippocampus of rats between various groups (n=12,±s)
*P<0.05 vs control group;△P<0.05 vs mild group;#P<0.05 vs moderate group;○P<0.05 vs 8 weeks in mild group;▭P<0.05 vs 8 weeks in moderate group;▲P<0.05 vs 8 weeks in severe group.
Group Expression level of JNK protein(t/week)2 4 6 8 Control 0.52±0.15 0.48±0.12 0.64±0.18 0.44±0.18 Intermittent hypoxia Mild 1.96±0.82*○ 2.49±0.96*○ 5.84±1.17*○ 3.58±1.02*Moderate 2.12±0.79*▭ 2.96±1.01*▭ 6.10±1.12*▭ 4.02±1.14*Severe 2.98±1.09*△#▲ 4.68±1.56*△#▲ 7.86±1.56*△#▲ 9.78±3.41*△#
表2 各组大鼠海马TUNEL阳性细胞数量比较Tab.2 Comparison of the TUNEL positive cell number in hippocampus of rats between various groups (n=12,±s)

表2 各组大鼠海马TUNEL阳性细胞数量比较Tab.2 Comparison of the TUNEL positive cell number in hippocampus of rats between various groups (n=12,±s)
*P<0.05 vs control group;△P<0.05 vs mild group;#P<0.05 vs moderate group;○P<0.05 vs 8 weeks in mild group;▭P<0.05 vs 8 weeks in moderate group;▲P<0.05 vs 8 weeks in severe group.
Group Number of TUNEL positive cells(t/week)2 4 6 8 Control 2.40±0.42 2.42±0.38 2.58±0.57 2.74±0.56 Intermittent hypoxia Mild 3.40±0.49*○ 4.39±0.73*○ 9.54±1.36*○ 6.10±0.72*Moderate 3.68±0.43*▭ 4.82±0.84*▭ 11.00±1.42*▭ 6.64±0.69*Severe 6.60±0.69*△#▲ 9.68±0.79*△#▲ 15.94±2.92*△#▲ 19.82±2.61*△#
2.3 各组大鼠学习记忆功能评估 与对照组比较,轻、中、重间歇性低氧组大鼠逃避潜伏期时间均延长、穿越原平台位置的次数均减少;轻度和中度组比较差异无统计学意义;与轻、中度组比较,重度间歇性低氧组逃避潜伏期时间延长、穿越原平台位置的次数减少(P<0.05)。见表3和4。
表3 各组大鼠逃避潜伏期的比较Tab.3 Comparison of escaping latency of rats between various groups (n=20,±s,t/s)

表3 各组大鼠逃避潜伏期的比较Tab.3 Comparison of escaping latency of rats between various groups (n=20,±s,t/s)
*P<0.05 vs control group;△P<0.05 vs mild group;#P<0.05 vs moderate group;○P<0.05 vs 8 weeks in mild group;▭P<0.05 vs 8 weeks in moderate group;▲P<0.05 vs 8 weeks in severe group.
Group Escaping latency(t/week)2 4 6 8 Control 25.66±2.97 25.40±3.00 24.96±2.98 25.29±3.07 Intermittent hypoxia Mild 32.76±2.02*○ 38.86±3.18*○ 49.64±4.71*○ 34.65±3.25*Moderate 34.08±2.24*▭ 40.24±2.96*▭ 52.36±4.66*▭ 36.72±3.44*Severe 49.17±8.87*△#▲ 56.47±6.98*△#▲ 62.15±7.44*△#▲ 68.42±7.91*△#
表4 各组大鼠穿台次数比较Tab.4 Comparison of frequency of crossing the platform of rats between various groups (n=20,±s)

表4 各组大鼠穿台次数比较Tab.4 Comparison of frequency of crossing the platform of rats between various groups (n=20,±s)
*P<0.05 vs control group;△P<0.05 vs mild group;#P<0.05 vs moderate group;○P<0.05 vs 8 weeks in mild group;▭P<0.05 vs 8 weeks in moderate group;▲P<0.05 vs 8 weeks in severe group.
Group Frequency of crossing the platform(t/week)2 4 6 8 Control group 11.57±2.18 10.94±2.40 10.78±1.70 10.65±1.26 Intermittent hypoxia Mild 9.12±1.18*○ 8.94±1.16*○ 6.32±1.12*○ 8.36±1.04*○Moderate 9.02±1.16*▭ 7.98±1.15*▭ 6.04±1.00*▭ 7.62±1.20*▭Severe 7.68±1.03*△#▲ 5.81±1.60*△#▲ 4.42±1.25*△#▲ 2.87±0.92*△#▲
3 讨 论
流行病学研究显示:OSAHS患者认知功能障碍主要表现为注意、集中、记忆和复杂问题解决能力等受损;OSAHS不仅是脑血管病的重要危险因素,同时OSAHS与阿尔茨海默病(AD)发病有密 切 关 联[5-6], 因 此 有 必 要 深 入 研 究 继 发 于OSAHS的神经损伤机制。海马是脑内认知形成的重要部位。神经影像学研究证实:OSAHS患者海马萎缩且海马的体积与学习记忆的改变存在线性正相关关系。本研究结果显示:低氧时间越长和低氧程度越重则海马区凋亡神经细胞越明显,同时水迷宫实验结果显示:大鼠搜索安全岛潜伏期时间明显延长,穿台次数明显减少,提示间歇低氧造成海马区神经元丢失是相应的脑功能障碍出现的关键环节。本研究中间歇性低氧3组大鼠学习记忆能力检测指标变化趋势表明:间歇性低氧损害学习记忆具有 “高度依赖形式”,与临床实际相符,即OSAHS病程越长,低氧程度越重,造成的认知功能损害程度越严重。本研究中重度间歇性低氧组和轻、中度间歇性低氧组中凋亡神经细胞变化存在下降趋势,可能是轻度和中度慢性间歇性低氧诱导了低氧耐受,启动大脑内部某些内源性保护机制,而重度慢性低氧状态下,组织难以对缺氧产生适应性调节,即处于缺氧应激状态,缺氧应激持续过久导致脑内转导信号持续处在紊乱状态,诱导细胞凋亡。
MAPKs信号通路是连接大多数细胞外信号与膜受体、转录因子和各基因调节的中央信号通路,其家族成员包括细胞外信号调节激酶(ERK)、JNK和p38 MAPK等。研究[7]显示:缺血/低氧、紫外线照射、细胞因子刺激和高渗透性休克等多种应激因素可激活MAPKs信号。有文献[8]报道:活化的JNK信号在多种疾病的病理进程中表现为负性调节作用,其可通过诱导炎症因子和促细胞凋亡因子的释放或表达产生损伤作用。全脑缺血-再灌注损伤模型中,抑制磷酸化JNK的表达,可有效地减轻全脑缺血-再灌注引起海马区域的神经细胞凋亡。老年痴呆的动物模型中,JNK活化与磷酸化Tau蛋白和淀粉样沉积有关,且JNK激活呈时间依赖性,并随粉样沉积的增加而增加[9]。本研究中随间歇性低氧时间的延长,轻、中、重度低氧动物海马区磷酸化JNK阳性细胞及其蛋白表达水平均增高,且重度间歇低氧组变化最为显著,说明JNK活化参与了间歇性低氧对神经损伤的病理过程。与轻、中度间歇性低氧组比较,重度间歇性低氧组磷酸化JNK表达水平持续增高趋势的原因,可能是不同程度低氧/再复氧,脑内氧化应激状态不同,脑内某些信号差异激活[10],导致重度间歇性低氧时JNK信号过度持续活化。本研究中磷酸化JNK和TUNEL阳性细胞在不同程度间歇性低氧组表达变化趋势一致,同时二者分布区域基本一致,提示间歇性低氧造成的神经细胞凋亡与JNK蛋白激活有关。有研究[11]显示:JNK活化后从胞质中转位入核通过磷酸化激活c-Jun、c-Fos和Elk-1等转录因子而调节下游凋亡相关靶基因如Fas L、TNF等配体蛋白启动死亡受体途径的细胞凋亡;亦可上调BH3-only蛋白如Bim、Bid的表达而活化Bax等促凋亡蛋白介导线粒体途径的细胞凋亡。在不同程度间歇性低氧状态下,JNK蛋白激活介导神经细胞凋亡的具体转录调控机制有待进一步研究。
综上所述,本实验证实了不同程度间歇性低氧可引起JNK蛋白激活、神经细胞凋亡,同时相对于轻度间歇性低氧,重度间歇性低氧更易于造成JNK过度活化,这在一定程度上揭示了OSAHS患者认知功能损害的机制。JNK蛋白激活参与了不同程度间歇性低氧神经损伤的病理机制,但在不同低氧条件下,JNK介导神经损伤的具体机制尚需进一步研究。
[1]Kim EK,Choi EJ.Pathological roles of MAPK signaling pathways in human diseases[J].Biochim Biophys Acta,2010,1802(4):396-405.
[2]Newman AB,Spiekerman CF,Enright P,et al.Daytime sleepiness predicts mortality and cardiovascular disease in older adults[J].J Am Geriatr Soc,2000,48(2):115-123.
[3]Mc Nicholas WT,Bonsignore MR.Management Committee of EU COST ACTION B26.Sleep apnea as an independent risk factor for cardiovascular disease:current evidence,basic mechanicisms and research priorities[J].Eur Respir J,2007,29(2):156-178.
[4]Smith DH,Okiyama K,Thomas MJ,et al.Evaluation of memory dysfunction following experimental brain injury using the Morris water maze[J].Neurotrauma,1991,8(4):259-269.
[5]Beebe DW, Groesz L, Wells C, et al. The neuropsychological effects of obstruncive sleep panea:a metaanalysis of norm-referenced and case-controlled data[J].Sleep,2003,26(3):298-307.
[6]Mitchell RB,Kelly J,Call E,et al.Lonng-term changes in quality of life after surgery for pedianic obstructive sleep apnea[J]. Arch Otolaryngol Head Neck Surg,2004,130(4):409-412.
[7]Weston CR, Davis RJ. The JNK signal transduction pathway[J].Curr Opin Cell Biol,2007,19(2):142-149.
[8]Ferrandi C,Ballerio R,Gaillard P,et al.Inhibition of c-Jun N-terminal kinase decreases cardiomyocyte apoptosis and infarct size aftermyocardial ischemia and reperfusion in anaesthetized rats[J].Br J Pharmacol,2004,142(6):953-960.
[9]Li LM,Liu QH,Qiao JT,et al.Abeta(31-35)-induced neuronal apoptosis is mediated by JNK-dependent extrinsic apoptosispathway[J].Neurosci Bull,2009,25(6):361-366.
[10]郭 军,朱 红,德 伟.丝裂原活化蛋白激酶ERKs和JNKs在脑缺血损伤中的差异激活及其调控机制[J].中国神经科学杂志,2004,20(3):217-221.
[11]Pan J,Zhao YX,Wang ZQ,et al.Expression of FasL and its interaction with Fas are mediated by c-Jun N-terminal kinase(JNK)pathway in 6-OHDA-induced rat model of Parkinson disease[J].Neurosci Lett,2007,428(2/3):82-87.
Expression of phosophorylated JNK in hippocampus of rats with different degrees of intermittent hypoxia and its significance
ZHAO Ya-ning1,WANG Hong-yang2,GUO Xia2,LI Lin2,HAN Xiao-qing2,ZHANG Pan-pan2
(1.College of Rehabilitation,Hebei United University,Tangshan 063000,China;2.Affiliated Hospital,Hebei United University,Tangshan 063000,China)
Objective To investigate the changes of expression levels of posophorylated JNK in hippocampus of rats with different degrees of intermittent hypoxia and to clarify the mechnism of cognitive dysfunction of hypoxia rats.Methods 96 male SD rats were randomly divided into control group(n=24),mild intermittent hypoxia group(n=24),moderate intermittent hypoxia group(n=24)and severe intermittent hypoxia group(n=24).The rats in control group were exposed in air,and the rats in intermittent hypoxia groups were exposed respectively in different intermittent hypoxia conditions(100,75 and 50 m L·L-1,8 h everyday for 8 weeks).The expression levels of phosphorylated JNK proteins were detected by immunohistochemistry and Western blotting methods;the number of apoptotic cells was measured by terminal deoxynucleotidyl transfernase medicated nick end labeling(TUNEL)method;the learning and memory functions were determined by Eight-arm maze.Results Compared with control group,the expression levels of phosphorylated JNK and the number of TUNEL-positive cells in intermittent hypoxia groups were increased obviously in a time-dependant manner(P<0.05);Water maze test showed that the escaping latency was prolonged and the frequency of crossing the platform was decreased in a time-dependant manner in mild,moderate and severe interminttent hypoxia group.Compared with mild,moderate intermittent hypoxia groups,the number of TUNEL positive cells was increased;the expression level of JNK protein was increased and the escaping latency was prolonged and the frequency of crossing the platform was decreased in severe intermittent hypoxia group(P<0.05).The expression levels of phosphorylated JNK and the numbers of TUNEL-positive cells reached peak at 6 weeks and reduced at 8 weeks in mild and moderate intermittent hypoxia groups and there were no significant difference between different time points in two groups(P > 0.05);the expression level of phosphorylated JNK and the number of TUNEL-positive cells reached peak at 8 weeks in severe intermittent hypoxia group and there were significant differences between different time points in sever intermittent hypoxia group(P<0.05).Conclusion Different degrees of intermittent hypoxia can cause cognitive dysfunction and its mechanism may be related to activating JNK in hippocampus of rats and regulating the neuronal apoptosis.
mitogen-activated protein kinases;apoptosis;immunohistochemistry;Western blotting method;rats,SD;intermittent hypoxia
R56
A
1671-587Ⅹ(2012)06-1135-06
2012-05-31
河北省科技厅科研基金资助课题(09276103D-11)
赵雅宁(1974-),女,河北省唐山市人,副教授,在读医学博士,主要从事呼吸系统疾病诊断及治疗研究。
王红阳(Tel:0315-3726234,E-mail:zyning789@126.com)
