染料木素对大鼠食饵性高脂血症PON1及CRP的影响
2012-12-06赵绿英刘玉玲李金兰高治平黄红林
赵绿英,刘玉玲,李金兰,高治平,黄红林
(南华大学药物药理研究所,湖南省高等学校药物蛋白质组学重点实验室,湖南衡阳 421001)
动脉粥样硬化(atherosclerosis,As)是多种心血管疾病的主要病理基础,其中高脂血症是诱发冠状动脉粥样硬化性心脏病的独立危险因素。机体长时间接触低剂量有机磷酸酯类(organophosphorus,OP)杀虫剂会导致血浆PON1活性和浓度明显下降,也与As等疾病的发生有关[1]。敌百虫是目前应用最广、接触人数最多的一种高效、低毒的有机磷类杀虫剂。本课题组已成功建立了低剂量敌百虫加速家兔食饵性As模型[2]。与家兔不同,大鼠对As有很强的抵抗力[3],仅用高脂饲料喂养等其他方法不易使大鼠形成As[4]。因此,本实验利用SD大鼠探索每日给予低剂量敌百虫加高脂饲料建立食饵性大鼠高脂血症模型,同时观察染料木素(genistein,Gen)的干预效应。
Gen是大豆植物雌激素中最主要的异黄酮,属多酚类化合物,其结构与17β-雌二醇(estradiol,E2)相似,能选择性结合雌激素受体产生与E2相似的脉管保护效应,却不出现雌激素引起生殖系统有关的不良反应如女性致癌副作用和男子女性化特征等,而且具有抑制肿瘤、抗氧化、抗骨质疏松和保护心血管等多方面的药理活性[5-6]。
利用高脂饲料喂养加敌百虫腹腔注射建立大鼠高脂血症模型以观察Gen的调节血脂等作用及与对PON1活性及CRP浓度关系,目前未见国内外有相似实验研究的报道。他汀类药物辛伐他汀具有明显可靠的降脂作用,对 As有很好的疗效[7],Sung等[8]利用体外实验证明Gen和他汀类调脂药一样也可以抑制羟甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA)还原酶,故此实验选用辛伐他汀作阳性药物对照进一步探讨Gen降脂作用机制,为Gen在心脑血管疾病防治方面的进一步开发利用提供理论基础。
1 材料
1.1 动物 健康SD大鼠,♀♂各半,40只,2月龄,体质量150~200 g,清洁级,购自南华大学实验动物中心。室温(20~25)℃ ,相对湿度55% ~70%。大鼠用标准颗粒饲料由南华大学实验动物中心提供。
1.2 主要药物与试剂 Gen(98%)浙大泛科(20070826)生产;辛伐他汀(98%)湖南康普药业股份有限公司(B2090774);丙硫氧嘧啶片,南通精华制药股份有限公司(090202);90%敌百虫原药,湖南沙隆达股份有限公司(20060707001),二甲基亚砜(DMSO),美国Sigma公司;乙酸苯酯,北京市庆盛达化工技术有限公司;乳胶C反应蛋白诊断试剂盒,德国罗氏诊断有限公司;微量MDA试剂盒,南京建成生物工程研究所;DAB显色试剂盒,北京中山生物技术有限公司。德国罗氏诊断有限公司TC等血脂检测试剂盒。
敌百虫应用液(1%)的配制[9-10]:先配成 10%的敌百虫母液,用新鲜且pH≤5.5的双蒸水(高压灭菌冷却)溶解90%的敌百虫原粉,涡旋混匀,过滤除菌,4℃保存。1%的敌百虫应用液即取10%的敌百虫母液1 ml,用新鲜且pH≤5.5双蒸水稀释10倍。
1.3 仪器和器材 UV/VIS DU-640紫外分光光度仪,美国Beckman公司;H7600全自动生化分析仪,德国罗氏公司;Nikon E200光学显微镜,日本Nikon公司。
2 方法
2.1 模型建立与给药 将40只SD健康大鼠适应性喂养1周后随机分为5组:①普食组:普食喂养,皮下注射10%DMSO的生理盐水(1 ml·kg-1·d-1);② 模型组;③ 低剂量Gen组;④ 高剂量Gen组;⑤辛伐他汀组;其中②~⑤均为高脂饲料喂养加敌百虫腹腔注射(10 mg·kg-1·d-1),并分别皮下注射 10%DMSO的生理盐水(1 ml·kg-1·d-1)、低剂量Gen、高剂量Gen及辛伐他汀溶液。连续给药并按上述饲料喂养8周,每2周为大鼠称1次体重以调整给药剂量。
2.2 血样、标本的采集与测定 在实验开始给药前(0周)和给药后第4、8周分别断尾采血:大鼠禁食10 h,称重;于次日清晨用5%水合氯醛(8 ml·kg-1)腹腔注射麻醉大鼠断尾采血,室温静置30 min后,3 000 r·min-1离心 30 min,收集血清,分批保存于-70℃冰箱中,备样。
上述血标本分别检测大鼠血清TC、TG、HDL-C、LDL-C、CRP含量、血清PON1活性、MDA浓度;全血AChE活性。
实验第8周末,大鼠禁食12 h,称重;于次日清晨用5%水合氯醛(8 ml·kg-1)腹腔注射麻醉大鼠,自主动脉瓣部至髂动脉剥离大鼠主动脉后,取主动脉弓约1 cm,固定于10%的甲醛固定液中;同时取肝脏正中叶相同部位横断面约1 cm3,使用10%的甲醛溶液固定;上述标本分别经脱水、透明、浸蜡、包埋后,连续切片,切片厚4 μm,HE染色使用,显微镜下观察大鼠主动脉弓及肝细胞脂质沉积等病理形态变化。
2.2.1 全血AChE活性测定 采血时留50 μl全血加以0.1%肝素钠抗凝的采血管中,用羟肟酸铁比色法检测全血AChE活性[11]。
2.2.2 血脂和C-反应蛋白检测 取血清上样于全自动生化分析仪,分别采用德国罗氏诊断有限公司试剂盒检测大鼠血清 TC、TG、HDL-C、LDL-C和CRP,并计算HDL-C/TC比值及AI值,由公式(1)计算:

2.2.3 血清PON1活性的测定 实验第4、8周末用乙酸苯酯法检测血清PON1活性。测定原理是PON1可将乙酸苯酯水解为乙酸和苯酚,苯酚在270 nm波长处有强吸收峰,在一定浓度内,其浓度与吸光度呈线性关系,单位时间内生成的苯酚量可反映PON1的活性[12]。采用乙酸苯酯法检测,以Eckerson等[13]的方法为基础并稍加改进,将乙酸苯酯加入反应缓冲液(0.1 mmol·L-1的 Tris-HCl缓冲液,2.0 mmol·L-1的 CaCl2,pH=8.0),于 25℃ 预温 6 min后,加入血清样本,反应2 min后用乙二胺四乙酸二钠终止反应,然后用美国Beckman UV/VIS DU-640紫外分光光度仪于270 nm波长测定吸光度值。以不同浓度的苯酚浓度为横坐标,相应的苯酚浓度的吸光度值为纵坐标,作标准曲线。按公式计算PON1活性。PON1酶活性单位定义为每分钟催化1 μmol乙酸苯酯水解所需的酶量为1 U(kU·L-1)。
2.2.4 血清MDA含量测定 过氧化脂质(LPO)用LPO降解产物MDA来衡量。采用微量MDA试剂盒,硫代巴比妥酸法检测血清MDA含量。
2.2.5 形态学观察 肉眼和HE染色后观察各组大鼠主动脉弓及肝脏病理形态学。
2.2.6 统计学方法 采用SPSS 16.0统计软件分析,所有数据进行正态性检验,均以±s表示,多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(one-way ANOVA);方差齐者两两比较采用LSD法,方差不齐者采用Dunnet’s T3检验。
3 结果
3.1 实验大鼠一般状况 40只实验SD大鼠共35只存活至第8周末(存活率87.5%)。高脂饲料喂养加敌百虫的4组中,模型组、低剂量及高剂量Gen组各1只,辛伐他汀组2只死于腹泻,普食组1只于采血时意外死亡。每组均取6只,且♀♂各半进行统计分析。
普食组大鼠毛色光泽,正常活动,体重增长较快;高脂加敌百虫组,随着实验进程,大鼠毛色逐渐松散暗淡,活动减少,其中各给药组大鼠精神状态较模型组明显好转;体重都呈现先降低再增长,且实验期间体重变化不大。
3.2 大鼠全血AChE活性变化 实验第8周末各组大鼠全血AChE活性差异无显著性,提示实验给SD大鼠腹腔注射10 mg·kg-1·d-1的敌百虫并不影响全血AChE活性,达到了本实验的预期目的。
3.3 Gen 对大鼠血清 TC、TG、LDL-C、HDL-C、HDL-C/TC与AI的影响 实验结果(Tab 1~3)可见,实验0周大鼠血清TC、TG、LDL-C和HDL-C含量,HDL-C/TC比值与AI值各组间差异均无显著性;第4、8周末血清TC、LDL-C含量及 AI值,相对普食组,模型组升高;相对模型组,高剂量Gen组降低,低剂量Gen有降低趋势,但差异无显著性;而血清TG含量,相对普食组,模型组的升高作用不明显。相对模型组,Gen各剂量组血清TG含量降低作用不明显。
第4周血清HDL-C含量,相对模型组,高剂量Gen组升高,而低剂量Gen组有升高趋势,但差异无显著性。而第8周,相对普食组,模型组升高;相对模型组,Gen各剂量组差异均无显著性。
第4、8周,相对普食组,模型组的HDL-C/TC比值降低;相对模型组,高剂量Gen组的HDL-C/TC比值增加;而低剂量Gen增加HDL-C/TC比值差异无显著性。
3.4 Gen对大鼠血清CRP的影响 Tab 4结果可见,0周各组大鼠血清CRP含量差异无显著性;第4、8周末,相对普食组,模型组升高,相对模型组,Gen各剂量组均降低。
3.5 肝脏形态学变化 肝脏HE染色,光镜下显示:与普食组比较,模型组肝小叶结构受损,结构不清晰,肝细胞均为大小不一的脂肪变性空泡(图中箭头所示),部分细胞核位于边缘;肝细胞索排列紊乱;而各给药组大鼠肝脏形态,与模型组比较,均能在一定程度上减轻上述肝脏病变。
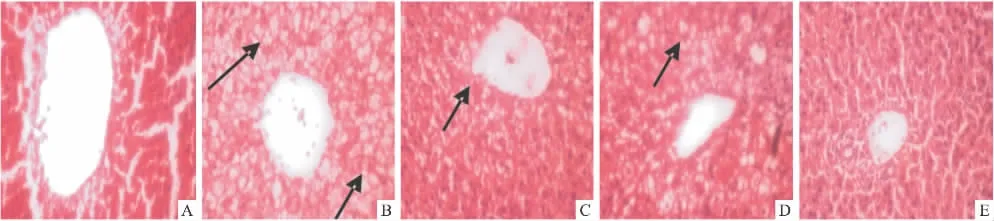
Fig 1 Changes of liver histomorphology(HE×400)

Fig 2 Changes of aortic histomorphology(HE×400)
Tab 1Effects of Gen on TC and TG in rat serum(±s,n=6)

Tab 1Effects of Gen on TC and TG in rat serum(±s,n=6)
*P <0.01 vs normal;△P <0.05,△△P <0.01 vs model
Group TC/mmol·L -1 0 wk 4 wk 8 wk TG/mmol·L-1 0 wk 4 wk 8 wk Normal 1.44 ±0.36 1.48 ±0.13 1.40 ±0.19 0.53 ±0.20 0.57 ±0.13 0.85 ±0.20 Model 1.40 ±0.31 16.52 ±3.13** 12.27 ±1.75** 0.48 ±0.13 0.72 ±0.37 0.55 ±0.19 Gen low 1.50 ±0.37 13.23 ±4.39 9.64 ±1.93 0.50 ±0.13 0.51 ±0.25 0.41 ±0.20 Gen high 1.48 ±0.28 10.10 ±2.29△ 6.58 ±0.95△△ 0.49 ±0.16 0.45 ±0.12 0.72 ±0.25 Simvastatin 1.42 ±0.29 6.69 ±1.95△△ 5.52 ±1.43△△0.48 ±0.06 0.36 ±0.06 0.36 ±0.09
Tab 2Effects of Gen on LDL-C and HDL-C in rat serum(±s,n=6)

Tab 2Effects of Gen on LDL-C and HDL-C in rat serum(±s,n=6)
*P <0.05,**P <0.01 vs normal;△P <0.05,△△P <0.01 vs model
Group LDL-C/mmol·L -1 0 wk 4 wk 8 wk HDL-C/mmol·L-1 0 wk 4 wk 8 wk Normal 0.35 ±0.26 0.27 ±0.18 0.18 ±0.08 0.98 ±0.16 1.12 ±0.08 1.06 ±0.19 Model 0.33 ±0.19 14.87 ±3.07** 9.90 ±1.95** 1.01 ±0.18 1.50 ±0.20* 2.15 ±0.21**Gen low 0.38 ±0.23 11.25 ±4.39 7.40 ±1.65 0.97 ±0.10 1.89 ±0.29 2.13 ±0.36 Gen high 0.35 ±0.21 7.95 ±2.25△ 4.55 ±0.79△△ 1.00 ±0.14 2.03 ±0.26△ 1.90 ±0.28 Simvastatin 0.33 ±0.16 4.93 ±1.99△△ 3.83 ±1.35△△ 1.00 ±0.17 1.67 ±0.23 1.67 ±0.09△△
Tab 3Effects of Gen on HDL-C/TC and AI in rat seurm(±s,n=6)

Tab 3Effects of Gen on HDL-C/TC and AI in rat seurm(±s,n=6)
*P <0.05;**P <0.01 vs normal;△P <0.05,△△P<0.01 vs model
Group HDL-C/TC 0 wk 4 wk 8 wk AI 0 wk 4 wk 8 wk Normal 0.72 ±0.11 0.76 ±0.09 0.76 ±0.06 0.44 ±0.26 0.33 ±0.18 0.33 ±0.10 Model 0.73 ±0.05 0.09 ±0.02** 0.18 ±0.04*△ 0.38 ±0.11 10.11 ±2.24** 4.77 ±1.16**Gen low 0.67 ±0.11 0.15 ±0.06 0.22 ±0.02 0.58 ±0.30 6.19 ±2.50 3.34 ±0.58 Gen high 0.68 ±0.07 0.21 ±0.06△△ 0.29 ±0.04△△ 0.48 ±0.15 4.03 ±1.24△△ 2.50 ±0.43△Simvastatin 0.71 ±0.07 0.31 ±0.08△△ 0.32 ±0.06△ 0.42 ±0.14 2.44 ±1.04△△ 2.29 ±0.64△
Tab 4 Effects of Gen on CRP in rat serum(±s,n=6,×10-1mg·L-1)

Tab 4 Effects of Gen on CRP in rat serum(±s,n=6,×10-1mg·L-1)
*P<0.05 vs normal;△P<0.05 vs model
Group 0 wk 4 wk 8 wk Normal 1.17 ±0.41 1.17 ±0.41 1.33 ±0.52 Model 1.00 ±0.00 5.67 ±2.07* 2.00 ±0.00 Gen low 1.17 ±0.41 2.00 ±1.10 1.83 ±0.41 Gen high 1.17 ±0.41 1.50±.055△ 1.17 ±0.41△Simvastatin 1.17 ±0.41 1.33 ±0.52△ 1.17 ±0.41△
3.6 主动脉弓形态学变化 主动脉弓HE染色,光镜下显示:与普食组比较,模型组的血管壁内膜明显增厚,不光滑,内皮细胞局部缺失,内有脂质浸润、泡沫细胞形成,靠近内膜的中膜平滑肌细胞增生、可见脂质浸润,并向内膜迁移(图中箭头所示);弹力纤维层结构不清晰,局部有断裂现象,外膜有不同程度的脂质浸润。而各药物组大鼠主动脉病理形态,与模型组比较,均可在一定程度上减轻主动脉弓病变,其中高剂量Gen组基本上恢复到普食组形态。
3.7 Gen对大鼠血清MDA含量的影响 实验结果见Tab 5,模型组血清中MDA含量增加;与模型组比较,高剂量的Gen可降低MDA水平,低剂量Gen虽有降低但差异无显著性。
3.8 Gen对大鼠血清PON1活性的影响 Tab 5表明,第4周,相对普食组,模型组PON1降低,而相对模型组,各药物组的PON1含量增加,说明药物能使高脂血症大鼠的PON1活性基本恢复到普食组水平。
而第8周,相对普食组,模型组PON1增加,原因可能是高脂饲料喂养的SD大鼠随实验时间的延长,其HDL-C也随着增高。相对模型组,各药物组的PON1活性增加。进一步说明,Gen可提高PON1活性。
Tab 5 Effects of Gen on MDA and PON1 in rat serum(±s,n=6)

Tab 5 Effects of Gen on MDA and PON1 in rat serum(±s,n=6)
*P<0.05,**P<0.01 vs normal;△P<0.05,△△P<0.01 vs model
Group MDA/μmol·L -1 4 wk 8 wk PON1/mmol·min -1·L-1 4 wk 8 wk Normal 3.84 ±0.62 4.02 ±0.71 3.92 ±0.84 3.56 ±1.82 Model 11.60 ±2.43** 12.02 ±2.83** 1.53 ±0.83* 10.01 ±3.39 Gen low 8.61 ±1.24 9.16 ±1.79 4.25 ±2.10△ 12.28 ±4.55 Gen high 4.80±1.85△△ 5.12±1.12△ 5.22±2.47△△ 17.26±6.91△△Simvastatin 5.19 ±1.48△ 5.31 ±1.49△ 5.38 ±2.33△△ 15.11 ±3.26△
4 讨论
As的发生、发展是一个复杂的病理过程,而高脂血症是造成As的主要原因,血液中LDL-C和TC含量的升高以及脂质的过氧化是心血管疾病发生和发展的重要因素。模型组SD大鼠组织病理形态结果表明高脂血症模型复制成功,但是没有发现模型组大鼠主动脉壁形成典型的脂质斑块,与以往诸多研究结果一致[4,14]。
实验结果显示:低剂量Gen对大鼠血脂水平表现出降低趋势,高剂量Gen能明显降低食饵性高脂血症大鼠的血脂,而且高剂量Gen能明显降低TC和LDL-C;Gen对TG的作用尚无明显影响,文献报道也存在争论,服用Gen或富含Gen的大豆异黄酮后检测到血清TC与LDL-C明显降低,而TG明显升高[15-17],其他研究和包括该实验,检测到 Gen处理后,TG不发生改变或者对 TG没有作用[18-20],Lin等[21]认为不同饮食对SD大鼠血清的TG水平影响差异具有显著性。
Gen给药后第4周末检测到HDL-C作用明显升高,而第8周末提高血清HDL-C水平上虽没有明显的作用,但是能使血清HDL-C/TC明显升高,AI值明显降低。
C-反应蛋白(CRP)是由肝细胞产生与临床炎症有关的急性期反应物蛋白[22]。大量证据表明 As是一种炎症性疾病;CRP是As进程中最主要的危险标志。本实验结果显示,模型组CRP水平呈低浓度分布,但明显高于普食组,差异具有显著性(P<0.05)。高剂量Gen组和辛伐他汀组CRP水平均明显低于模型组。结果提示,高剂量Gen和辛伐他汀均能明显降低高脂血症大鼠血清炎症因子CRP水平。
MDA是体内脂质过氧化产物之一,它的含量常可反映机体内脂质过氧化的程度,间接反映出机体细胞受自由基攻击的严重程度。结果可见Gen降低高脂喂养加敌百虫引起的脂质过氧化代谢产物MDA的含量,减少血管内皮细胞的损伤而发挥抗As作用。
PON1是由肝脏产生、存在于HDL分子中表现酯酶和内酯酶活性的一种酶。PON1能水解多种OP和神经毒剂、多种外源性和内源性内酯及代谢降解LDL-C和HDL-C被氧化后的脂质毒性。高脂饮食与敌百虫均能引起机体PON1水平降低,导致机体血管内皮损伤,促进As病变发生[23]。Gen对血清PON1的活性影响在体内外研究尚未见文献报道。实验结果可见:Gen能明显提高大鼠血清PON1的活性,且呈现剂量-效应关系。
综上所述,Gen能明显抑制SD大鼠高脂血症的发生,改善其肝、主动脉弓形态变化,此作用与Gen可逆转血脂障碍,抑制脂质过氧化,降低炎症因子CRP的含量与PON1的调节作用有关。
[1]李 鹏,尹雅玲,张玉林,等.有机磷酸酯类化合物对机体的影响[J].安徽农业科学,2008,36(31):13492-3,13501.
[1]Li P,Yin Y L,Zhang Y L,et al.Effects of organophosphate compounds on the organism[J].J Anhui Agri Sci,2008,36(31):13492-3,13501.
[2]李荣霏,谢 利,郭鹏程,等.敌百虫对兔食饵性动脉硬化加速作用[J].现代生物医学进展,2008,8(8):1422-4.
[2]Li R F,Xie L,Guo P C,et al.Effect of Dipterex in acceleration of atherosclerosis in rabbits with hyperlipidemic diet[J].Progr Mod Biomed,2008,8(8):1422-4.
[3]Singh V,Tiwari R L,Dikshit M,et al.Models to study atherosclerosis:a mechanistic insight[J].Curr Vasc Pharmacol,2009,7(1):75-109.
[4]赵 娟,任立群.大鼠动脉粥样硬化模型的复制[J].实用医学杂志,2008,24(23):4139-41.
[4]Zhao J,Ren L Q.Duplication of a rat atherosclerosis model[J].J Pract Med,2008,24(23):4139-41.
[5]Altavilla D,Crisafulli A,Marini H.Cardiovascular effects of the phytoestrogen genistein[J].Curr Med Chem Cardiovasc Hematol A-gents,2004,2(2):179-86.
[6]Qin W,Zhu W.Soy soflavones have an antiestrogenic effect and alter mammary propomoter hypermethylation in healthy premenopausal women[J].Nutr Cancer,2009,61(2):238-44.
[7]潘 平,范敢峰.不同剂量辛伐他汀对血脂及颈动脉粥样硬化斑块的疗效观察[J].临床医学,2007,27(6):33-4.
[7]Pan P,Fan G F.Clinical effect observation of simvastatin dosage on blood lipids and carotid atherosclerotic plaques[J].Clin Med,2007,27(6):33-4.
[8]Sung J H,Lee S J,Park K H,Moon T W.Isoflavones inhibit 3-hydroxy-3-methylglutaryl coenzyme A reductasein vitro[J].Biosci Biotechnol Biochem,2004,68(2):428-32.
[9]Ranaldi R,Gambuti G,Eichenlaub-Ritter U,et al.Trichlorfon effects on mouse oocytes followingin vivoexposure[J].Mutat Res,2008,651(1-2):125-30.
[10]Hinz V,Grewig S,Schmidt B H.Metrifonate and dichlorvos:effects of a singe oral administration on cholinesterase activity in rat brain and blood[J].Neurochem Res,1996,21(3),339-45.
[11]中华人民共和国卫生行业标准全血胆碱酯酶活性的分光光度测定方法羟胺三氯化铁法[S].WS/T 66-1996.
[11]Blood-determination of cholinesterase activity-spectrophotometric method-hydroxylamine-ferric chloride method[S].WS/T 66-1996.
[12]Lorentz K,Flatter B,Augustin E.Arylesterase in serum:elaboration and clinical application of a fixed-incubation method[J].Clin Chem,1979,25(10):1714-20.
[13]Eckerson H W,Wyte C M,La Du B N.The human serum paraoxonase/arylesterase polymorphism[J].Am J Hum Genet,1983,35(6):1126-38.
[14]宋 鑫,陈慧敏,高南南,等.豚鼠动脉粥样硬化模型的建立及与大鼠模型的比较[J].中国药理学通报,2011,27(4):572-7.
[14]Song X,Chen H M,Gao N N,et al.The establishment of atherosclerosis model in guinea pigs and the comparision with rat model[J].Chin Pharmacol Bull,2011,27(4):572-7.
[15]Sosic-Jurjevic B,Filipovic B,Ajdzanovic V,et al.Subcutaneously administrated genist ein and daidzein decrease serum cholesterol and increase triglyceride levels in male middle-aged rats[J].Exp Biol Med(Maywood),2007,232(9):1222-7.
[16]Ryokkynen A,Kukkonen J V,Nieminen P.Effects of dietary genistein on mouse reproduction,postnataldevelopmentand weight-regulation[J].Anim Reprod Sci,2006,93(3-4):337-48.
[17]Naaz A,Yellayi S,Zakroczymski M A.The soy isoflavone genistein decreases adipose deposition in mice[J].Endocrinology,2003,144:3315-20.
[18]Nogowski L,Mackowiak P,Kandulska K,et al.Genistein-induced changes in lipid metabolism of ovariectomized rats[J].Ann Nutr Metab,1998,42(6):360-6.
[19]Kojima T,Uesugi T,Toda T,et al.Hypolipidemic action of the soybean isoflavones genistein and genistin in glomerulonephritic rats[J].Lipids,2002,37(3):261-5.
[20]Szkudelska K,Nogowski L.Genistein——A dietary compound inducing hormonal and metabolic changes[J].J Steroid Biochem Mol Biol,2007,105(1-5):37-45.
[21]Lin C Y,Tsai C Y,Lin S H.Effects of soy components on blood and liver lipids in rats fed high-cholesterol diets[J].World J Gastroenterol,2005,11(35):5549-52.
[22]Jialal I,Devaraj S,Venugopal S K.C-reactive protein:Risk marker or mediator in atherothrombosis[J]?Hypertension,2004,44(1):6-11.
[23]Rosenblat M,Aviram M.Paraoxonases role in the prevention of cardiovascular diseases[J].Biofactors,2009,35(1):98-104.
