细梗香草总皂苷的抗肿瘤活性研究
2012-12-06荣语媚刘小保应弘梅邹莉波田景奎
徐 燕,荣语媚,刘小保,应弘梅,邹莉波,田景奎
(1.浙江大学生物医学工程与仪器学院生物医学工程学系,浙江杭州 310027;2.沈阳药科大学生命科学与生物制药学院药理学教研室,辽宁沈阳 110016)
细梗香草(Lysimachia capillipesHemsl)又名满山香、香排草,为报春花科珍珠菜属植物。细梗香草总皂苷为本实验室从细梗香草全草提取的含有10余种结构已明确的齐墩果烷型三萜皂苷[1]混合物,皂苷含量占总提物含量60%以上,其中又以细梗香草皂苷B和C这两个新化合物为主,其含量占总皂苷 70%以上[2]。
民间将细梗香草用于治疗感冒咳嗽、风湿痹痛、抗肿瘤、月经不调、神经衰弱、驱蛔等[3]。本实验室前期的研究结果表明细梗香草皂苷有很强体外抗肿瘤活性,本文重点研究细梗香草总皂苷的体内抗肿瘤活性和对荷瘤小鼠免疫系统的影响。
1 材料与方法
1.1 实验动物 健康♂C57BL/6小鼠60只,5~6周,清洁级;健康BALB/c裸小鼠,5~6周,SPF级,上海斯莱克实验动物有限责任公司[SCXK(沪)2007-0005]。
1.2 细胞株 前列腺癌RM-1细胞、前列腺癌PC-3细胞、胃癌BGC-823细胞、卵巢癌SK-OV-3细胞,中科院上海细胞库。
1.3 药品与试剂 细梗香草总皂苷(capilliposide,LC)由本实验室提取,批号:TS101021,总皂苷含量为63.03%。HyClone改良型RPMI 1640培养液,赛默飞世尔生物化学制品(北京)有限公司;F-12培养液、DMEM高糖培养液、McCOY’S 5A培养液、0.25%Trypsin-0.02%EDTA,吉诺生物医药技术有限公司;无支原体胎牛血清,浙江天杭生物科技有限公司;环磷酰胺、多西他赛注射液,江苏恒瑞医药股份有限公司;刀豆蛋白Ⅳ(Con A typeⅣ),杭州昊天生物技术有限公司;兔抗人VEGF多克隆一抗,thermo fisher;链霉亲和素-过氧化物酶(SABC)、聚合HRP标记抗兔IGg及DAB显色试剂盒,武汉博士德生物技术有限公司。其余试剂为国产分析纯。
1.4 仪器设备 HEPA class 100二氧化碳培养箱(Thermo,美国);18#髂骨穿刺针,上海埃斯埃医械塑料制品有限公司;数显游标卡尺(Mahr,德国);AG 22331台式低速离心机(Eppendorf,德国)。
1.5 细梗香草总皂苷对小鼠前列腺癌的体内抑瘤作用及对免疫功能影响 取对数生长期的RM-1细胞,用全血清RPMI 1640细胞培养液调整细胞密度为2×109·L-1,无菌下每只小鼠皮下接种0.2 ml。接种后 24 h,按体重随机分为:LC 90、60、40 mg·kg-1组、阳性对照环磷酰胺 (cyclophosphamide,CTX)30 mg·kg-1组和模型对照组(model group,M),另设正常对照组(control group,C),每组10只动物。LC各给药组连续灌胃(ig)给药10 d,CTX隔天腹腔注射(ip),给药容积均为20 ml·kg-1。
1.5.1 细梗香草总皂苷对C57BL/6小鼠荷前列腺癌RM-1增殖的抑制作用 给药期间每天监测小鼠体重。于末次给药24 h后处死小鼠,剥取肿瘤,计算抑瘤率(inhibitory rate,I),计算公式如下:
I/%=(1-给药组平均瘤重/模型组平均瘤重)×100%。
1.5.2 细梗香草总皂苷对免疫功能的影响 取脾脏和胸腺,计算脏器指数(脏器指数=脏器重量/体重)。MTT法测定脾T淋巴细胞增殖反应[4]和IL-2活性[4]。
1.6 细梗香草总皂苷体内抗肿瘤药效学评价 选取前列腺癌PC-3细胞、胃癌BGC-823细胞和卵巢癌SK-OV-3细胞3个敏感瘤株进行体内的药效评价。
1.6.1 裸鼠荷人源肿瘤模型建立[5]取对数生长
期的人源肿瘤细胞,调细胞密度为2×1010·L-1,无菌下每只小鼠皮下接种0.2 ml。组织块接瘤法体内传1~2代,待肿瘤体积长至100 mm3左右,随机分组同上,阳性对照为多西他赛(docetaxel,DTX)25 mg·kg-1组,每组6只动物。LC隔天给药,连续20 d左右,DTX 25 mg·kg-1每 3周尾静脉注射给药(iv)一次,给药容积均为 10 ml·kg-1。
1.6.2 细梗香草总皂苷体内抗肿瘤药效评价 每周定期监测肿瘤体积(tumor volume,V),V=1/2×a×b2,其中a和b分别表示长径和短径。计算相对肿瘤增殖率 T/C(%)=TRTV/CRTV×100%。(TRTV:治疗组相对肿瘤体积;CRTV:模型组相对肿瘤体积)。末次给药24 h后处死动物,取瘤,并将新鲜组织用中性福尔马林溶液固定,进行组织病理学检测(HE染色)和免疫组织化学检测(VEGF表达)。
2 结果
2.1细梗香草总皂苷抗肿瘤药效评价
2.1.1 细梗香草总皂苷对C57BL/6小鼠荷前列腺癌的增殖抑制作用 LC可以剂量依赖性抑制前列腺癌RM-1的生长,且中、高剂量组与模型组相比差异均有显著性,见Tab 1。
2.1.2 细梗香草总皂苷对荷瘤裸鼠肿瘤增殖的抑制作用 LC对裸鼠胃癌BGC-823的肿瘤生长曲线见Fig 1A,1B为肿瘤照片。结果显示,各给药组肿瘤体积与模型组相比均有不同程度的差异。LC对瘤裸荷前列腺癌PC-3和卵巢癌SK-OV-3的抑瘤率和末次给药的相对肿瘤增殖率见Tab 2。实验结果显示,LC可不同程度的抑制3个敏感肿瘤株的增殖,其中对前列腺癌和胃癌的抑制作用更强。

Fig 1 Effect of LC on tumor growth in nude mice bearing BGC-823(±s,n=6)
2.2 免疫相关指标检测和裸鼠肿瘤组织切片染色
2.2.1 血液学指标和免疫学相关指标测定 血液学指标分别检测外周血白细胞(white blood cell,WBC)、淋巴细胞(lymphocytes,LYM)、血小板(blood platelets,PLT)和血红蛋白(hemoglobin,HGB)见 Tab 2。与模型组小鼠相比,LC可上调荷瘤小鼠外周血液中HGB,对 WBC也有一定上调作用,LYM和PLT各组未见差异。小鼠脾T淋巴细胞增殖反应能力实验(Fig 2A)和IL-2活性测定实验结果(Fig 2B)显示,模型组小鼠较空白组值降低;与模型对照组比较,LC中、高剂量组数值增高。
2.2.2 裸鼠荷人胃癌BGC-823肿瘤组织的病理切片分析 胃癌肿瘤组织HE染色见Fig3。模型组移植瘤细胞核大、深染,肿瘤细胞数量多,排列紊乱,血窦丰富,癌组织中可见纤维结缔组织和血管增生,肿瘤的中央可见少量坏死区域,肿瘤细胞数量相对减少。LC各给药组和DTX组的肿瘤细胞呈圆形或椭圆形,淡染,核分裂少见,肿瘤细胞数量明显减少,可见较多肿瘤细胞肿胀变性坏死,甚至大片坏死[6]。
Tab 1Effect of LC on the growth of transplanted prostatic cancer(RM-1)in mice(±s)
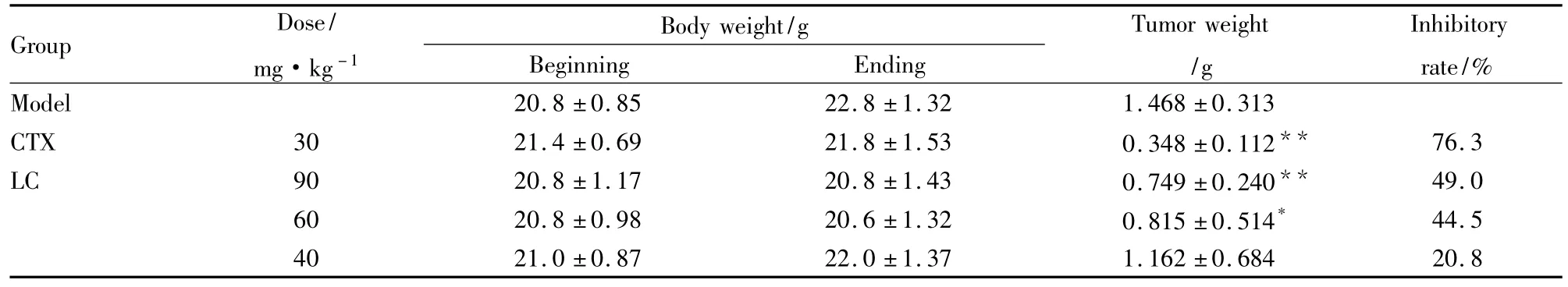
Tab 1Effect of LC on the growth of transplanted prostatic cancer(RM-1)in mice(±s)
*P <0.05,**P <0.01 vs model group
Group Dose/mg·kg-1 Body weight/g Beginning Ending Tumor weight/g Inhibitory rate/%Model 20.8 ±0.85 22.8 ±1.32 1.468 ±0.313 CTX 30 21.4 ±0.69 21.8 ±1.53 0.348 ±0.112** 76.3 LC 90 20.8 ±1.17 20.8 ±1.43 0.749 ±0.240** 49.0 60 20.8 ±0.98 20.6 ±1.32 0.815 ±0.514* 44.5 40 21.0 ±0.87 22.0 ±1.37 1.162 ±0.684 20.8
Tab 2 Effect of LC on tumor inhibitory rate and T/C in nude mice models(±s)
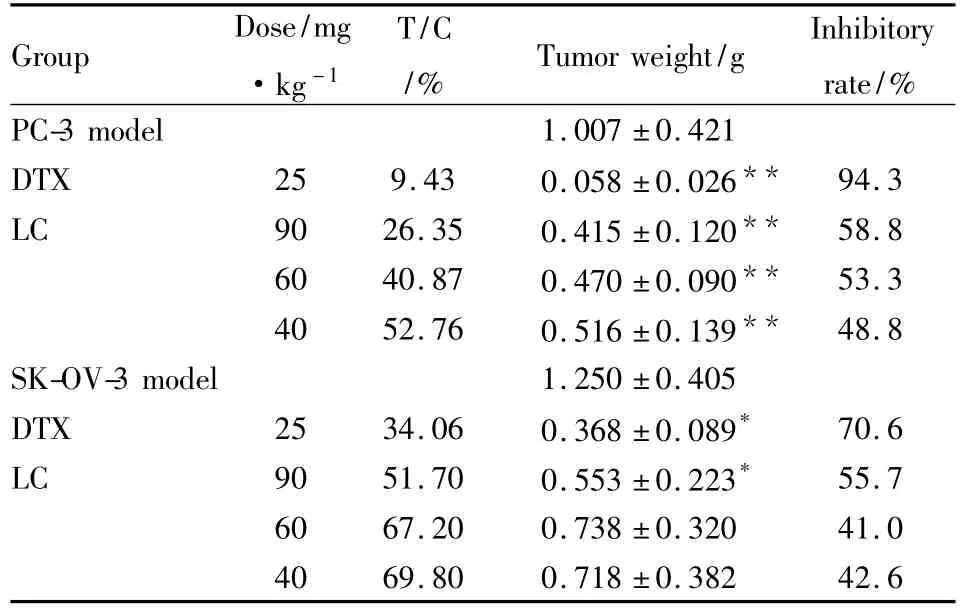
Tab 2 Effect of LC on tumor inhibitory rate and T/C in nude mice models(±s)
*P <0.05,**P <0.01 vs model group
Group Dose/mg·kg-1 T/C/% Tumor weight/g Inhibitory rate/%PC-3 model 1.007 ±0.421 DTX 25 9.43 0.058 ±0.026** 94.3 LC 90 26.35 0.415 ±0.120** 58.8 60 40.87 0.470 ±0.090** 53.3 40 52.76 0.516 ±0.139** 48.8 SK-OV-3 model 1.250 ±0.405 DTX 25 34.06 0.368 ±0.089* 70.6 LC 90 51.70 0.553 ±0.223* 55.7 60 67.20 0.738 ±0.320 41.0 40 69.80 0.718 ±0.382 42.6
2.2.3 荷人胃癌BGC-823裸鼠肿瘤组织免疫组化染色 免疫组化实验结果(Fig 4)显示,LC高剂量组VEGF表达与模型组相比明显减少,提示LC可能通过抑制血管内皮生长因子的表达从而抑制肿瘤生长。
Tab 3Effect of LC on hematological parameters in C57BL/6 mice(±s)

Tab 3Effect of LC on hematological parameters in C57BL/6 mice(±s)
#P <0.05,##P <0.01 vs control;*P <0.05,**P <0.01 vs model.
Parameter Control Model LC 40 mg·kg-1 LC 60 mg·kg-1 LC 90 mg·kg-1CTXWBC/109·L-1 3.15 ±0.61 7.13 ±1.26## 8.34 ±1.99 8.52 ±1.78 6.78 ±1.99 4.29 ±1.55**LYM/109·L -1 2.30 ±0.20 4.28 ±1.82 4.43 ±2.37 4.11 ±1.83 3.05 ±1.53 2.69 ±1.99 PLT/1011·L-1 9.25 ±1.55 8.02 ±1.63 7.44 ±3.05 4.97 ±1.46** 7.39 ±1.83 9.64 ±3.26 HGB/102g·L -1 1.48 ±0.07 1.37 ±0.09# 1.44 ±0.12 1.41 ±0.14 1.48 ±0.07*1.30 ±0.12
3 讨论
本实验中裸鼠荷瘤模型建立采用组织块接瘤法,可以大批量一次性进行接瘤,成瘤时间短,传代稳定性好,得到的模型鼠的肿瘤生长更均匀。

Fig 2 (A)Effect of LC on the proliferation of spleen T lymphocyte in mice bearing RM-1;(B)Effect of LC on the activity of IL-2 in mice bearing RM-1(±s,n=8)
大量免疫学研究表明,对免疫系统有效的所有活性成分均对控制肿瘤生长有作用。抗肿瘤免疫效应一般以细胞免疫为主,体液免疫为辅,两者并存且密切相关,非特异性免疫及各种细胞因子在肿瘤免疫中也起着非常重要的作用[4]。本研究主要考察了LC对小鼠T淋巴细胞增殖反应、IL-2活性的影响,并对血液学指标进行检测,结果显示,LC可一定程度上调外周血中WBC和HGB,可明显提高Con A诱导的脾T淋巴细胞增殖(P<0.05)和IL-2活性(P<0.05),说明LC可以促进淋巴细胞对有丝分裂原的反应性,增强T淋巴细胞功能,从而促进T细胞介导的细胞免疫反应。
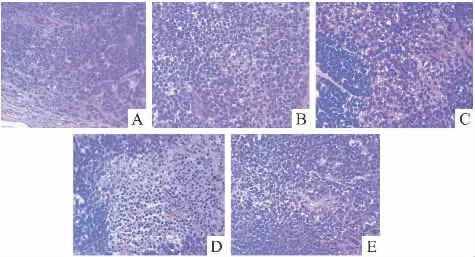
Fig 3 Histopathology of tumor tissue in nude mice bearing BGC-823(HE×400)
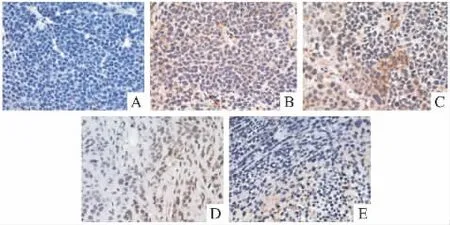
Fig 4 Effect of LC on immunohistochemistry of tumor tissue in nude mice bearing BGC-823(SABC×400)
肿瘤血管的形成对直径大于1~3 mm的实体瘤的进一步生长极其重要,肿瘤诱导新生血管形成的过程是一个多种正负因素共同作用的结果。至今至少已有15种肿瘤血管形成因子见诸报道[7],其中,VEGF是诱导和促进血管生成最强有力的关键因子,也是抗肿瘤血管生成的重要靶点;肿瘤组织往往过量表达VEGF因子,该因子可以与血管内皮细胞表面VEGF受体特异性结合,活化其细胞内酪氨激酶,并最终促进血管内皮细胞增殖和游走,构成管样结构[8]。有研究表明,三萜皂苷可能通过RTKs以及VEGF/VEGFR信号通路抑制血管增生[9]。本实验通过免疫组化方法检测肿瘤组织中VEGF的表达,研究LC对肿瘤血管生成的影响,初步探究其可能的作用机制。实验结果显示,LC对肿瘤新生血管的生成有一定抑制作用,提示该化合物可能通过抑制肿瘤血管生成从而抑制肿瘤细胞的增殖。
[1]田景奎.珍珠菜属两种药用植物化学成分的研究[D].北京:中国协和医科大学,2002:6-11.
[1]Tian J K.Studies on the chemical constituents of two medicinal plants of lysimachia genus[D].Beijing:Peking Union Med Coll,2002:6-11.
[2]应弘梅.细梗香草总皂苷制备工艺及质量标准研究[D].杭州:浙江大学,2011:20-51.
[2]Ying H M.Study on the preparation process of total saponins in Lysimachia capollipes Hemsl.and the establishment of quality standards[D].Hangzhou:Zhejiang University,2011:20-51.
[3]田景奎,邹忠梅,徐丽珍,等.细梗香草化学成分的研究[J].
中国药学杂志,2006,41(3):171-3.
[3]Tian J K,Zou Z M,Xu L Z,et al.Study on constituents of Lysimachia capillipes[J].Chin Pharm J,2006,41(3):171-3.
[4]纪雪飞.SY抗肿瘤作用的实验研究[D].沈阳:沈阳药科大学,2006:18-28.
[4]Ji X F.Experimental studies on anti-tumor effects on SY[D].Shenyang:Shenyang Pharm Univ,2006:18-28.
[5]Goya N,Koga S,Tomizawa Y,et al.Effects of direct injection of dehydrated ethanol on PC3 human prostate cancer cells in nude mice:Preliminary study[J].Int J Urol,2007,14:760-3.
[6]石 磊.豆蔻提取物联合5-FU抑制人胃腺癌细胞裸鼠皮下移植瘤生长的实验研究[D].扬州:扬州大学,2010:23.
[6]Shi L.The empirical study concerning the inhibition effect of fructus amomi rotundus combined with 5-FU on subcutaneous transplantation tumor of human gastric cancer cell in nude mice model[D].Yangzhou:Yangzhou Univer,2010:23.
[7]孔海宏.抗肿瘤血管药物TNP-470抑制人SKOV3卵巢癌生长的动物体内实验研究[D].上海:第二军医大学,2000:17-35.
[7]Kong H H.In vivoexperiment on the inhibition of grouth of human SKOV3 ovarian neoplasms with TNP-470[D].Shanghai:The Second Mill Med Univ,2000:17-35.
[8]甘 力,蒋福升,范秋艳,等.姜黄素对 LPS诱导小鼠 cae-VEGF表达的抑制[J].中国药理学通报,2011,27(8):1148-51.
[8]Gan L,Jiang F S,Fan Q Y,et al.Inhibition of curcumin on LPS-induced caeVEGF in mice[J].Chin Phamacol Bull,2011,27(8):1148-51.
[9]赵 芹,薛长湖,张 珣,等.革皮氏海参皂苷抑制血管新生作用[J].中国药理学通报,2011,27(7):934-9.
[9]Zhao Q,Xue C H,Zhang X,et al.Antiangiogenesis effect of holothurin A1 and 24-dehydroechinoside A from Pearsonothria graeffei[J].Chin Phamacol Bull,2011,27(7):934-9.
