胡黄连苷Ⅱ治疗脑缺血/再灌注损伤剂量和时间窗的初步探讨
2012-12-06李红云裴海涛张美增郭云良
李红云,赵 丽,宿 希,裴海涛,张美增,辛 辉,郭云良
(青岛大学医学院附属医院1.急诊神经科、2.中西医结合中心、3.神经内科、4.心内科,山东 青 岛 266003)
脑缺血/再灌注损伤是由兴奋性氨基酸释放、氧化应激、钙离子超载、炎症反应和细胞凋亡等多种因素参与的病理过程[1-3]。神经元特异性烯醇化酶(neuronspecific enolase,NSE)和神经胶质细胞标志蛋白S-100与脑损伤和恢复的程度有密切关系[4-6]。细胞培养研究证实,胡黄连苷Ⅱ能减轻H2O2诱导的 PC12细胞损伤,提高细胞存活率[7-9]。动物实验研究表明,胡黄连苷Ⅱ可抑制大鼠大脑中动脉闭塞再灌注(MCAO/R)后缺血半影区的细胞凋亡和相关炎性因子的表达[10-11]。本课题组前期实验表明,胡黄连苷Ⅱ可通过抑制下调大鼠脑缺血损伤后炎性细胞因子Toll样受体4(TLR4)、核转录因子 κB(NF-κB)、肿瘤坏死因子α(TNF-α),以及半胱天冬酶-3(Caspase-3)的表达,减少其底物多聚腺苷酸二磷酸核糖聚合酶(PARP)的降解,使PARP利用缺血半暗带细胞内残存的能量,修复可逆性神经细胞损伤,从而抑制脑缺血损伤导致的细胞凋亡[12-16]。但前述实验均在单一脑缺血时间(2 h)经尾静脉注射应用单一剂量(20 mg·kg-1)的胡黄连苷Ⅱ进行干预,静脉用药极为不便。为此,本实验试图根据正交试验设计原理,经腹腔注射胡黄连苷Ⅱ治疗,探讨其治疗脑缺血损伤的最佳治疗剂量和时间窗。
1 材料与方法
1.1 动物模型 成年健康♂ SPF级Wistar大鼠,体质量240~260 g,由青岛市药物检验所实验动物中心提供[SCXK(鲁)20100010]。实验前动物均置实验室适应环境1周,自由进食、饮水;室温(23±2)℃,自然光照,术前禁食12 h。动物经100 g·L-1水合氯醛腹腔注射麻醉(0.3 ml·kg-1),仰卧固定、无菌操作,应用线栓法经左侧颈外-颈内动脉插线建立大脑中动脉闭塞(MCAO)模型[17]。术中和术后用恒温电热毯保持动物肛温36℃~37℃。动物手术麻醉清醒后出现左侧honer's征、提尾右侧上肢屈曲、爬行时向右侧转圈者为模型成功的标志,假手术组插线10mm后即刻退出,其余操作同模型组。
1.2 设计分组 将手术成功的动物模型(16×2)纳入统计范围,按照二因素四水平[L16(45)]正交试验设计原理分组(Tab 1)。治疗时间窗为A因素,设缺血1.0、1.5、2.0、2.5 h 4个水平;治疗剂量为 B因素,设 5、10、20、40 mg·kg-14 个水平,如 Tab 1。

Tab 1 Orthogonal experimental disign of【L16(45)】
1.3 干预措施 应用0.1 mol·L-1PBS将胡黄连苷Ⅱ(天津奎青医药公司,CAS No:39012-20-9,纯度>98%,分子质量:512)溶解稀释成1%溶液,按照[L16(45)]正交表中的设计,在相应的缺血时间,腹腔注射相应剂量胡黄连苷Ⅱ,24 h处死动物,检测相应的指标。
1.4 观察指标
1.4.1 神经行为功能缺陷评分 腹腔注射胡黄连苷Ⅱ 24 h后[(16×2)只],参考 Bederson's评分[18]标准进行神经行为功能缺陷评分,得分越高表示神经功能缺陷程度越重,反之则较轻微。0分:未见行为缺陷;1分:前肢屈曲(即提尾悬空实验阳性);2分:侧推抵抗力下降(即侧向推力实验阳性),伴前肢屈曲,无转圈行为;3分:同中度行为,伴自发性旋转。
1.4.2 脑梗死体积 腹腔注射胡黄连苷Ⅱ24 h后(16 只),以100 g·L-1水合氯醛 0.3 ml·kg-1腹腔注射麻醉动物,完整取脑,用大鼠切脑模具自前向后连续冠状切片,厚2 mm,共5片,置20 g·L-1的氯化三苯基四氮唑(TTC)磷酸盐缓冲液中,37℃避光染色10 min,置于40 g·L-1多聚甲醛溶液中固定,正常脑组织染为红色,梗死组织为白色。拍照后用Adobe PhotoShop CS计算梗死面积,以经过视交叉平面的脑梗死面积占该层同侧半球面积的百分比(%)表示脑梗死体积。
1.4.3 免疫组化 腹腔注射胡黄连苷Ⅱ 24 h后(16 只),以100 g·L-1水合氯醛 0.3 ml·kg-1腹腔注射麻醉动物,40 g·L-1多聚甲醛200 ml经心脏灌注固定,完整取脑。常规梯度乙醇脱水、二甲苯透明、石蜡包埋,自视交叉后连续冠状位切片,厚5 μm,贴于经过多聚赖氨酸处理的载玻片上,烤片机60℃烤片4 h后,4℃保存。兔抗鼠神经元特异性烯醇化酶(NSE)和神经胶质蛋白(S-100蛋白)抗体,SABC免疫组化试剂盒、DAB显色液均购自武汉博士德生物工程有限公司。取上述切片,常规脱蜡至水,按照试剂盒说明书步骤操作,DAB显色,光镜下观察胞质有棕色颗粒者为阳性细胞。每只大鼠取5张连续切片,在400倍光镜下随机观察皮质区5个视野,用Leica Qwin图像处理系统分析各视野的阳性细胞数,取其均值。
1.5 统计学处理 应用SPSS 17.0版本统计软件,进行数据统计分析。根据结果,分析不同水平的缺血(给药)时间和剂量对试验检测指标是否有显著差异,以及缺血(给药)时间和剂量的交互作用对实验检测指标是否有影响,并得出最佳的剂量和时间窗的组合。检测结果正交表以脑梗死面积检测结果为例(Tab 2),其他结果正交表(略)。
2 结果
2.1 神经行为功能评分 治疗结束后,各组动物表现为不同程度的功能缺陷,经SPSS分析(设定α为0.05),自变量的交互作用显著性概率P=0.46>0.05(Tab 3),认为时间与剂量无交互作用。方差分析结果可以看出,各个自变量的显著性概率P=0.02<0.05,认为给药(缺血)时间和剂量对神经功能的恢复均有影响。应用SSR法进行两两比较,计算LSD值,根据分析结果得出:给药(缺血)时间1 h(A1)与1.5 h(A2)、2 h(A3)与 2.5 h(A4)之间差异无显著性(P>0.05);注射剂量5 mg·kg-1(B1)与 10 mg·kg-1(B2)、20 mg·kg-1(B3)与 40 mg·kg-1(B4)之间差异无显著性(P>0.05);其余两两比较差异均有显著性(P<0.05)。因此,给药时间与剂量组合以 A1B3、A1B4、A2B3、A2B4较好。从用药剂量最小化和治疗时间窗最大化的角度考虑,以A2B3组合最好,即最佳治疗时间窗和剂量分别为缺血 1.5 h、20 mg·kg-1。
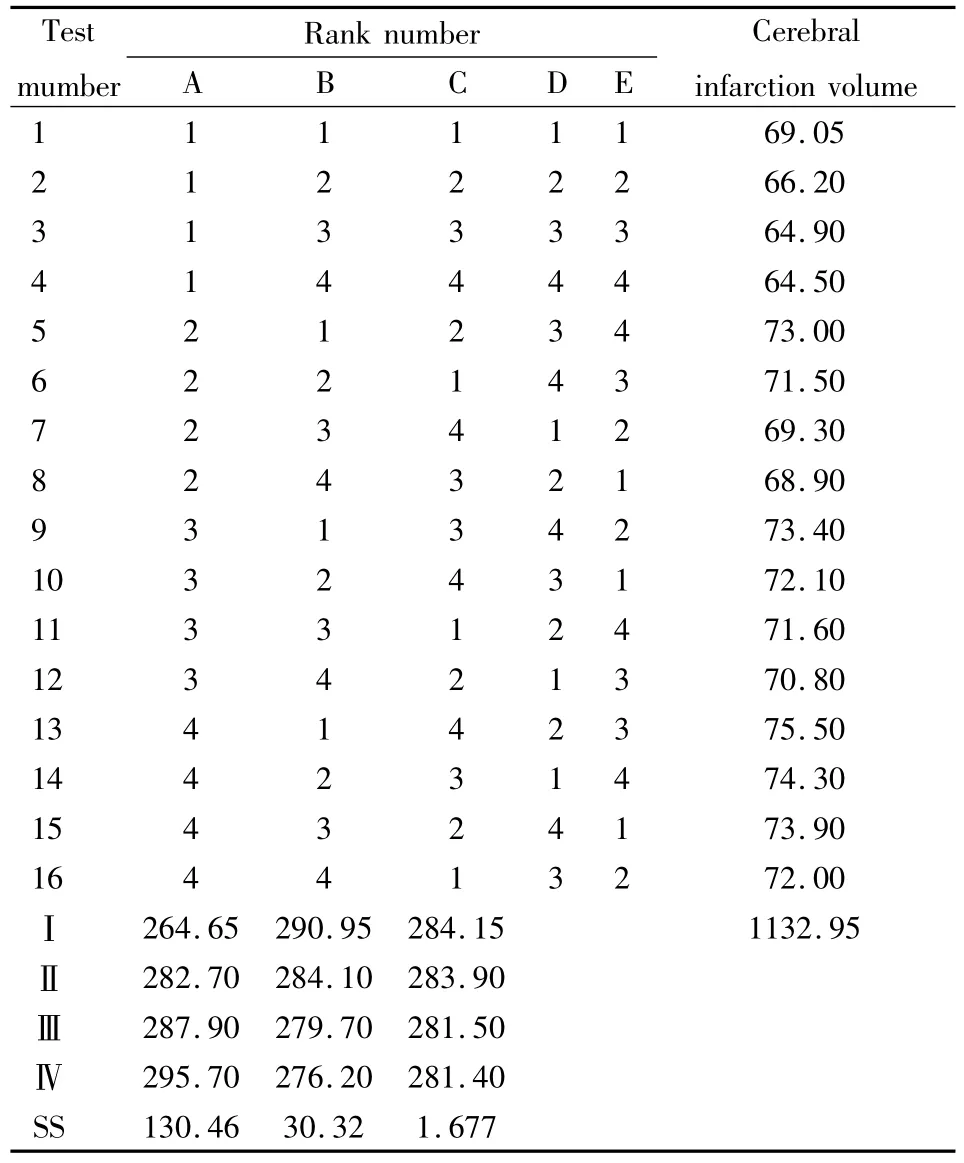
Tab 2 Orthogonal layout and the result of infarction volume

Tab 3 Ananalysis of variance about neurological function defect
2.2 脑梗死体积 TTC染色显示,各组动物大脑中动脉供血区出现不同程度的梗死病灶,经过SPSS分析(设定α为0.05),自变量交互作用的显著性概率为0.23>0.05,认为给药(缺血)时间与剂量无交互作用(Tab 4)。方差分析结果可以看出:各个自变量的显著性概率均小于0.01,认为给药(缺血)时间和剂量对脑缺血后脑梗死面积均有影响。应用SSR

Tab 4 ANOVA of cerebral infraction volume
2.3 NSE蛋白表达 免疫组化染色显示,各组大鼠脑组织NSE呈不同程度表达,主要在胞质着色,呈棕黄或棕褐色。自变量(即阳性细胞数)交互作用的显著性概率为0.78>0.05,认为给药(缺血)时间与剂量无交互作用(Tab 5)。方差分析结果:各个自变量的显著性概率P<0.01,认为给药(缺血)时间和剂量对脑缺血后NSE表达均有影响。SSR法两两比较,计算LSD值,根据分析结果得出:各给药(缺血)时间NSE阳性细胞数差异均有显著性(P<0.05);各给药剂量间除20 mg·kg-1(B3)和40 mg·kg-1(B4)之间差异无显著性外,其余水平间差异均有显著性(P<0.05)。因此,给药时间与剂量组合以A1B3或A1B4组合为好。从用药剂量最小化和治疗时间窗最大化的角度考虑,以A1B3组合最好,即最佳治疗时间窗和剂量分别为缺血1.0 h、20 mg·kg-1。
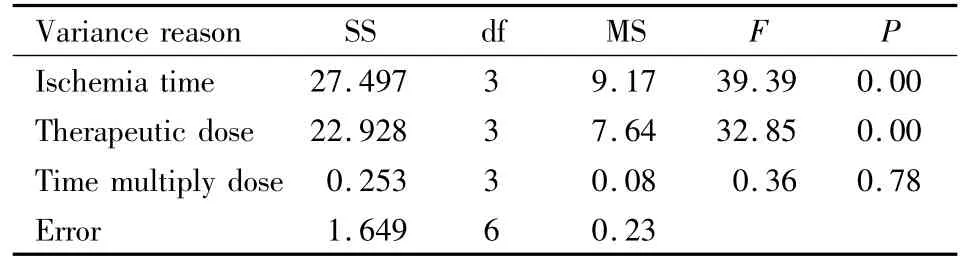
Tab 5 ANOVA of positivbe cells of NSE
2.4 S-100蛋白表达 各组大鼠脑组织S-100蛋白呈不同程度表达,主要为胞质着色,自变量(即阳性细胞数)交互作用的显著性概率为P=0.35>0.05,认为给药(缺血)时间与剂量无交互作用(Tab 6)。方差分析结果:各个自变量的显著性概率P=0.01,认为给药(缺血)时间和剂量对脑缺血后S-100蛋白法进行两两比较,计算LSD值,根据分析结果得出:给药时间两两比较差异有显著性(P<0.05);注射剂量20 mg·kg-1(B3)与 40 mg·kg-1(B4)比较差异无显著性(P>0.05);其余组合两两比较差异都有显著性(P<0.05)。因此,给药时间与剂量组合以A2B3或A1B4较好。从用药剂量最小化和治疗时间窗最大化的角度考虑,以A2B3组合最好,即最佳治疗时间窗和剂量分别为缺血1.5 h、20 mg·kg-1。表达均有影响。SSR两两比较LSD值:S-100蛋白表达给药(缺血)时间1 h(A1)与1.5 h(A2)、1.5 h(A2)和2 h(A3)比较差异无显著性(P>0.05),其余给药时间水平间差异均有显著性(P<0.05);给药剂量 5 mg·kg-1(B1)与 10 mg·kg-1(B2)、20 mg·kg-1(B2)与 40 mg·kg-1(B4)之间差异无显著性外(P>0.05),其余给药剂量水平间差异均有显著性(P<0.05)。可以得出:给药时间与剂量组合以A1B3或A1B4或A2B3或A2B4。从用药剂量最小化和治疗时间窗最大化的角度考虑,以A2B3组合最好,即最佳治疗时间窗和剂量分别为缺血1.5 h、20 mg·kg-1。
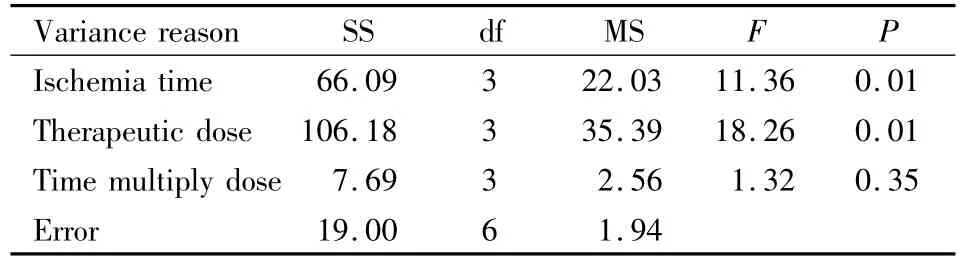
Tab 6 ANOVA of positive cells of S-100
3 讨论
正交表能够在因素变化范围内均衡抽样,在减少试验次数的同时,使每次试验都具有较强的代表性。正交表具备均衡分散的特点,保证了全面试验的某些要求,能缩短试验周期,提高试验效率,更好的达到试验目的。本实验应用正交表对试验进行整体设计、综合比较、统计分析,实现通过少数的实验次数找到较好的治疗方案,以达到最佳的治疗效果。
本实验检测指标中,神经功能评分是通过大鼠的体征来判断胡黄连苷Ⅱ对缺血性脑损伤的治疗作用;TTC染色能够直观的检测脑梗死面积,通过直接脑缺血区域的测定反映脑损伤的程度;神经胶质细胞标志蛋白 S-100[19-21]和 NSE 是评估脑缺血损伤的敏感指标[22-23]。NSE为一种存在于神经组织而不存在于非神经组织中的酸性可溶性蛋白。S-100是一种酸性钙离子结合蛋白,主要存在于神经胶质细胞。S-100为细胞内的钙受体蛋白,并调节能量代谢、促进轴突生长、胶质细胞增生,钙离子内环境的稳定等。通过检测脑组织中NSE和S-100的表达可反映胡黄连苷对脑缺血损伤的保护作用。
本实验按[L16(45)]正交试验设计分组,大鼠脑缺血1、1.5、2和2.5 h 4个时间点,分别给予胡黄连苷Ⅱ 5、10、20、40 mg·kg-14 个剂量,通过检测神经功能评分、脑梗死面积、NSE及S-100蛋白表达等指标,研究胡黄连苷Ⅱ治疗脑缺血损伤的最佳剂量和时间窗。结果表明,注射时间和用药剂量对于胡黄连苷Ⅱ的治疗效果差异有显著性,不同检测指标最佳组合结果不尽一致,从用药剂量最小化和治疗时间窗最大化的角度考虑,以A2B3组合最好,即最佳治疗时间窗和剂量分别为缺血1.5 h、20 mg·kg-1。由于脑缺血损伤的机制极为复杂,本研究仅观察了以上4个指标的变化,难免有所偏差。因此,胡黄连苷Ⅱ的确切作用机制和最佳治疗时间窗和给药剂量尚有待于结合其他检测指标进一步综合评价。
[1]Etienne Manneville S,Manneville J B,Adamson P,et al.ICAM-1-coupled cytosskeletal tearrangements and transcendothelial lymphocyte migration involve intracellular calcium signaling in brain endothelial cell lines[J].Immunol,2000,165(6):3375-83.
[2]Caso J R,Pradillo J M,Hurtado O,et al.Toll-like receptor 4 is involved in subacute stress-induced neuroinflammation and in the worsening of experimental stroke[J].Stroke,2008,39(4):1314-20.
[3]Bi X,Yan B,Fang S.Quetiapine regulates neurogenesis in ischemic mice by inhibiting NF-kappaB p65/p50 expression[J].Neurol Res,2009,31(2):159-66.
[4]Kruijk J R,Leffers P,Menheere P P,et al.S-100β and neuron-specific enolase in serum of mild traumatic brain injury patients.A comparison with health controls[J].Acta Neurol Scand,2001,103(3):175-9.
[5]Basile A M,Fusi C,Conti A A,et al.S-100 protein and neuronspecific enolase as markers of subclinical cerebral damage after cardiac surgery:preliminary observation of a 6-month follow-up study[J].Eur Neurol,2001,45(3):151-9.
[6]Kessler F H,Woody G,Portela L V,et al.Brain injury markers(s100β and NSE)in chronic cocaine dependents[J].Rev Bras Psiquiatr,2007,29(2):134-9.
[7]Li P,Matsunaga K,Yamakuni T,Ohizumi Y.PicrosidesⅠ and Ⅱ,selective enhancers of the mitogen-activated protein kinase-dependent signaling pathway in the action of neuritogenic substances on PC12D cells[J].Life Sci,2002,71(15):1821-35.
[8]陶移文,刘建文,魏东芝,等.胡黄连苷Ⅱ在体外对PC12细胞损伤的保护作用[J].中国临床药理学与治疗学,2003,8(1):27-30.
[8]Tao Y W,Liu J W,Wei D Z,et al.Protective effect of picroside-Ⅱon the damage of cultured PC12 cellsin vitro[J].Chin J Clin Pharrmacol Ther,2003,8(1):27-30.
[9]郭明川,曹 艳,刘建文,等.胡黄连苷Ⅱ在谷氨酸诱导的PC12细胞损伤中的保护作用[J].中国临床药理学与治疗学,2007,12(4):440-33.
[9]Guo M C,Cao Y,Liu J W.Protective effects of picrosideⅡon glutamate injury of PC12 cells[J].Chin J Clin Pharmacol Ther,2007,12(4):440-33.
[10]银建军,张 伟,杜 芳.胡黄连提取物对大鼠脑缺血再灌注后半暗带区细胞凋亡及Bcl-2基因表达的影响[J].山东中医杂志,2005,24(6):364-6.
[10]Yin J J,Zhang W,Du F.Effects of picrorhiza extractive on the apoptosis and expression of Bcl-2 gene in cerebral ischemia reperfusion penumbra in rats[J].Shandong J Tradit Chin Med,2005,24(6):364-6.
[11]李 震,秦丽华,郭云良,等.胡黄连苷Ⅱ对大鼠脑缺血再灌注损伤的干预作用[J].解剖学报,2010,41(1):9-12.
[11]Li Z,Qin L H,Guo Y L,et al.Interference effect of picroside Ⅱon cerebral ischemia reperfusion injury in rats[J].Acta Anat Sin,2010,41(1):9-12.
[12]Guo Y L,Xu X Y,Li Q,et al.Anti-inflammation effects of PicrosideⅡ in cerebral ischemic injury rats[J].Behavioral Brain Function,2010,6:43-53.
[13]Li Q,Li Z,Xu X Y,et al.Neuroprotective properties of picrosideⅡ in rat model of focal cerebral ischemia[J].Int J Mol Sci,2010,11(11):4580-90.
[14]李 震,徐新颖,沈 卫,等.胡黄连苷对大鼠脑缺血再灌注损伤 NFκB 和 IκB 的干预作用[J].中国药理学通报,2010,26(1):52-6.
[14]Li Z,Xu X Y,Shen W,et al.The interferring effects of picrosideⅡ on the expressions of NFκB and IκB following cerebral ischemia reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(1):52-6.
[15]郭云良,沈 卫,杜 芳,等.胡黄连苷Ⅱ对大鼠脑缺血再灌注损伤后 TLR4及 NF-κB表达的影响[J].中国中西医结合杂志,2011,31(1):58-61.
[15]Guo Y L,Shen W,Du F,et al.Effect of PicrosideⅡon Expressions of TLR4 and NF-κB in rats with cerebral ischemia reperfusion injury[J].Chin Integr Tradit West Med,2011,31(1):58-61.
[16]李 琴,郭云良,李 震,等.胡黄连苷Ⅱ对大鼠脑缺血/再灌注损伤Caspase-3和PARP表达的影响[J].中国药理学通报,2010,26(3):342-5.
[16]Li Q,Guo Y L,Li Z,et al.The interference of picrosideⅡ on the expressions of Caspase-3 and PARP following cerebral ischemia reperfnsion injury in rats[J].Chin Pharmacol Bull,2010,26(3):342-5.
[17]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[18]Bederson J B,Pitts L H,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-6.
[19]Butterworth R J,Wassif W S,Sherwood R A,et al.Serum neuronspecific enolase,carnosinase,and their ratio in acute stroke[J].Stroke,1996,27(11):2064-8.
[20]Abra H D,Butterworth R J,Bath P M,et al.Serum S-100 protein relationship to clinical outcome in acute stroke[J].Ann Clin Biochem,1997,34(4):366-70.
[21]Naeimi Z S,Weinhofer A,Sarahrudi K.Predictive value of S-100β protein and neuron specific-enolase as markers of traumaticbrain damage in clinical use[J].Brain Inj,2006,20(5):463-8.
[22]金丽英,刘真友,杨学伟,等.兔脑缺血再灌注后NSE和S-100的表达及其血清水平的变化[J].中国康复医学杂志,2007,22(11):964-7.
[22]Jin L Y,Liu Z Y,Yang X W,et al.The expressions and serum levels of NSE and S-100 following cerebral ischemia and reperfusion in rabbits[J].Chin J Rehabil Med,2007,22(11):964-7.
[23]牛廷献,史智勇,罗建军,等.缺血缺氧脑损伤大鼠 NSE和S100β蛋白的变化及其临床意义[J].中国比较医学杂志,2009,19(9):34-7.
[23]Niu T X,Shi Z Y,Luo J J,et al.The change of NSE and S100β protein and their clinical significance in cerebral ischemia rats[J].Chin J Compar Med,2009,19(9):34-7.
