川芎嗪对脂多糖诱导内皮细胞花生四烯酸通路炎症反应的影响
2012-12-06王国峰陈冬梅
王国峰,赵 霞,李 宁,陈冬梅
(1.济南军区总医院干部病房三科,山东 济南 250031;2.中国科学院生物物理研究所脑与认知科学中心,北京 100101)
动脉粥样硬化(atherosclerosis,AS)是多因素诱导的慢性炎性疾病,内皮细胞功能异常为其始动环节[1-4]。脂多糖(1ipopolysaccharide,LPS)可与内皮细胞 TLR4(Toll-like receptor 4)受体结合,激活MAPK、JAK/STAT等信号通路,促使NF-κB入核,导致炎症和黏附分子表达[5],LPS在 AS整个发生发展过程中都起着非常重要的作用[6]。花生四烯酸(arachidonicacid,AA)通路在内皮细胞活化相关的信号转导及内膜增殖中发挥重要作用。其中限速酶——环氧酶-2(cyclooxygenase-2,COX-2)和 5-脂氧酶(5-lipoxygenase,5-LOX),可催化炎症因子PGE2及白三烯类(leukotriene,LTs)生成,在泡沫细胞中大量表达[7]。5-LOX结合蛋白(5-lipoxygenase activating protein,FLAP)是定位于核膜上的膜结合蛋白,介导LOX锚定到核膜上,FLAP基因突变与心梗危险性密切相关,FLAP抑制剂MK-886可减轻载脂蛋白E和低密度脂蛋白受体双敲除小鼠AS斑块形成[8]。
川芎嗪(ligustrazine,LIG)是川芎的主要活性成分,广泛应用于治疗心绞痛和脑缺血[9]。近年有报道LIG保护内皮细胞,提高机体NO水平等[10],但对于内皮细胞上其他受体及信号转导系统的研究均无涉及。
本文从内皮损伤这一始动环节入手,以LPS诱导原代培养人冠状动脉内皮细胞炎症模型,观察LIG对AA通路炎症反应的影响;进一步研究对其偶联的MAPK和STAT通路的影响。为深入理解LIG抗AS机制,拓展其临床适应症奠定基础。
1 材料与方法
1.1 细胞系 人冠脉内皮细胞系CC-2585(批号1F2025)及培养基EGM-2(含胎牛血清及7种生长因子如 hydrocortisone、hFGF-B、EGF、R3-IGF-1、ascorbic acid、hEGF、GA-1000)购于毕龙公司。
1.2 药品与试剂 盐酸LIG(纯度98.5%):中国药品与生物制品检定所。I型胶原酶、胰蛋白酶:Sigma公司产品;DMEM培养基、新牛血清:Gibco公司产品;LPS:Sigma公司产品;COX-2、5-LOX、FLAP、p-p38MAPK和 p-STAT3抗体购自 Santa Cruz Biotechnology Inc;SuperSignal West Pico chemiluminescent substrate购自 Pierce(Rockford,IL)。其它试剂均为国产分析纯试剂。
1.3 人冠脉内皮细胞的培养 T25培养瓶用2%明胶包被,4℃过夜,将CC-2585人冠状动脉内皮细胞从液氮中取出后37℃水浴3 min使之解冻后均匀分到培养瓶中,加入人的培养基EGM-2后37℃,5%CO2孵箱中培养,24 h细胞贴壁后第1次换液。以后按常规培养,细胞长至融合,按1∶2进行传代。
1.4 LPS诱导的内皮细胞炎症损伤实验模型 将细胞以2 ×108·L-1接种于6 孔板,每孔1.5 ml,细胞总数为3×105个/孔,待细胞稳定24 h后,用无血清EGM-2培养基预处理(pH 7.2),LIG以EGM-2培养基配置成浓度为1 mmol·L-1的浓缩液。内皮细胞分组如下:①正常对照组(培养基中为标准内皮细胞培养液);②LPS组(培养基中加入终浓度为1 mg·L-1的 LPS孵育2 h);③ LPS+LIG 组:在给予 LPS前,以LIG(1 和10 μmol·L-1)预处理细胞6 h;④ LPS+LIG+p-p38MAPK抑制剂SB203580或JAK2抑制剂AG490组:在给予LPS前,以LIG(10 μmol·L-1)和 p-p38MAPK 抑制剂 SB203580(20 μmol·L-1)或 p-STAT3抑制剂 AG490(30 μmol·L-1)同时预处理细胞6 h。
1.5 Western blot RIPA裂解液 (Tris-HCl 50 mmol·L-1,pH 7.4 NaCl 150 mmol·L-1,EDTA 1 mmol· L-1,Na-deoxycholate 0.25%,NP-40 1%,PMSF 1 mmol·L-1,Na3VO41 mmol·L-1,NaF 1 mmol·L-1,Aprotinin 10 mg·L-1,leupeptin 5 mg·L-1,pepstatin 5 mg·L-1)重悬 5×106cells,冰上裂解45 min。裂解液14 000×g离心15 min。Lowry法测定上清中的蛋白浓度。样品经SDS/PAGE电泳分离后转移至PVDF膜。5%脱脂奶粉封闭1 h,然后一抗4℃孵育过夜。TBST洗3次,每次10 min,然后与二抗孵育1 h。TBST洗3遍后显影。
2 结果
2.1 对COX-2蛋白表达的影响 LIG对LPS诱导内皮细胞COX-2蛋白表达的影响如Fig 1所示,LPS可诱导COX-2蛋白表达水平增高,LIG 1和10 μmol·L-1,可使其蛋白水平分别降低为模型组0.21倍和0.25倍(P<0.01);p-p38MAPK抑制剂SB203580则可使其蛋白水平增高为LIG(10 μmol·L-1)组的4.17倍(P<0.01)。
2.2 对5-LOX蛋白表达的影响 LIG对LPS损伤内皮细胞后5-LOX蛋白表达的影响如Fig 2所示。LPS可诱导5-LOX蛋白表达水平增高,LIG 1和10 μmol·L-1,可使其蛋白水平分别降低为模型组的0.20倍和0.37倍(P<0.01);SB203580则可使其蛋白水平增高为 LIG(10 μmol·L-1)组的1.16倍(P<0.01)。
2.3 对FLAP蛋白表达的影响 LIG对LPS损伤内皮细胞FLAP蛋白表达的影响如Fig 3所示。LPS可诱导 FLAP蛋白表达水平增高,LIG 10 μmol·L-1,可使其蛋白水平降低为模型组的0.42倍(P<0.01),1 μmol·L-1低剂量组对 FLAP 蛋白表达无影响(P>0.01);SB203580则可使其蛋白水平增高为 LIG(10 μmol·L-1)组的2.89 倍(P<0.01)。
2.4 对MAPK通路磷酸化激活的影响 LPS可诱导MAPK通路中p38MAPK磷酸化水平升高而激活,LIG 1 和 10 μmol·L-1,可使其磷酸化水平分别降低为模型组的0.50倍和0.07倍(P<0.01);SB203580则使其磷酸化水平增高为LIG(10 μmol·L-1)组的17.80倍(P<0.01,Fig 4)。

Fig 1 Effect of ligustrazine on the protein expression of COX-2 in coronary endothelial cells induced by LPS(±s,n=4)

Fig 2 Effect of ligustrazine on the protein expression of 5-LOX in coronary endothelial cells induced by LPS(±s,n=4)
2.5 对JAK2/STAT3通路磷酸化激活的影响LPS可诱导JAK2/STAT3通路中STAT3蛋白磷酸化水平升高而激活,LIG 1 和 10 μmol·L-1可使其磷酸化水平分别降低为模型组的0.48倍和0.28倍(P<0.01);JAK2特异性抑制剂AG490则使其磷酸化水平增高为LIG(10 μmol·L-1)组的4.55倍(P<0.01,Fig 5)。
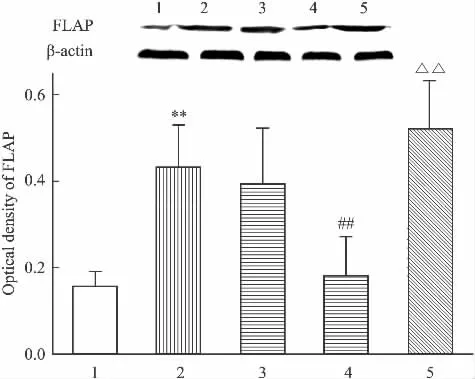
Fig 3 Effect of ligustrazine on the protein expression of FLAP in coronary endothelial cells induced by LPS(±s,n=4)
1:Control;2:LPS;3:LPS+LIG(1 μmol·L-1);4:LPS+LIG(10 μmol·L-1);5:LPS+LIG(10 μmol·L-1)+SB203580.**P<0.01vscontrol;##P<0.01vsLPS;△△P<0.01vsLPS+LIG

Fig 4 Effect of ligustrazine on the protein expression of p-p38MAPK in coronary endothelial cells induced by LPS(±s,n=4)
3 讨论
3.1 抑制花生四烯酸炎症通路,改善内皮功能为其抗AS关键环节 目前关于LPS在AS形成中对AA通路炎症反应及其信号通路的研究尚不够系统和深入,尚无靶向内皮细胞,抑制该通路及其相关信号转导系统的安全有效、毒副作用低的临床药物应用。但国内外已有研究表明,AA代谢的限速酶COX-2、5-LOX及结合蛋白FLAP在AS发生发展的不同阶段均发挥重要作用[11]。免疫组织化学研究也表明:5-LOX、FLAP及LTA4水解酶等在AS斑块区表达明显增加,并与内膜损伤区的巨噬细胞共定位,5-LOX强效抑制剂VIA-2291可剂量依赖性地降低急性冠脉综合症患者斑块的不稳定性[12];在ApoE-/-小鼠AS模型上,FLAP在主动脉中上调最多,FLAP抑制剂MK-886可明显降低斑块面积。

Fig 5 Effect of ligustrazine on the protein expression of p-STAT3 in coronary endothelial cells induced by LPS(±s,n=4)
本研究在LPS诱导体外AS炎症反应模型上的结果表明,LIG可有效抑制LPS诱导的内皮细胞COX-2、5-LOX及 FLAP蛋白表达,且与其阻断MAPK磷酸化激活密切相关。因此,抑制AA通路炎症反应,改善内皮功能是LIG抗AS关键始动环节。
3.2 抑制MAPK和JAK2/STAT3通路活化为其抗AS形成的新途径 MAPK信号途径的激活很可能是各种致AS病变因素的共同通路,p38MAPK途径参与对炎症因子、黏附分子的调控,促进AS进程。MAPK磷酸化水平升高与AS患者颈动脉斑块内膜增厚关系密切。有研究表明,AA可通过MAPK激活蛋白激酶2促进5-LOX在Ser-271部位的磷酸化,促进炎症反应[13]。本研究表明,LIG通过下调p38MAPK磷酸化而抑制LPS诱导的内皮细胞AA通路炎症因子 COX-2、5-LOX及 FLAP表达,p-p38MAPK特异性抑制剂SB203580逆转LIG的内皮保护作用。提示,LIG抑制LPS诱导的内皮AA通路激活是通过MAPK通路实现。
抑制内皮细胞JAK2/STAT3通路的激活,可明显抑制EC炎症反应,对抗EC损伤,有报道,JAK2特异性抑制剂AG490可明显抑制牛主动脉EC中LDH渗出,降低黏附分子 PECAM-1表达,抑制STAT3磷酸化激活[14]。本研究中,LIG通过下调STAT3磷酸化蛋白的表达而抑制LPS诱导的内皮损伤作用,JAK2特异性抑制剂AG490可翻转LIG的内皮保护作用。提示抑制JAK2/STAT3通路激活是LIG抗LPS诱导内皮AA通路炎症反应的另一新型通路。因此,抑制内皮MAPK和JAK2/STAT3通路激活为LIG抗AS形成的新途径。
[1]Libby P,Ridker P M,Hansson G K.Progress and challenges in translating the biology of atherosclerosis[J].Nature,2011,473(7347):317-25.
[2]Koenen R R,von Hundelshausen P,Nesmelova I V,et al.Disrupting functional interactions between platelet chemokines inhibits atherosclerosis in hyperlipidemic mice[J].Nat Med,2009,15(1):97-103.
[3]Furchgott R F,Zawadzki J V.The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine[J].Nature,1980,288(5789):373-6.
[4]Puntmann V O,Bigalke B,Nagel E.Characterization of the inflammatory phenotype in atherosclerosis may contribute to the development of new therapeutic and preventative interventions[J].Trends Cardiovasc Med,2010,20(5):176-81.
[5]Shih R H,Yang C M.Induction of heme oxygenase-1 attenuates lipopolysaccharide-induced cyclooxygenase-2 expression in mouse brain endothelial cells[J].J Neuroinflamm,2010,7:86.
[6]Hui X,Li H,Zhou Z,Xu A.Adipocyte fatty acid-binding protein modulates inflammatory responses in macrophages through a positive feedback loop involving c-Jun NH2-terminal kinases and activator protein-1[J].J Biol Chem,2010,285(14):10273-80.
[7]Choi J H,Jeon H J,Park J G,et al.Anti-atherogenic effect of BHB-TZD having inhibitory activities on cyclooxygenase and 5-lipoxygenase in hyperlipidemic mice[J].Atherosclerosis,2010,212(1):146-52.
[8]Sampson A P.FLAP inhibitors for the treatment of inflammatory diseases[J].Curr Opin Investig Drugs,2009,10(11):1163-72.
[9]李建生,刘敬霞,王 冬,等.大黄苷元注射抗大鼠脑缺血损伤炎性级联反应[J].中国药理学通报,2007,23(1):114-8.
[9]Li J S,Liu J X,Wang D,et al.Rhubarb aglycone injection antagonism to inflammatory cascade reaction of rats with cerebral ischemia injury[J].Chin Pharmacol Bull,2007,23(1):114-8.
[10]崔 磊,王守训,刘新泳.川芎嗪在抗动脉粥样硬化中的作用和机制[J].医学综述,2008,14(22):3491-2.
[10]Cui L,Wang S X,Liu X Y.The effective mechanism of tetramethylpyrazine in anti-atherosclerosis[J].Med Recap,2008,14(22):3491-2.
[11]Poeckel D,Zemski Berry K A,Murphy R C,et al.Dual 12/15-and 5-lipoxygenase deficiency in macrophages alters arachidonic acid metabolism and attenuates peritonitis and atherosclerosis in ApoE knock-out mice[J].J Biol Chem,2009,284(31):21077-89.
[12]Cao R Y,St Amand T,Habenicht A J.Genetic and pharmacological inhibition of the 5-lipoxygenase/leukotriene pathway in atherosclerotic lesion development in ApoE deficient mice[J].Atherosclerosis,2009,203(2):395-400.
[13]Werz O,Szellas D,Steinhilber D,et al.Arachidonic acid promotes phosphorylation of 5-lipoxygenase at Ser-271 by MAPK-activated protein kinase 2(MK2)[J].J Biol Chem,2002,277(17):14793-800.
[14]Neria F,Caramelo C,Peinado H,et al.Mechanisms of endothelial cell protection by blockade of the JAK2 pathway[J].Am J Physiol Cell Physiol,2007,292(3):C1123-31.
