汉防己甲素聚乳酸微球的安全性评价Δ
2012-12-03胡泽丽程国华庞廷媛汪小乐广州医学院附属肿瘤医院药剂科广州510095
胡泽丽,程国华,庞廷媛,陈 娟,汪小乐(广州医学院附属肿瘤医院药剂科,广州 510095)
汉防己甲素(Tetrandine,TET)是从防己科植物的干燥块根中提取出来的一种双苄基异喹啉类生物碱,有抗心肌缺血、抑制血小板聚集、解痉、镇痛、镇静、抗炎、抗溃疡等药理作用。临床上TET对矽肺、风湿痛有一定疗效,常与低剂量放射合并治疗肺癌,为放射治疗肿瘤增效药物[1]。TET iv有局部刺激性,而以无毒可生物降解的聚乳酸为载体,制成肺靶向制剂能提高肺部药物浓度,减轻局部刺激性和全身毒副作用。因此,以聚乳酸为载体,采用液中干燥法制备肺靶向微球平均粒径为80.3%,载药量为46.9%[2],同法制备聚乳酸空白微球(PLA-MC)。为评价TET聚乳酸微球(TET-MC)的安全性,笔者按照国家食品药品监督管理局(SFDA)2005年颁布编号为[H]GDT4-1“化学药物刺激性、过敏性和溶血性研究技术指导原则”的要求进行制剂安全性的评价。
1 仪器与材料
1.1 仪器
RW20 DZM.n型强力流线型搅拌机(德国IKA公司);5810型台式高速离心机(德国Eppendorf公司);TC-120型智能程控生物组织自动脱水机、TB-718型生物组织自动包埋机(孝感市泰维电子设备有限公司);HM450型电脑程控式切片机(德国Microm GmbH公司);CFM-500型倒置荧光显微镜摄像系统(德国Zeiss公司)。
1.2 试药
TET原料药(西安山川生物技术有限公司,批号:20100409);TET注射液(江西银涛药业有限公司,批号:H20053840);聚乳酸(济南岱罡生物科技有限公司,分子量:10000);TET-MC(载药量:46.9%,批号:20110415)、PLA-MC(批号:20110507)、卵白蛋白均为笔者自制;弗氏完全佐剂(美国Sigma公司,规格:F5881-10 mL)。
1.3 动物
SPF级昆明种小鼠150只,♀♂兼半,体重18~22 g;新西兰兔18只,♀♂兼半,体重2.0~2.5 kg;SD大鼠32只,♀♂兼半,220~240 g,以上动物均由广东省医学实验动物中心提供(动物生产许可证号:SCXK(粤)2008-0002)。
2 方法[3]与结果
2.1 急性毒性实验
以生理盐水为分散介质配制供试样品。实验分为3个大组,每组设定5个剂量,根据预实验结果,将TET注射液①、②、③、④、⑤(65.00、52.00、41.60、33.28、26.24mg·kg-1)组、PLA-MC①、②、③、④、⑤(800.00、640.00、512.00、409.60、327.68 mg·kg-1)组、TET-MC①、②、③、④、⑤(250.00、200.00、160.00、128.00、102.40 mg·kg-1)组剂量间距调整为0.8。取禁食12 h昆明种小鼠150只,按体重、性别随机均分为15组,分别尾iv相应药物。给药后连续观察6 h,如无异常则终止持续观察,改为每天观察1次,观察至给药后第14天。记录各组小鼠的死亡情况、体重变化。对实验过程中因濒死而处死的小鼠、死亡的小鼠和实验结束时仍存活的小鼠均进行大体解剖,观察主要脏器变化,变化若有异常均记录并进行组织病理学检查。采用Bliss法计算小鼠的半数致死量(LD50)与95%可信限。小鼠尾iv高剂量(65 mg·kg-1)TET注射液,小鼠立即出现躁动不安,呼吸困难,惊厥、抽搐死亡,死亡多发生于5 min内,其它剂量组小鼠部分抽搐死亡,未死亡的小鼠14 d后仍活动正常;尾iv高剂量TET-MC(800mg·kg-1)、PLA-MC(250mg·kg-1)后,小鼠立即呼吸困难、死亡,其它剂量组部分小鼠呼吸急促后死亡,部分小鼠数分钟后缓解,14 d后仍活动正常。死亡小鼠经解剖,肉眼观察肺部有瘀血,其余器官未见明显变化。小鼠一次性尾iv药物后的LD50测定结果见表1。
2.2 血管刺激性实验

表1 小鼠一次性iv药物后的LD50测定结果Tab 1 The LD50level of different drugs in mice after one time intravenous administration
新西兰兔12只,随机分为2组,每组6只,采用同体左右侧自身对比法,观察血管刺激性。第1组左耳iv TET-MC混悬液(8 mg·kg-1),右耳iv等容生理盐水作为阴性对照;第2组左耳iv TET注射液(8 mg·kg-1),右耳iv等容生理盐水作为阴性对照。给药体积1 mL,每天1次,连续3 d,每天给药前和末次给药后48 h对兔和注射部位进行肉眼观察,观察结束后每组各处死一半兔,于注射处1 cm左右取一段血管,立即放入10%的甲醛溶液中固定,进行常规病理组织学检查。留存一半兔继续进行14 d的恢复期观察,观察期结束后按同样的方法处死、取材进行组织学检查。各组给药后,除由注射操作原因引起的红肿外,局部血管注射部位均无明显充血、肿胀等现象。病理组织切片显示,新西兰兔耳缘iv部位未见损伤性病变,静脉管壁完整,未见炎症反应等病变,表明TET注射液和TET-MC在实验剂量下无明显的血管刺激性。耳缘静脉病理组织切片见图1。
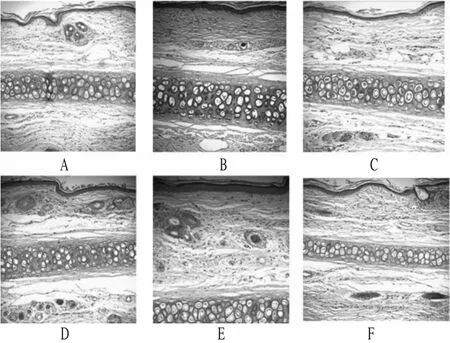
图1 耳缘静脉病理组织切片图(100×)Fig 1 Pathohistological photograph of ear vein(100×)
2.3 肌肉刺激性实验
新西兰兔6只,采用自体左右侧对比法,观察肌肉刺激性。第1组左腿股四头肌im TET注射液(8 mg·kg-1),右腿股四头肌im等容生理盐水作阴性对照;第2组左腿股四头肌im TET-MC混悬液(8 mg·kg-1),右腿股四头肌im等容生理盐水作为阴性对照。给药体积1 mL,每天1次,连续3 d。注射后观察新西兰兔状态,14 d后解剖取出股四头肌,纵向切开,观察注射部位局部刺激反应及可逆反应的程度,取材进行组织学检查。病理组织切片显示,给药14 d后阴性对照组兔肌肉组织正常,未见炎症损伤;TET注射液组有炎症反应及肌肉组织纤维化;TET-MC组可见微球分布于肌肉中,微球周围有炎症反应,肌纤维有冲断的现象,表明TET注射液、TET-MC都有一定的肌肉刺激性。肌肉组织病理切片见图2。

图2 肌肉组织病理切片图(14d,100×)Fig 2 Pathohistological photograph of muscular(14d,100×)
2.4 被动皮肤过敏性实验(PCA)
SD大鼠8只,均分为4组,分别为阴性对照(生理盐水)、阳性对照(卵白蛋白)和TET-MC高、低剂量(30、10mg·kg-1)组。每组定时、无菌、间日sc供试液1 mL,共3次,ip弗氏完全佐剂0.5mL/只,末次致敏后10d心脏采血,2000r·min-1离心10 min-1,分离血清,-20℃贮藏,备用。
另取相应大鼠,分组同上,每组6只,♀♂各半,乙醚浅麻醉,背部预先脱毛4点(脊柱两侧),每点面积约为3×4 cm2,同时配制各组血清iv生理盐水稀释液(1∶2、1∶4、1∶8、1∶16),备用。每只大鼠于脱毛处某一点sc 0.1 mL一种上述血清。被动致敏24 h后,各组iv与致敏剂量相同的激发抗原加等量0.5%伊文思蓝染料共1 mL,进行激发。30 min后麻醉处死各组大鼠,剪取背部皮肤,测量皮肤内层的斑点大小,直径>5 mm者判断为阳性。不规则斑点的直径为长径与短径之和的一半。
结果,阳性对照组蓝斑直径均>5 mm,TET-MC高、低剂量和生理盐水组蓝斑直径均<5 mm,表明被动皮肤过敏结果为阴性。SD大鼠PCA实验结果见表2。
4 讨论
采用液中干燥法制备TET-MC,粒径为7~15µm的占80.3%。研究表明[4],TET-MC菌检合格,在室温条件下稳定性良好。小鼠尾iv TET注射液,LD50为41.6 mg·kg-1,与文献[5]报道33.30 mg·kg-1接近,说明本方法可行,TET微球化后LD50提高,毒性明显降低。
表2 SD大鼠PCA实验结果(±s,n=6)Tab 2 Results of PCAtest of SD rats(±s,n=6)

表2 SD大鼠PCA实验结果(±s,n=6)Tab 2 Results of PCAtest of SD rats(±s,n=6)
组别阴性对照组阳性对照组TET-MC低剂量组TET-MC高剂量组致敏鼠数/n 6666阳性反应鼠数(蓝斑直径)/只(mm)1∶20(1.0±0.3)6(26.0±3.2)0(1.0±0.7)0(1.0±0.6)1∶40(1.0±0.1)6(18.0±2.1)0(0.6±0.2)0(1.0±0.2)1∶806(14.4±2.3)001∶1606(10.0±1.8)00
TET临床iv剂量为2.85~4.29 mg·kg-1,血管刺激性预实验时按2.85 mg·kg-1剂量换算成新西兰兔给药剂量14 mg·kg-1给药,给药后出现兔立即死亡的现象,最后采用8 mg·kg-1的给药剂量。
iv 7~12µm的微球通常被肺毛细血管以机械滤过方式截留,集中于肺部表现肺部靶向性。在进行急性毒性实验时,TET-MC高剂量(250 mg·kg-1)组小鼠迅速死亡,病理解剖时发现肺部有瘀血。导致死亡的原因可能有:TET-MC混悬液在贮藏期间容易发生聚集、融合及药物渗漏,导致微球抱成团粒径增大,小鼠脑部或血管栓塞死亡;一次性注射微球过多,大量集中于肺部导致局部栓塞。提示TET-MC应现配现用,使用前尽量混匀,同时应该提高载药量,减少微球用量。肌肉刺激性实验中TET-MC混悬液有炎症反应,可能的原因是聚乳酸的降解是一个复杂的过程,聚乳酸的降解过程中局部酸性积累导致聚乳酸存在部位出现非感染性炎症,甚至局部严重水肿[6]。
总之,对TET-MC的安全性研究结果表明,小鼠尾iv TET-MC混悬液LD50为158.9 mg·kg-1,该微球制剂无溶血性,未见血管刺激性,有轻微的肌肉刺激性,未产生过敏反应,在本实验条件下TET-MC基本安全。
[1]陈志蓉.汉防己甲素的临床应用概述[J].海峡药学,2008,20(8):119.
[2]程国华,王 娟.均匀设计法优化汉防己甲素肺靶向微球的处方及制备工艺[J].中国医院药学杂志,2003,23(7):390.
[3]国家食品药品监督管理局.化学药物刺激性、过敏性和溶血性研究技术指导原则(第二稿)[Z].2005.
[4]程国华,罗佳波.汉防己甲素微球的稳定性研究[J].中药材,2005,28(5):429.
[5]李凤前,陆 彬,陈文彬.肺靶向汉防己甲素缓释微囊的安全性评价[J].中国现代应用药学,2002,19(6):478.
[6]Bergsma JE,Rozema FR,Bos RR,et al.Foreign-body reactions to resorbable poly-(l-lactide)bone plates and screws used for the fixation of unstable zygomatic fractures[J].J Oral Maxillo fac Surg,1993,51(6):666.
