一株红树林真菌胞外多糖免疫增强作用研究
2012-12-02裴华牛莉娜林英姿王华民王永霞邬强夏乾峰
裴华,牛莉娜,林英姿,王华民,王永霞,邬强,夏乾峰
(海南医学院热带医学与检验医学院,海南 海口 571101)
红树林位于海洋和陆地之间的潮间带,该区域土壤具有沼泽化、盐渍化、强酸性和有机质含量高等特点。生长于此的真菌等微生物种类丰富,目前已分离鉴定的红树林真菌超过200余种,已成为海洋真菌的第二大类群。相对与陆生真菌,生长于红树林特殊环境的真菌可能存在特殊的分子适应机制,其代谢产物的表达水平与类型皆有可能独特新颖[1]。
本研究以海南东寨红树林自然保护区作为土壤采样地点,研究该环境中真菌发酵上清中活性产物的免疫调节活性。最终课题组获得了一株产免疫调节活性胞外多糖的真菌菌株,初步鉴定为淡紫色拟青霉。
1 材料和方法
1.1 材料
1.1.1 样本来源
土壤样本采集于海南东寨红树林自然保护区,距
地表5 cm~20 cm采样。采集后放入无菌塑料封口袋内,迅速运回实验室进行样本处理。
1.1.2 人外周血单个核细胞
外周血采集自健康成年男性,无菌条件下聚蔗糖泛影葡胺密度梯度离心法分离获得人外周血单个核细胞[2]。
1.1.3 昆明种小鼠
昆明种小鼠购买自广州省医学实验动物中心;绵羊红细胞、鸡红细胞均获取自海南省药物安全性评价中心。
1.1.4 其他主要试剂
发酵培养基采用大豆粉玉米粉培养基(大豆粉10.0g,玉米粉 10.0 g,可溶性淀粉 5.0 g,KH2PO40.5 g,50%陈海水定容至1 L,调pH 7.2)。查氏培养基、分离培养基采用陈海水马丁培养基(50%陈海水配置、0.1%氯霉素):购买自北京陆桥技术有限责任公司。香菇多糖购买自南京康海药业有限公司:国药准字H10950078。ConA购自Sigma公司,RPMI1640培养液:购自GIBCO公司。新生牛血清:购自杭州四季青工程材料有限公司。其余试剂均为分析纯。
1.2 方法
1.2.1 真菌菌株的分离纯化
称取10 g土壤样本,在无菌操作下加入100 mL无菌陈海水的三角瓶中,充分振荡混匀后,进行10倍稀释,取样本上清制备成10-2至10-4不同稀释度,各稀释度取100μL涂布于分离培养基上,28℃培养,对平板上不同形态菌落进行编号并观察记录[3]。
1.2.2 EPS的获取
挑取单菌落接种于发酵培养基中,发酵5d(250r/min,28℃),发酵液离心后(3000 r/min,4℃,20 min)取上清。发酵上清4℃10000 r/min离心20 min后,上清液以3倍体积冰乙醇4℃沉淀。24 h后4℃条件下4520 g离心15 min后,沉淀溶于去离子水中。链蛋白酶+Sevag法联合脱蛋白[4]后,-50℃条件下冻干48 h后备用。
1.2.3 人外周血单个核细胞增殖刺激实验(MTT法)
无菌条件下分离获得人外周血单个核细胞,96孔细胞培养板内每孔中加入人外周血单个核细胞1×105个。在待测样本孔中加入含5 mg/mL EPS的RPMI1640培养液100μL,阳性对照孔内加入含5mg/ml刀豆蛋白 A(ConA)RPMI1640 培养液 100μL,正常对照孔内加入RPMI1640培养液100μL,各组培养液中新生牛血清含量均为10%,每个样本3个复孔。37℃,5%CO2培养72 h后,加入含5 mg/mL MTT基础培养液20μL,37℃,5%CO2培养。4 h后弃培养上清,每孔中加入100μL二甲亚砜,振荡器振摇10 min,酶联免疫检测仪492 nm波长进行测定,630 nm参比波长,实验重复3 次[5]。
1.2.4 动物免疫实验
应用上述方法从菌株发酵液中获得大量胞外多糖冻干粉末后,以昆明种小鼠进行动物体内实验,评价活性产物对动物免疫功能影响情况[6]。实验动物为昆明种小鼠,雌雄随机,8~10 周龄,体重(20±3.0)g。随机将小鼠分为3组,每组20只,实验组以生理盐水溶解胞外多糖冻干粉末(50 mg/kg)灌胃,阳性对照组以生理盐水溶解香菇多糖(50 mg/kg)灌胃,正常对照组灌胃生理盐水,灌胃体积1 mL,1次/d,连续28 d。
1.2.4.1 脏体指数测定
末次给药后,禁食不禁水12 h,分别称重。脱颈椎处死后剥离脾脏、胸腺称重并计算脾脏/体重和胸腺/体重比值。
1.2.4.2 迟发型过敏反应测定
末次给药后,动物致敏前腹部脱毛,以1%二硝基氟苯(DNFB)5μL涂于小鼠腹部脱毛处,连续致敏4 d后右耳双面涂以DNFB 10μL,24 h后处死小鼠,打孔器摘取左、右耳片各8 mm,称重。
1.2.4.3 血清溶血素抗体生成测定(HC50)
小鼠于首次给药后23 d,每只腹腔注射0.2 mL 4%(体积分数)的绵羊红细胞致敏。于末次给药后12 h,摘眼球收集血液。分离血清,按体积比1∶200生理盐水稀释。测定小鼠血清溶血素含量,计算半数溶血值(HC50)。
1.2.4.4 巨噬细胞吞噬功能测定
末次给药后于小鼠腹腔注射2%溶解淀粉溶液1 mL,次日腹腔注射5%鸡红细胞0.5 mL,40 min后处死小鼠,取腹腔液涂片,瑞氏-姬姆萨染色,油镜下计数100个MФ中已吞噬鸡红细胞的MФ数及未吞噬数。
1.2.5 菌株分类鉴定
对菌株PH0016进行形态学鉴定;同时对菌株ITS序列进行分析,进行系统发育分析[7]。
2 结果
2.1 菌株分离、筛选、刺激人外周血单个核细胞增殖活性检测结果
从东寨红树林自然保护区土壤样本中共分离得到真菌536株,其中菌株PH0016的EPS促进人外周血单个核细胞增殖较为突出和稳定,被应用于后续研究,实验结果见表1。相比于正常对照,菌株PH0016所产生的EPS在体外对于人外周血单个核细胞具有较显著的刺激增殖作用(P<0.05)。
表1 菌株PH0016EPS对单个核细胞增殖的影响()Table1 Effect of EPS from strain PH0016 on proliferation of PBMC

表1 菌株PH0016EPS对单个核细胞增殖的影响()Table1 Effect of EPS from strain PH0016 on proliferation of PBMC
注:*与正常对照组比较,P<0.05。
2.2 脏体指数
根据表2所示实验结果表明,菌株PH0016所产生的EPS小鼠灌胃28 d后,相比于正常对照,小鼠的脾脏/体重、胸腺/体重的脏体指数有显著性提高(P<0.05)。
2.3 迟发型过敏反应
根据表2所示实验结果提示,菌株PH0016所产生的EPS可显著促进昆明种小鼠机体对DNFB致敏的反应性,相比于正常对照,经DNFB致敏后耳片重量明显增加(P<0.05)。
表2 菌株PH0016胞外多糖对小鼠脏体指数及迟发型超敏反应的影响()Table 2 Effect of EPS from strain PH0016 on ratio of organs to body and DTH
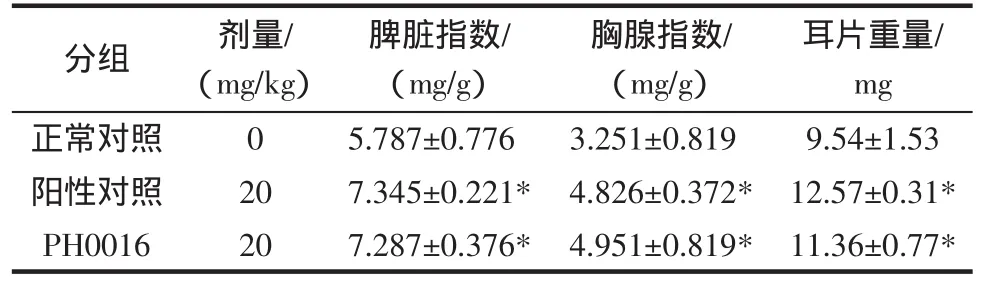
表2 菌株PH0016胞外多糖对小鼠脏体指数及迟发型超敏反应的影响()Table 2 Effect of EPS from strain PH0016 on ratio of organs to body and DTH
注:*与正常对照组比较,P<0.05。
2.4 血清溶血素生成测定(HC50)
经菌株PH0016胞外多糖连续灌胃后,相比正常对照HC5021.54±3.27,实验组HC50有显著提高达到124.36±32.56(P<0.01)。小鼠体内针对绵羊红细胞刺激产生的溶血素水平显著提升,实验结果见表3。
表3 EPS对小鼠HC50及吞噬细胞吞噬功能的影响()Table 3 Effect of EPS from strain PH0016 on HC50and phagocytic function
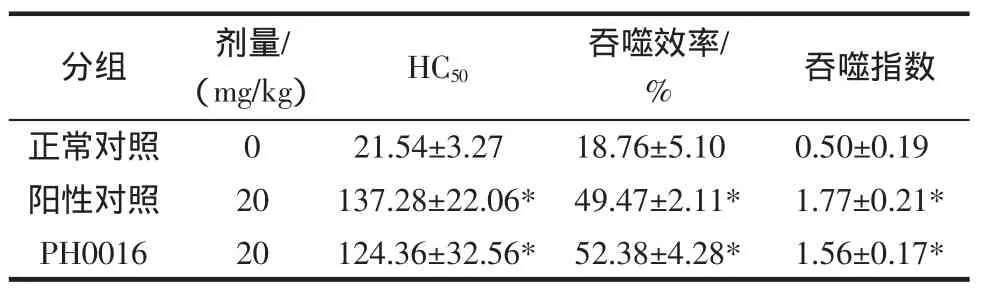
表3 EPS对小鼠HC50及吞噬细胞吞噬功能的影响()Table 3 Effect of EPS from strain PH0016 on HC50and phagocytic function
注:*与正常对照组比较,P<0.01。
2.5 小鼠腹腔巨噬细胞吞噬功能
菌株PH0016胞外多糖连续灌胃后,实验组小鼠腹腔吞噬细胞吞噬鸡红细胞的吞噬效率达到(52.38±4.28)%,吞噬指数为1.56±0.17,相比于正常对照的吞噬效率18.76±5.10和吞噬指数0.50±0.19有显著升高(P<0.01),实验结果见表 3。
2.6 菌株PH0016分类鉴定
2.6.1 菌株PH0016的形态学特征
接种于查氏培养基上培养3 d见菌落生长,7 d直径可达15 mm~18 mm。菌落扁平、质地疏松、粉絮状、淡紫色。表面紫色为产孢层,产孢旺盛,肉眼可见紫色孢子密集。菌落边缘质地疏松,呈白色,菌落背面呈白色。PDA培养基形态同查氏培养基。沙氏培养基上菌落生长速度缓慢,灰白色,中央隆起,质地较疏松,不形成紫色色素。光镜下营养菌丝壁光滑,无色透明。分生孢子梗光滑无色,单个小梗直立于营养菌丝上,瓶梗基部膨大,孢梗上有2~4个瓶梗状的轮生分枝。顶部锥形变细,形成较薄独特的颈,分生孢子成向两侧分开的链状,偶有纠缠,分生孢子呈卵形或近球形,成熟后表面粗糙,透明无色,成团时呈紫色。
2.6.2 ITS序列分析结果
测序获得菌株PH0016ITS序列长度为588 bp。将该序列与Genbank相关序列进行BLAST相似性分析,选取与其同源性较高菌株,用Neighbour Joining method构建系统发育树(图1)。结果显示,PH0016与一株未明确命名的真菌菌株(FJ612890,Fungal sp.ARIZ L99)聚为一支,两者相似率达到100%,其Bootsrap支持率为100%;其分类地位为子囊菌纲(Ascomycetes);肉座菌目(Hypocreales);麦角菌科(Clavicipitaceae);拟青霉属(Paecilomyces)。
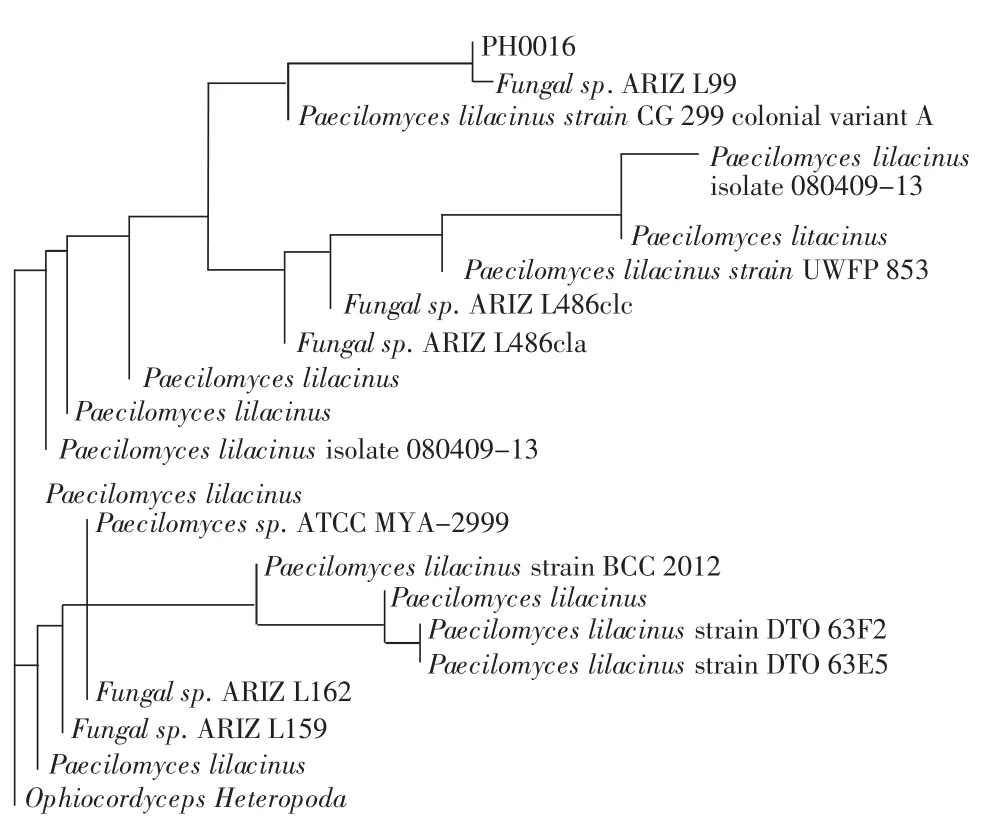
图1 基于ITS序列的菌株PH0016与相关菌株系统发育树Fig.1 Dendrogram of rDNA ITS sequence of PH0016
3 讨论
课题组在海南东寨红树林自然保护区土壤样本中分离得到真菌536株,其中菌株PH0016经初步形态学和系统发育鉴定为淡紫色拟青霉菌株。该菌株所产生的胞外多糖在体外具有较好的刺激人外周血单个核细胞增殖效应。小鼠体内实验发现,该菌株所产生的胞外多糖连续灌胃小鼠后,对于小鼠脏体指数、血清溶血素生成水平、迟发型过敏反应应答能力及小鼠腹腔巨噬细胞吞噬功能均有较为显著的增强效应。这些指标的提升说明,淡紫色拟青霉菌株PH0016所产生的胞外多糖对小鼠特异性和非特异性免疫应答均有一定的增强效果。综合上述分析,课题组从海南近海红树林地区分离获得一株产免疫增强效应胞外多糖的淡紫色拟青霉菌株。
糖单体之间有多种不同的连接方式,可形成不同构型的直链和支链结构。通过单糖分子间氢键及基团的相互作用进一步又可进一步形成不同的高级结构,3个单糖最多可以有27648种可能的排列方式,寡糖链多变的连接方式和分支结构使多糖承载了巨大的生物信息[8-9]。
课题组从海南红树林分离获得一株淡紫色拟青霉,初步证实其胞外多糖具有免疫调节活性,这可能与真菌为适应特殊生存环境而产生独特代谢机制和新颖代谢产物有关。
本研究获得真菌菌株存在于海南红树林底泥之中,对近海环境有较好的适应性。对该菌株生物学性状及代谢途径的进一步研究,以及对菌株所产生EPS的组份与结构的进一步分析,将可能为当地目前日益扩大的近海水产养殖及保健食品开发提供理论研究参考。
[1]CHENG Zhong-shan,PAN Jia-Hui,TANG Wen-cheng,et al.Biodiversity and biotechnological potential of mangrove-associated fungi[J].Forestry research,2009,20(1):63-72
[2]柳忠辉,吕昌龙.免疫学常用实验技术[M].北京:科学出版社,2007:73-76
[3]缪承杜,庄令,林海鹏,等.海南文昌清澜港红树林真菌抗B16肿瘤细胞活性菌株的筛选[J].生物工程学报,2008,24(6):975-979
[4]Säwén E,Huttunen E,Zhang X,et al.Structural analysis of the exopolysaccharide produced by Streptococcus thermophilus ST1 solely by NMR spectroscopy[J].Biomol NMR,2010,47(2):125-134
[5]王新国,刘杞,孙航,等.人肝再生增强因子对人外周血单个核细胞增殖的影响及其机制[J].中国生物制品学杂志,2009,22(10):961-963
[6]黄雨三.保健食品检验与评价技术规范实施手册[M].北京:清华同方电子出版社,2003:369-372
[7]牛莉娜,王英,饶朗毓,等.一株具有免疫增强活性的海南红树林真菌WC1016的分类鉴定[J].海南医学院学报,2011,17(8):1009-1014
[8]戴慧,高晓明.多糖特异性免疫识别的分子机制及其免疫生物学意义[J].中国免疫学杂志,2009,25(1):35-39
[9]Arthur O Tzianabos.Polysaccharide immunomodulators as therapeutic agents:structural aspects and biologic function[J].Clinical microbiology reviews,2000,13(4):523-533
