HPLC法测定曲奇饼干中丙烯酰胺的含量
2012-12-02王志伟傅红杨琳赖冬花
王志伟,傅红,*,杨琳,赖冬花
(1.福州大学生物科学与工程学院,福建 福州 350002;2.福建省海洋环境与渔业资源监测中心,福建 福州 350003)
2002年瑞典科学家发现富含淀粉类食品原料经高温(>120℃)加工后,会产生具神经毒素的丙烯酰胺[1],随后各国的研究机构均证实了这个研究成果[2-3]。2005年4月,我国卫生部发布公告警告公众关注食品中的丙烯酰胺,呼吁采取措施减少食品中的丙烯酰胺含量以确保食品的安全性[4]。曲奇饼干由于具备高糖、高油脂、高温加工的特点,是丙烯酰胺含量较高的食品[5-6]。目前通用的检测方法包括GC、HPLC、MS及三者之间的结合技术[7]。不过,由于食品成分的差异性,特别是针对于油脂和碳水化合物较高的基质,丙烯酰胺的快速准确检测方法仍然是食品分析工作者面临的难题。本研究在以往检测方法的基础上,通过筛选前处理条件[8-10],确定了一种有效的曲奇饼干中丙烯酰胺HPLC检测的方法。
1 材料与方法
1.1 材料与设备
Agilent 1100高效液相色谱仪,配有可变波长检测器(VWD):美国 Agilent公司;Mil1i-Q 超纯水机:美国Millipore公司;LG4000-G3旋转蒸发仪:美国Heidolph公司;Oasis HLB,3cc.60mg:美国 Water公司;MG-2200氮吹仪:日本EYELA公司;3-30K高速离心机:安捷伦科技有限公司;MMV-1000W分液漏斗振动器:日本EYELA公司;T25高速分散机:IKA公司。
丙烯酰胺标准品(纯度大于99%):德国Dr.Ehrenstorfer公司;甲酸(96%)、甲醇、乙酸乙酯均为色谱纯;其他试剂均为国药分析纯。
1.2 方法
1.2.1 曲奇饼干的制作
低筋粉 100 g,白糖 35 g,黄油 50 g,盐 0.7 g,奶粉5 g,鸡蛋 25 g,小苏打 0.5 g,经搅拌、调粉[11]。每个面团称取 5 g(精确至 0.01 g),采用特定的模具(7.6×4.6×2.4 cm)压制成型,然后在190℃条件下烘焙7 min,得到的饼干样品冷却后装入自封袋中,研磨待测。
1.2.2 丙烯酰胺的测定
1.2.2.1 标准溶液的配制
准确称取10 mg(精确到0.0001 g)丙烯酰胺标准品于10 mL棕色容量瓶中,二次超纯水定容至刻度,得到1 mg/mL浓度的标准液,并于4℃冰箱保存。临用时配制浓度为 0.2、0.4、0.6、0.8、1.0μg/mL 的标准使用液。
1.2.2.2 样品处理
[10],称取2.00 g经研磨充分的样品于100 mL带盖聚丙烯离心管中,分别加入(25,250,500μg/kg)丙烯酰胺标准品以确定方法的加标回收率,静置10 min。加入10 mL正己烷,涡旋混合2 min,弃去上层液(重复操作一次),电吹风吹干。分别加入10 mL 0.1%CHOOH和10 mL 2 mol/L NaCl提取液,均质5 min,于50℃水浴中超声振荡20 min,10000 r/min,4℃离心20 min。收集上清液于150 mL分液漏斗中,样品残渣加入10 mL 2 mol/L NaCl重复提取过程,合并上清液,混匀备用。
样品提取液中加入乙酸乙酯充分萃取(30 mL×3,振荡频率280r/min,10min),合并乙酸乙酯层至150mL梨形瓶,于35℃,真空度150 mbar下减压浓缩至约1 mL,将浓缩液转移至10 mL玻璃试管中,梨形瓶中加少量乙酸乙酯充分涤荡3次,合并至试管中,50℃氮气吹干,迅速加入2 mL超纯水重溶并涡旋混合。重溶液过0.45μm水系滤膜,再经过Oasis HLB萃取小柱(依次用1 mL CH3OH和1 mL超纯水活化),弃去前流出液(约7滴~8滴),收集后续液于进样瓶中,上机测定。
1.2.2.3 色谱条件
参考文献[12],根据实验室现有的色谱柱Kromasil ODS(250 mm×4.6 mm,5μm)确定色谱条件:流动相:甲醇-水(5∶95,体积比),流速 0.8 mL/min;检测波长:210 nm,柱温 25℃,进样量 5μL。
根据标样的保留时间,对样品所得色谱图进行定性分析。通过色谱仪工作站数据处理系统,对目标物按外标法进行定量分析,计算样品中丙烯酰胺的含量。
2 结果与讨论
2.1 HPLC流动相的选择
根据实验室现有的Kromasil ODS色谱柱,通过改变流动相中甲醇的比例,来调整丙烯酰胺的保留时间。当选用甲醇-水(5∶95,体积比)为流动相时,丙烯酰胺的出峰时间在5.240 min左右(图1)。随后对样品液进行上机测定,目标物能够很好的与干扰峰实现分离(图 2),最终确定流动相组成为甲醇-水(5∶95,体积比)。
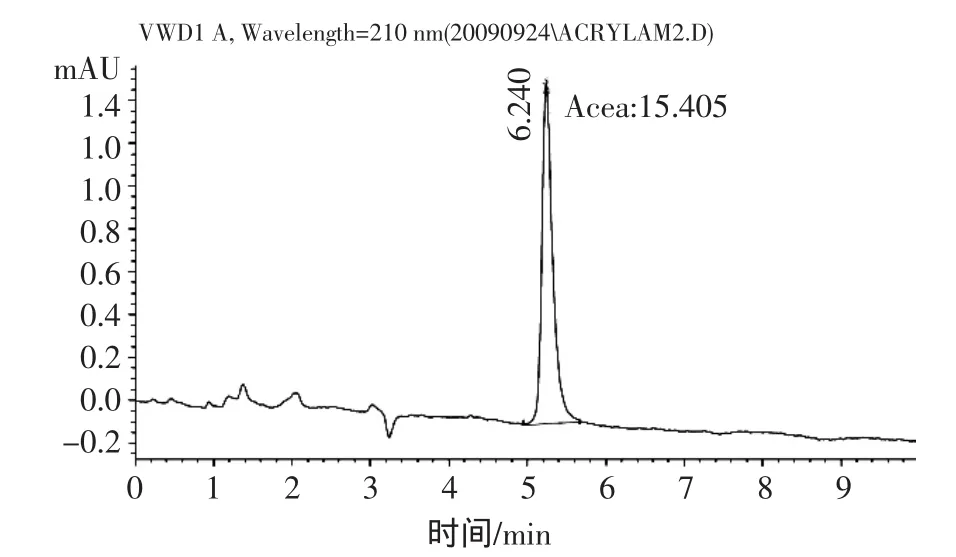
图1 丙烯酰胺标准样色谱图Fig.1 HPLC chromatograms of acrylamide standard
2.2 线性关系及检测限
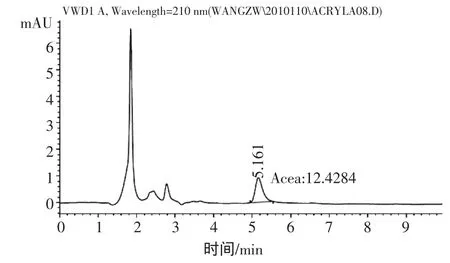
图2 样品中丙烯酰胺检测色谱图Fig.2 HPLC chromatograms of acrylamide in sample
以系列标准溶液进样,以标准物浓度横坐标,对应峰面积为纵坐标进行线性回归分析,由仪器自动积分得到线性回归方程:Y=35.86 X+0.2576,线性系数为0.99980,在测定范围内(0.2μg/mL~1.0μg/mL)线性关系性良好。根据3倍信噪比(S/N),计算该方法的检出限为 4.5(ng/mL);定量限为 14.5(ng/mL)。该范围覆盖了大部分食品中丙烯酰胺的含量,能够满足本实验的分析要求。
2.3 丙烯酰胺提取温度的选择
本实验比较了 25、45、50、55、75 ℃温度对丙烯酰胺提取效果的影响,结果见图3。
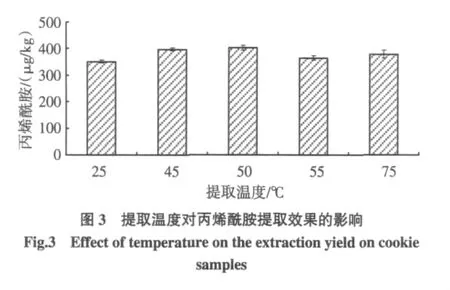
随着温度的提高,丙烯酰胺的检测值略有升高,温度大于50℃时,检测值趋于稳定;其中50℃时的检测值比25℃时提高了14.9%。同时,随着提取温度的升高,水相与有机相分层良好,萃取液澄清。最终选择丙烯酰胺的提取温度为50℃。
2.4 丙烯酰胺提取料液比的选择
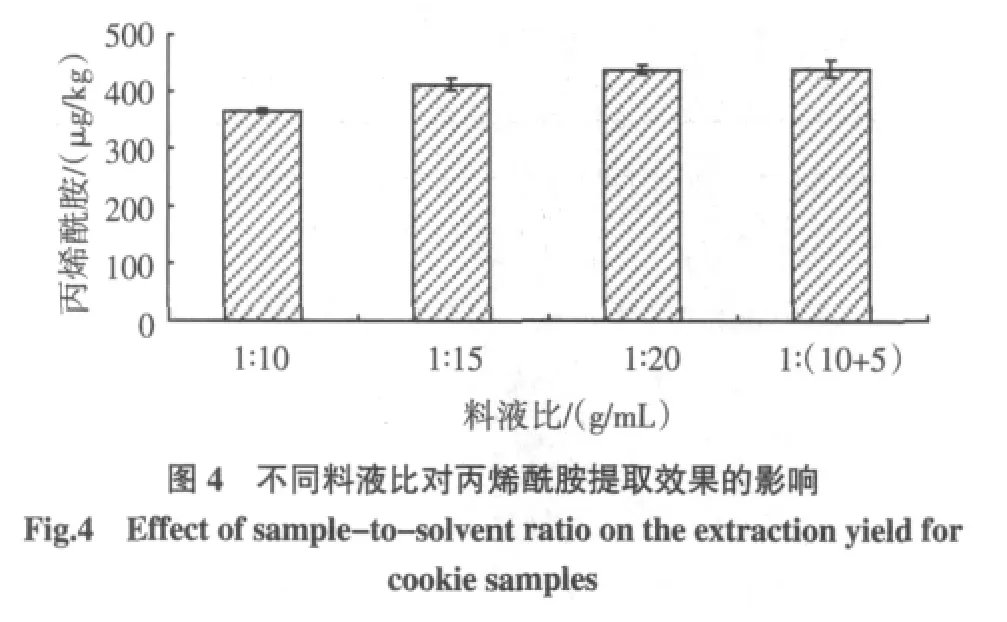
试验中每克样品分别用10、15、20 mL提取溶剂(0.1%甲酸∶2 mol/L NaCl溶液=1∶2,体积比),按照1.2.2.2的方法进行操作,结果见图4。
对于单级提取,提高料液比从10到20对丙烯酰胺得率的影响不显著;当料液比为15时,采取两级提取比单级提取的检测值提高了6.8%,并且获得最大的检测值,在节约成本的同时,对丙烯酰胺的提取更加充分。实验确定采用两次提取,料液比为1∶15(g/mL)。
2.5 乙酸乙酯萃取次数的选择
分别采用不同的萃取次数(1、2、3)对提取液中的丙烯酰胺进行乙酸乙酯液液萃取,比较不同萃取次数对丙烯酰胺检测值的影响,结果如图5所示。
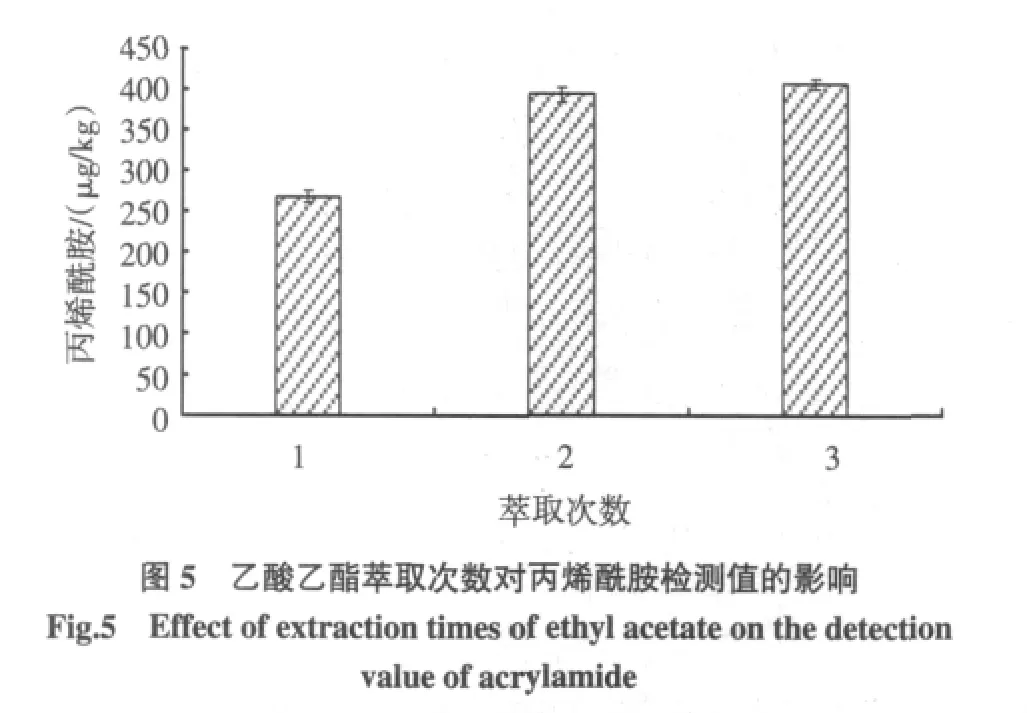
丙烯酰胺的检测值随萃取次数的增加而升高,与1次萃取比较,采用3次萃取能够使检测值提高51.6%。这说明充分的萃取可以确保丙烯酰胺最大限度进入有机相中,从而保证检测结果的准确性,故将萃取次数确定为3次。
2.6 正交试验
按照(1.2.2.2)方法步骤,选取提取时间、料液比和萃取次数为影响因素,各取3个水平设计L9(34)正交试验,每组实验重复3次(加标水平250μg/kg),以回收率为指标对丙烯酰胺的提取条件进行优化。结果如表1所示。由表1的极差分析可知,以丙烯酰胺的回收率为指标时,各因素对其提取效果的影响程度依次为C>A>B。即乙酸乙酯萃取次数>提取温度>料液比,最佳组合C3A2B2,即萃取次数3次,提取温度50℃,料液比1∶15,正好是正交表中实验5,即实验具有良好可行性,不需做验证实验。
2.7 方法精密度与加标回收率
目前国内外有关食品中丙烯酰胺提取的过程,通常是在室温条件下,以1∶10料液比进行单级提取[13-14],而本研究在提取过程中结合加热和二级提取步骤,为了比较两种提取效果的差异,结合正交试验的结果,在实验中加分别选取室温(25℃)、料液比1∶10(g/mL)单级提取、3次萃取操作和提取温度50℃、料液比1∶15(g/mL)二级提取,3次萃取操作进行预处理。各加标水平(25、250、500μg/kg)进行 3 次平行测定,以加标回收率表示方法的准确度,RSD表示方法的重复性和精密度,结果见表2。
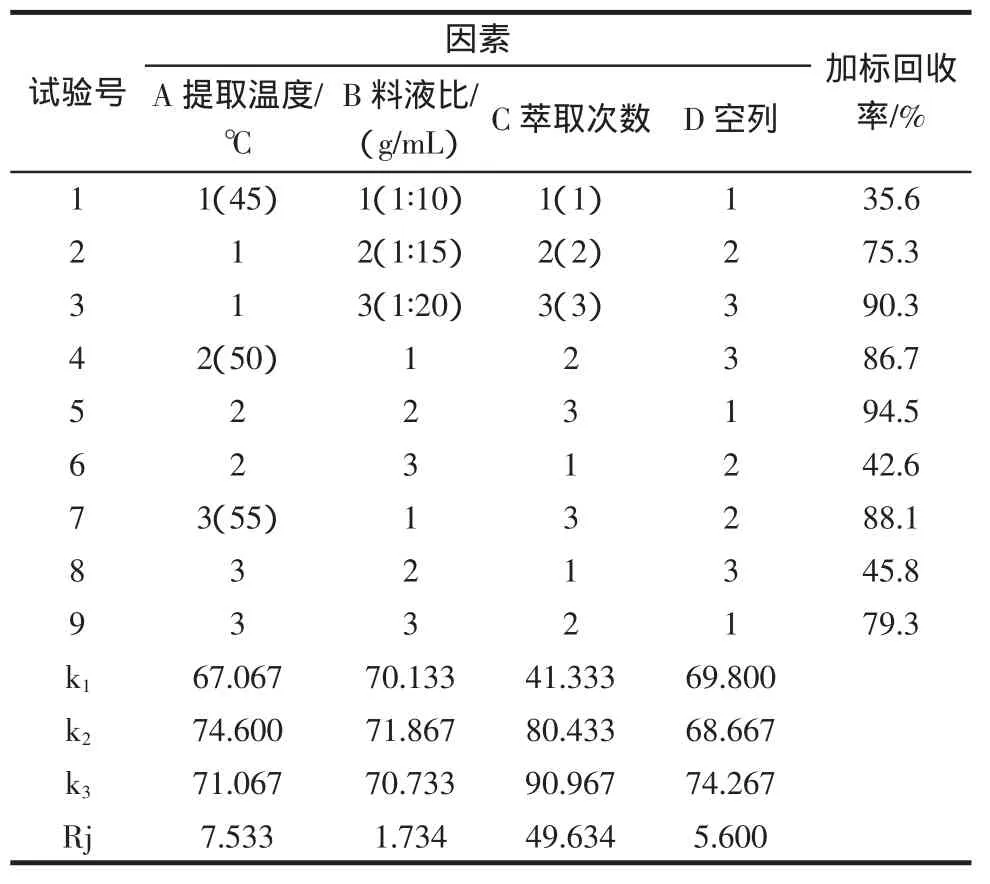
表1 正交试验结果Table 1 The results of orthogonal experiment
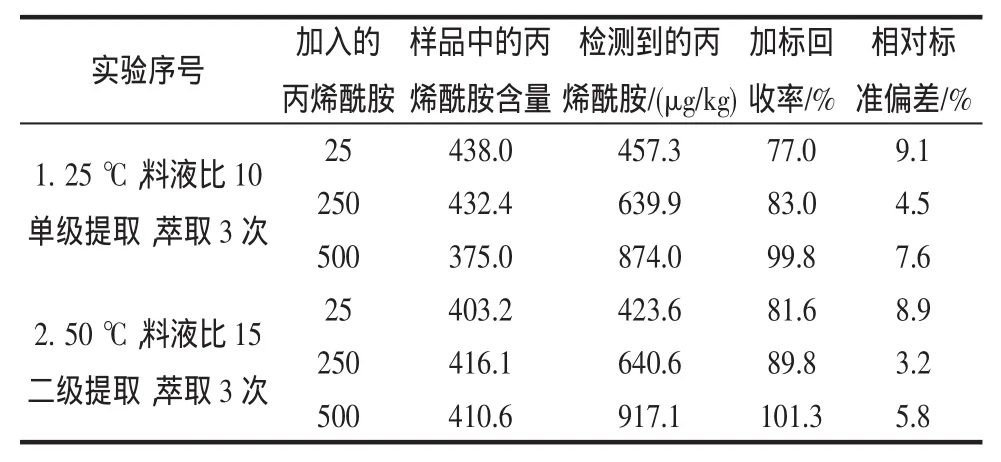
表2 两种预处理方法加标回收率结果比较(n=3)Table 2 The comparison of recovery of assay for acrylamide by two pretreated methods(n=3)
3 结论
本研究建立了一种曲奇饼干中丙烯酰胺的HPLC-VWD检测方法。通过优化前处理条件,使方法的平均加标回收率从86.6%提高到90.9%。该方法可以对样品中的丙烯酰胺进行快速准确的定量分析,每个样品的走样时间约为 5 min,在 0.2μg/mL~1.0μg/mL范围内具有良好的线性关系和重复性,同时减少了对昂贵的质谱检测设备的依赖,使用的实验设备价格相对低廉,容易被大多数实验室所采纳,有助于在食品检测行业的推广应用。不过,由于食品基质之间存在很大的差异性,以后的研究重点仍将集中在复杂基质的预处理过程。
参考文献:
[1]Bette Hileman.Acrylamide found in cooked foods[J].Chemical&engineering news,2002,80(19):33
[2]Ahn J S,Castle l,CLarke D B,et al.Verification of the findings of acrylamide in heated foods[J].Food Addit Contam,2002,19(12):1116-1124
[3]Food Standards Agency,UK.Press Briefing of the 17.5.2002.FSA study of acrylamide in food:background information and research findings[EB/OL].[2002-07-15]http://www.food.gov.uk/multimedia/pdfs/acrylamideback.pdf
[4]中华人民共和国卫生部.中华人民共和国卫生部公告2005年第4号[EB/OL].[2005-04-13]http://www.Moh.gov.cn/newshtmL/9632.Htm.
[5]Vural G觟kmen,Edoardo Capuano,Arda Serpen,et al.Effects of dough formula and baking conditions on acrylamide and hydroxymethylfurfural formation in cookie[J].Food chemistry,2007,104(3):1136-1142
[6]Vural G觟kmen,Palazoglu,Arda Serpen,et al.A new approach to evaluate the risk arising from acrylamide formation in cookie during baking:Total risk calculation[J].Journal of food engineering,2010,100(4):642-648
[7]鲁莉,于维森,林洪.食品中丙烯酰胺分析方法的研究进展[J].预防医学论坛,2007,13(5):449-451
[8]葛宇,赵旭丽,巢强国.超高效液相色谱-串联质谱法测定高温热加工食品中的丙烯酰胺[J].食品工业科技,2008,34(7):132-135
[9]V.G觟kmen,Francisco J.Morales,Arda Serpen,et al.Multiple-stage extraction strategy for the determination of acrylamide in foods[J].Journal of food composition and analysis,2009,22(2):142-147
[10]蒋立勤,张晓玲,胡均力,等.玉米芯粉制作曲奇饼干的工艺研究[J].现代食品科技,2008,24(2):150-152
[11]Yu Zhang,Jingjing Jiao,Zengxuan Cai,et al.An improved method validation for rapid determination of acrylamide in foods by ultra-performance liquid chromatography combined with tandem mass spectrometry[J].Journal of chromatography A,2007,1142(2):194-198
[12]张志清,白琦,陈黎.RP-HPLC快速测定马铃薯片中微量丙烯酰胺含量[J].药物分析杂志,2008,28(5):766-768
[13]林奇龄,欧仕益,欧云付.活性炭固相萃取-高效液相色谱联用分析食品中的丙烯酰胺[J].食品工业科技,2005,26(6):172-173
[14]US Food and Drug Administration.Detection and quantitation of acrylamide in foods[EB/OL].[2002-07-23]http://www.fda.gov/Food/FoodSafety/Food Contaminants Adulteration/Chemical Conta minants/Acrylamide/UCM053537
