脂多糖与干扰素α联用诱导白血病U937细胞凋亡及其机制*
2012-11-28邱元秀王晓桃莫东华
邱元秀 王晓桃 莫东华
Toll样受体(Toll-like receptor,TLRs)是存在于哺乳动物细胞表面的一种跨膜蛋白受体,表达于各种肿瘤细胞,在多种血液系统肿瘤细胞中也有表达[1]。内毒素脂多糖(lipopolysaccharide,LPS)是Toll样受体的主要外源性配体,LPS须与其受体结合后才能通过信号转导级联反应产生效应。Lehner等[2]研究表明TLRs的主要外源性配体LPS和干扰素(IFN)-α共同作用于急性单核细胞白血病细胞株THP-1时,有协同促进细胞凋亡的作用,并检测到半胱氨酸天冬氨酸蛋白酶(caspase)-8的活性及Fas/CD95的表达明显增高。本研究探讨LPS与IFN-α联用对白血病U937细胞的增殖抑制和诱导凋亡作用及其对caspase-8的调节作用,为寻找和开发TLR激动剂或TLR配体临床免疫治疗白血病提供理论依据。
1 材料与方法
1.1 主要试剂及仪器 RPMI-1640干粉、Trizol试剂(美国Gibco公司)、胎牛血清(杭州四季青)、噻唑蓝(MTT,美国Sigma公司)、DMSO(杭州双林)、逆转录(RT)试剂盒及聚合酶链反应(PCR)试剂盒(大连宝生物工程有限公司)、各引物序列均由上海博亚公司设计和合成,Fluor ChemTM8900凝胶成像系统分析仪器(美国Alpha Innotech公司)。
1.2 细胞培养 人AML细胞系U937由中山大学医学院惠赠传代引进后,常规离心弃上清液,复苏后的细胞在RPMI1640培养液(含10%的胎牛血清,青霉素、链霉素各1×105U/L),置37℃、含5%的CO2培养箱中培养,每3 d更换1次培养液。本实验用的细胞均处于对数生长期,根据处理细胞药物的不同将实验组分为单用2 000 U/mL IFN-α(IFN-α组)、200 μg/L LPS(LPS组)及 2 000 U/mL IFN-α+200 μg/L LPS处理(联合组);对照组不加任何药物处理细胞。
1.3 细胞生长抑制率的测定 采用MTT还原法进行检测。取对数生长期的U937细胞,调节细胞浓度至5×105/L,将细胞加入96孔平底培养板中,实验组每组各重复5个平行孔,对照组加入等体积的培养液,每孔加入上述细胞悬液100 μL。置于37℃、含5%的CO2的培养箱中,培养24、48 h后从培养箱中取出,每孔加入MTT(5 g/L)10 μL,再继续培养4~6 h后取出,2 000 r/min离心10 min后吸去上清液,每孔再加入DMSO 100 μL,充分将培养板震荡均匀5 min左右使结晶溶解,选择490 nm波长用酶标仪测各孔吸光度(A)值。计算细胞生长抑制率:细胞生长抑制率=[对照组A值-实验组A值]/对照组A值×100%。
1.4 细胞凋亡率的测定 收集各组药物处理后培养24、48 h细胞,以PBS缓冲液清洗2次后再将细胞沉淀充分混匀,用70%的冷乙醇4℃固定24 h以上。离心去除乙醇固定液,用PBS清洗1次后,加入200 mg/L去DNA酶的RNA酶,然后用流式细胞仪分析不同DNA含量的细胞分布。应用ModifitL TL 1.00(MAC)分析系统进行数据处理,低于G1期的细胞(亚G1期)为凋亡细胞,其占细胞总数的比例为凋亡细胞比例。
1.5 RT-PCR检测caspase-8 mRNA的表达 根据流式结果选择凋亡率明显的48 h进行RT-PCR检测。收集各组U937细胞,按Trizol法提取各组细胞总RNA,使用分光光度仪检测RNA的浓度与质量,要求A260nm/A280nm在2.0左右进行纯化和鉴定。取总RNA约2 μg随机引物法逆转录合成cDNA,反应体积为20 μL,取上述逆转录产物2 μL cDNA按试剂盒说明书提示的步骤进行扩增。引物的设计与合成是利用Oligo软件由上海博亚公司完成。caspase-8引物序列:上游5′-CT GCTGGGGATGGCCACTGTG-3′;下游5′-TCGCCTCGAGGAC ATCGCTCTC-3′,扩增片段366 bp。β-actin引物序列:上游5′-CGCTGCGCTGGTCGTCGACT-3′; 下 游5′-GTCACGCACG ATTTCCCGCT-3′,扩增片段150 bp。反应条件:95℃预变性2 min,95 ℃变性15 s,60 ℃15 s,72 ℃15 s,caspase-8、β-actin分别为40、35个循环,最后72℃延伸5 min。反应完毕,取10 μL PCR扩增产物在2%琼脂糖凝胶上电泳分离,电泳完毕后在Fluor ChemTM8900凝胶成像系统分析仪器下进行观察并分析。试验重复3次。目的基因mRNA表达量=每例标本目的基因的平均灰度值/同一标本β-actin的平均灰度值。
1.6 统计学分析 采用SPSS 17.0软件进行分析,计量数据以均数±标准差(±s)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞生长抑制率比较 各实验组与对照组之间比较差异均有统计学意义(均P<0.01),且联合组较IFN-α组、LPS组细胞生长抑制率变化明显(均P<0.01),见表1。
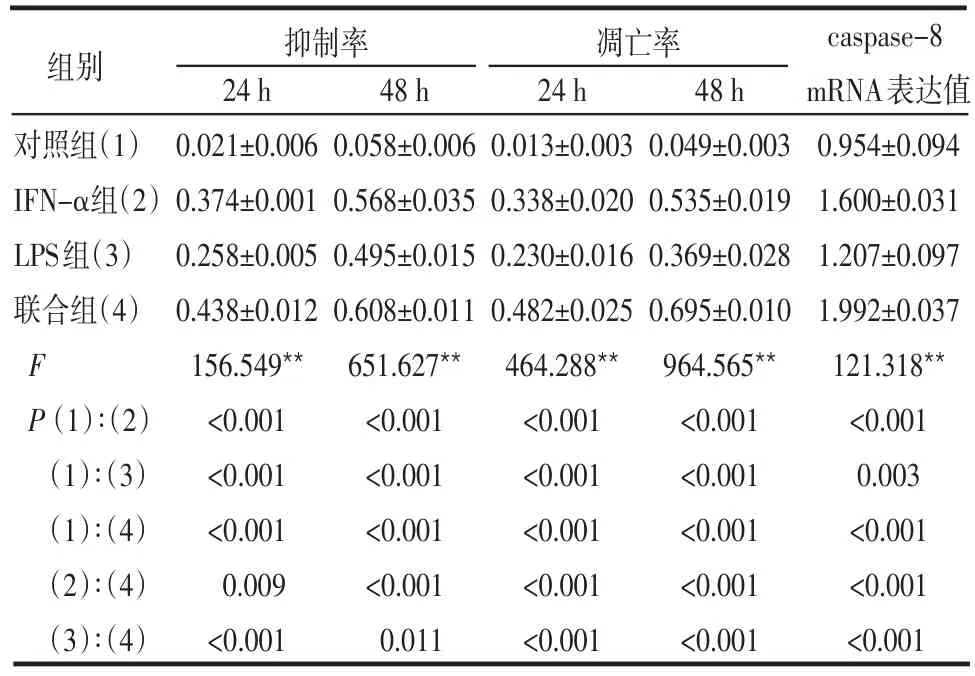
Table 1 Effects of different drugs on inhibitory rate,apoptotic rate and expression of caspase-8 mRNA of U937 cells表1 不同药物作用U937细胞的抑制率、凋亡率和caspase-8 mRNA表达
2.2 各组细胞凋亡率比较 各实验组细胞凋亡率与对照组比较差异均有统计学意义(均P<0.01),且联合组较IFN-α组、LPS组细胞凋亡率变化明显(均P<0.01),见表1。
2.3 各组细胞caspase-8 mRNA表达水平比较 RTPCR产物电泳结果显示药物处理U937细胞后caspase-8 mRNA的表达明显增多,且IFN-α+LPS组较IFN-α组、LPS组caspase-8 mRNA表达值变化明显(均P<0.01),见图1、表1。
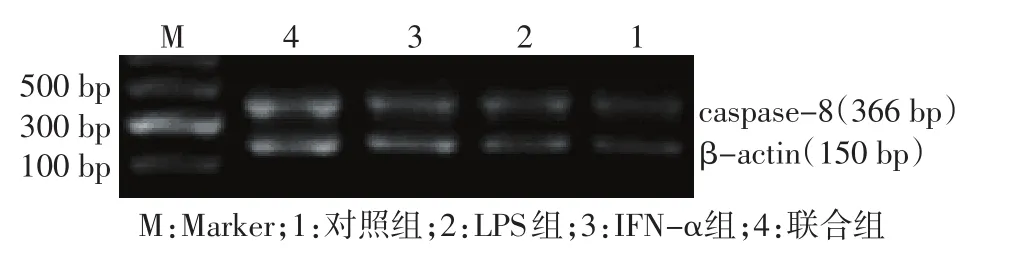
Figure 1 The expression of caspase-8 mRNA detected by RT-PCR图1 RT-PCR检测caspase-8 mRNA的表达水平
3 讨论
随着免疫研究的进展,免疫治疗在血液肿瘤治疗中的作用受到重视。最近白血病的免疫治疗方案中已包含TLRs激动剂,利用TLRs在肿瘤细胞表达差异的特性作为靶点的免疫治疗已逐渐引起关注[3]。TLRs在绝大多数血液系统恶性肿瘤中均有不同程度的表达,可表达于B系淋巴瘤细胞、B系慢性淋巴细胞白血病细胞和骨髓瘤细胞,并且发挥一定生物学效应。不同的TLRs通过识别相应不同的病原相关分子模式,在防御外来微生物入侵的先天性免疫过程中发挥关键的作用,并被视为联系固有免疫与获得性免疫的桥梁。
Huang等[4]研究发现在肿瘤细胞上用TLR配体LPS激活TLR4信号途径可促进多种肿瘤细胞的凋亡。Hammadi等[5]研究发现当TLR7激动剂作用于B系慢性淋巴细胞白血病细胞后,导致细胞凋亡及生长抑制增强。干扰素具有广泛的抗肿瘤活性,目前已被广泛应用于各种肿瘤的辅助治疗,并且在与其他药物联合使用治疗白血病方面也有一定的进展。刘加军等[6-7]的研究结果表明IFN-α能抑制单核细胞白血病U937细胞的生长并诱导细胞凋亡,且与阿糖胞苷联合应用对白血病K562细胞具有明显的生长抑制及诱导凋亡作用。本研究结果显示IFN-α、脂多糖联用作用于U937细胞24、48 h后,细胞生长抑制率和凋亡率较对照组升高,且两者联用较单用IFN-α、脂多糖细胞生长抑制率和凋亡率变化更明显。Caspase家族是介导细胞凋亡的关键蛋白酶家族,caspase-8是诱导细胞凋亡信号途径中的重要启动因子,主要参与由死亡受体(Fas、DR4和DR5等)介导的外源性细胞凋亡途径,在死亡受体Fas介导的信号通路中,Fas与其配体偶联后招募Fas相关死亡结构域蛋白并激活T细胞内凋亡启动酶caspase-8分子,活化的caspase-8可通过一系列的级联反应激活下游的凋亡效应蛋白酶分子而促使细胞凋亡[8-9]。Lehner等[2]研究报道IFN-α、LPS联用能明显增强白血病细胞的凋亡,其机制可能是LPS处理白血病细胞后启动TLRs发生级联反应,促发机体的免疫反应,从而增强抗白血病效应;也可能是两者联用作用于细胞后激活细胞内外多条信号通路,导致caspase-8等活化进一步加强,促进细胞外凋亡途径加强,从而进一步增强细胞凋亡[10]。在本研究中,药物作用U937细胞48 h后,caspase-8 mRNA的表达较对照组升高,且两者联用较单用IFN-α、脂多糖变化明显,这与上述文献报道一致。
综上,LPS与IFN-α联用对白血病细胞具有明显的生长抑制及诱导凋亡作用,其凋亡机制可能与caspase-8的激活有关,这可能是其抑制白血病细胞生长及诱导细胞凋亡的重要机制之一。
[1]Webb RN,Cruse JM,Lewis RE.Differential cytokine and Toll-like receptor expression in leukemia[J].Exp Mol Pathol,2007,83(3):464-470.
[2]Lehner M,Bailo M,Stachel D,et al.Caspase-8 dependent apoptosis induction in malignant myeloid cells by TLR stimulation in the presence of IFN-alpha[J].Leuk Res,2007,31(12):1729-1735.
[3]Wolska A,Lech-Maranda E,Robak T.Toll-like receptors and their role in hematologic malignancies[J].Curr Mol Med 2009,9(3):324-335.
[4]Huang B,Zhao J,Li H,et al.Toll-like receptors on tumor cells facilitate evasion of immune surveillance[J].Cancer Res,2005,65(12):5009-5014.
[5]Hammadi A,Billard C,Faussat AM,et al.Stimulation of iNOS expression and apoptosis resistance in B-cell chronic lymphocytic leukemia(B-CLL)cells through engagement of Toll-like receptor 7(TLR-7)and NF-kappaB activation[J].Nitric Oxide,2008,19(2):138-145.
[6]刘加军,陆惠玲,吕德坚,等.干扰素对U937细胞的诱导凋亡及其作用机制探讨[J].中国实用医学杂志,2005,5(23):15-18.
[7]刘加军,伍新尧,潘祥林,等.α干扰素联合阿糖胞苷对白血病K562细胞的诱导凋亡作用及其机制[J].中国肿瘤生物治疗杂志,2003,10(3):198-201.
[8]Lakhani S,Flavell RA.Caspases and T lymphocytes:a flip of the coin[J]?Immunol Rev,2003,193(1):22-30.
[9]Matsushita K,Wu Y,Qiu J,et al.Fas receptor and neuronal cell death after spinal cord ischemia[J].J Neurosci,2000,20(18):6879-6887.
[10]Lion E,Smits EL,Berneman ZN,et al.Acute myeloid leukemic cell lines loaded with synthetic dsRNA trigger IFN-gamma secretion by human NK cells[J].Leuk Res,2009,33(4):539-546.
