牛奶过敏原PCR检测方法的建立
2012-11-15许庆金邓志瑞张文举
许庆金,邓志瑞,张文举,陈 沁
(上海大学生命科学学院,上海200444)
牛奶过敏原PCR检测方法的建立
许庆金,邓志瑞,张文举,陈 沁*
(上海大学生命科学学院,上海200444)
牛奶是主要的食品过敏原之一,其中β-乳球蛋白是引起牛奶过敏的主要成分。基于牛奶β-乳球蛋白基因序列设计一对PCR引物,经过反应条件的优化,建立了适合检测牛奶β-乳球蛋白过敏原的PCR方法。实验结果表明,当PCR反应体系中模板DNA量为25ng,引物浓度为4mmol/L时,检测效果最佳。所建立的方法不仅可用于不同保质期、不同来源牛奶β-乳球蛋白过敏原的测定,亦可用于牛、羊奶不同比例混合物中β-乳球蛋白过敏原的检测。
β-乳球蛋白,PCR,牛奶过敏原
食物过敏(food allergy)是食物刺激有机体产生的变态反应[1],微小的剂量即可在几分钟之内引起皮肤以及肠道等的疾病,严重者甚至导致休克死亡。发达国家每年有超过20%的人受过敏性疾病的困扰。联合国粮食及农业组织(FAO,995)报告的八类主要的过敏原食物是牛奶、鸡蛋、鱼、甲壳类(虾、蟹)、大豆、花生、核果类(杏、板栗、腰果)以及小麦。牛奶是其中最常见的过敏原之一,在小于3岁的婴幼儿中发病率为1.6%~2.8%[2]。而β-乳球蛋白是牛奶致敏的主要成分[3]。牛奶过敏已引起社会的关注,日本、澳洲和西方国家要求含有牛奶成分的食品必须标明牛奶过敏标示[4-5]。目前,牛奶过敏原的检测方法主要有基于蛋白质检测的SDS-PAGE、HPLC和HPLC-MS等[6-7]。这些方法本可直接检测到过敏原蛋白,但在食品加工过程中,蛋白质空间构象易被破坏,从而影响检测准确性,目前已有研究证实变性后的部分蛋白可与抗体结合引起假阳性[8-9];此外,上述方法存在检测周期较长、不稳定因素多、工作量大等缺点[10]。PCR技术在食品检测中的成功应用在一定程度上可解决上述问题。鉴于此,本文针对牛奶中引起过敏的β-乳球蛋白对应的基因序列设计引物,拟建立检测牛奶过敏原的PCR方法。
1 材料与方法
1.1 实验材料
牛奶和羊奶 好又多超市;dNTPs、Taq酶和10 ×PCP buffer(Mg2+plus) 天根生物科技(北京)有限责任公司;引物 由上海生工生物工程有限公司合成;TEN溶液 1mL Tris-HCl溶液(1mol/L,pH 7.4)+0.2mL EDTA溶液(0.5mol/L)+0.5844g NaCl固体,定容至100mL;其他试剂 按常规方法配制。
1.2 实验方法
1.2.1 DNA的提取 牛奶DNA的提取参照徐仙等[11]、田雨[12]及Sharma D等[13]的方法,稍作修改。
a.取35mL牛奶(羊奶)置于50mL洁净的离心管中,4℃,3000r/min离心10min,弃上清液,在超净台中用脱脂棉球小心拭去管壁上的脂类物质;b.加10mL PBS溶液,溶解沉淀,4℃,3000r/min离心10min,弃上清液,再次在超净台中用脱脂棉球小心去脂;c.4℃,10000r/min离心1min,去上清液;d.加440μL TEN溶液和60μL NaOH溶液,转入无菌的 Eppendorf管(1.5mL)中,置于95℃条件下8min,冷却5min,4℃,10000r/min离心 5s,转移上清至新的无菌的Eppendorf管(1.5mL)中;e.加等体积SEVGA(氯仿∶异戊醇 =24∶1),混合混匀,4℃,12000r/min离心10min,取上清液;f.加等体积(-20℃)预冷的异丙醇,-20℃放置40min,13000r/min离心15min,弃上清液;g.加300μL 70%乙醇,12000r/min离心5min,去上清液;h.加50μL双蒸水,测DNA浓度和纯度,分装,低温(-20℃)保存。
1.2.2 PCR引物设计 针对牛β-乳球蛋白基因设计引物 FCM/RCM,序列见表 1,目的条带大小为1.8kb。
1.2.3 PCR反应体系和条件 PCR扩增反应总体系20μL,包含2μL PCR buffer(Mg2+plus),3.2μL dNTP (2.5mmol/L),2μL DNA模板,1μL引物(each 3μmol/L),0.4μL Taq酶(2.5U/mL),10.4μL双蒸水;同时设置空白对照,即在20μL PCR体系中使用等量双蒸水代替DNA。
PCR反应条件为:94℃预变性4min,94℃变性30s,68℃退火1min,72℃延伸2min,35个循环,72℃再延伸10min,4℃保存。扩增产物经1%琼脂糖凝胶电泳后,在凝胶成像系统中观察结果。

表1 PCR引物序列Table 1 Sequence of PCR primer
2 结果与分析
2.1 DNA浓度对PCR结果的影响
分别选取不同量的DNA(5、10、15、20、25、50ng)为模板,以FCM/RCM为引物进行PCR扩增,电泳结果见图1。由图1可知,当DNA含量低于15ng时无目的条带出现,15ng时开始出现目的条带但较弱,加大DNA用量时,目的条带愈加清晰。当DNA用量为50ng时,模板中的杂质含量也同时上升,此时PCR扩增也易受杂质干扰出现杂带,因而选用25ng为后续实验的DNA用量。
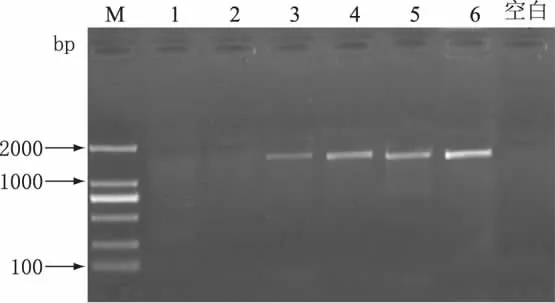
图1 DNA浓度对PCR扩增的影响Fig.1 Effect of DNA concentrations on PCR amplification
2.2 引物浓度对PCR扩增的影响
DNA用量为25ng时,设定引物FCM/RCM的不同浓度(1、2、3、4、5、10、20mmol/L)进行PCR扩增,电泳结果如图2所示。由图2可知,引物浓度为1mmol/L时,无目的条带扩增;增大至2mmol/L和3mmol/L时,目的条带清晰度较低;当引物浓度为4mmol/L时,目的条带较清晰;大于4mmol/L时,开始有微弱的非特异性杂带出现,且随着引物浓度的增大,非特异性趋于明显,综上所述,选择4mmol/L作为最终的引物浓度。

图2 引物浓度对PCR扩增的影响Fig.2 Effect of primer concentrations on PCR amplification
2.3 保质期对PCR扩增的影响
取不同保质期的品牌A牛奶(7、21、45、180d)提取DNA,进行PCR扩增,电泳结果见图3。由图3可知,保质期7d的A品牌鲜牛奶目的条带最强,保质期21d的目的条带强度次之,保质期45d的纯牛奶条带最弱,保质期180d的A品牌纯牛奶没有PCR扩增。

图3 保质期对PCR扩增的影响Fig.3 Effect of shelf lives on PCR amplification
2.4 不同品牌牛奶的PCR扩增结果
在优化PCR体系后,分别取四种不同品牌的鲜牛奶(A、B、C、D)提取DNA,进行PCR扩增电泳,结果如图4所示。由图4可见,四种品牌的牛奶均出现了目的条带,且条带的差异不大,说明不同品牌的鲜牛奶中均含有此种过敏原。
2.5 牛奶过敏原PCR检测方法的特异性
为考察所建立的PCR检测方法的特异性,以A品牌纯牛奶DNA模板为阳性对照,分别取不同品牌的羊奶(顶羊,御宝,阳春)提取DNA,进行PCR扩增,实验结果如图5所示。由图5可知,A品牌纯牛奶(21d)出现了清晰的目的条带,而不同来源的羊奶未出现相应目的条带,表明引物FCM/RCM具有较好的特异性。
2.6 A品牌纯牛奶和顶羊纯羊奶混合物的PCR检测
将A品牌纯牛奶(21d)和顶羊羊奶(30d)按不同比例(牛奶∶羊奶=0.5∶1,1∶1,2∶1,3∶1,4∶1,5∶1,10∶1)混合,上述混合物提取DNA,PCR扩增结果如图6所示。由图6可见,目的条带随着牛奶比例的提升从无到有,从弱到强;在牛奶∶羊奶=3∶1(V/V)时开始出现微弱的目的条带;4∶1、5∶1和10∶1时,目的条带较为清晰。
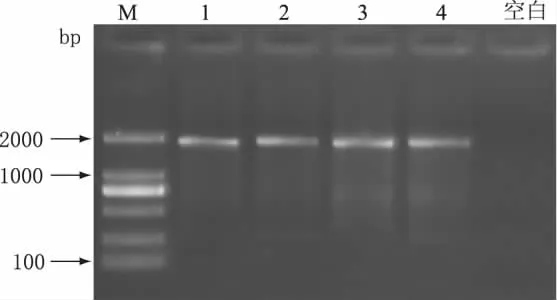
图4 不同品牌牛奶PCR扩增结果Fig.4 PCR results of different brands milk
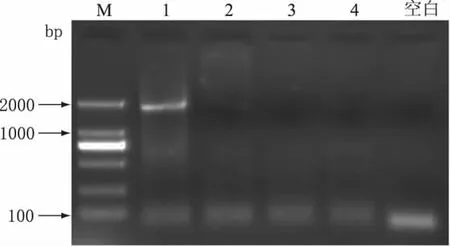
图5 A品牌纯牛奶和不同品牌羊奶PCR结果Fig.5 PCR results of brand A pure milk and different brands goat milk
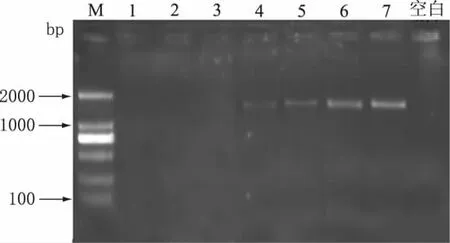
图6 A品牌纯牛奶和顶羊纯羊奶混合物PCR结果Fig.6 PCR results of mixture of brand A pure milk and Dingyang pure goat milk
为进一步确认PCR检测方法的临界点,在牛奶∶羊奶=3∶1(V/V,下同)附近设置了更多的混合比例(牛奶∶羊奶=1.5∶1,2∶1,2.2∶1,2.4∶1,2.6∶1,2.8∶1,3∶1),PCR扩增结果如图7所示。由图7可知,在牛奶∶羊奶=2.6∶1(V/V)时,目的条带开始出现但较弱;小于2.6∶1的比例混合时,没有目的条带出现,可以初步认定在本实验条件下,牛奶∶羊奶=2.6∶1 (V/V)为检测的临界值。
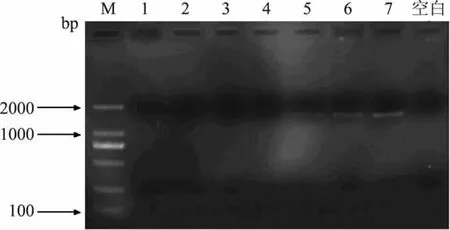
图7 不同比例混合的牛奶和羊奶PCR结果Fig.7 PCR results of mixture with different ratios of milk and goat milk
3 讨论
DNA和引物的用量是影响PCR扩增的重要因素,只有在适宜的浓度范围内才能得到理想的扩增条带[14-15]。过低的DNA模板量和引物用量使得扩增效率低下甚至扩增不出对应的目的条带;DNA过量时引物会过早耗尽,使得扩增产物与模板DNA之间发生退火或者扩增产物之间发生退火,导致出现弥散状背景[15];过高的引物用量倾向于形成非特异性产物,同时形成大量引物二聚体。所以本实验考察了模板量和引物用量对PCR扩增的影响,结果证实随着DNA量的增加,目的条带呈现增强的趋势;在15ng以下几乎检测不到牛奶过敏原的存在;DNA用量为25ng时可以得到较为清晰、分辨率较高的条带;在设定的7个引物浓度梯度中,最佳引物用量为4mmol/L。
实际商品检测中,不同处理(加热、酸碱等)方式及保存方式对DNA提取和PCR检验结果也会有一定影响[14,16-17]。Gawienowski M C等[16]研究表明,经浸泡、湿磨等加工过程能使玉米基因和质粒DNA降解,135℃加热2h后,DNA几乎完全降解;Kharazmi M等[17]认为,浸泡后又经过物理破碎处理而做成的豆奶、豆腐和热加工做成的玉米糊和马铃薯,没有检测出大于1.1kb的DNA片段。本实验提取不同保质期的牛奶DNA,同等模板量进行PCR扩增,结果表明不同保质期的牛奶PCR结果有一定差异。
PCR方法的特异性主要体现在特异引物与靶基因的专一、有效的结合上,而与其他相似的序列无法进行结合[18]。在牛奶和不同品牌羊奶的对照实验中,结果显示引物FCM/RCM不会与羊奶基因组DNA发生特异性结合,无目的条带产生,这说明本方法特异性较好。因此,本方法可用于牛奶过敏原的特异性检测。
与牛奶相比,羊奶中的β-乳球蛋白的含量比牛奶低,且氨基酸排列顺序与牛奶不同,较牛奶更易消化,因此羊奶可以解除大部分牛奶过敏症[19];但是羊奶产量较低,因此有不法商家将牛奶掺杂进羊奶销售,此种混合物难以用肉眼进行区分,所以本文按不同比例将牛奶混合进羊奶之中,使用本文建立的PCR方法检测羊奶之中的牛奶含量。结果表明,当牛奶∶羊奶比例为2.6∶1(V/V)时,能检测出来羊奶之中的牛奶成分,更多这方面的应用正在进一步的实验中。
[1]Johansson S G,Bieber T,Dahl R,et al.Revised nomenclature for allergy for global use:report of the Nomenclature Review Commol/Littee of the World Allergy Organization,October 2003[C].J Allergy Clin Immol/Lunol,2004,113:832-836.
[2]Besler M,Eigenmann P,Schwartz R H.Allergen data collection-Update:Cow’s Milk[C].Internet Symposium on Food Allergens,2002(4):19-106.
[3]Natale M C,Bisson G,Monti A,et al.Cow’s milk allergens identification by two-dimensional immol/Lunoblotting and mass spectrometry[J].Mol Nutr Food Res,2004,48:363-369.
[4]Swiss Food Law:Art.8 Abs.1 der Verordnung u¨ber die Kennzeichnung und Anpreisung von Lebensmitteln[S].2005,23 (11).
[5]Directive 2003/89 EC of the European Parliament and Council and its Annex IIIa[S].
[6]Wal J M,Bernard H,Yvon M,et al.Enzyme immol/Lunoassay of specific human IgE to purified cow’s milk allergens[J].Food Agric Immol/Lunol,1995(7):175-187.
[7]Wal J M.Cow’s milk proteins/allergens.Ann Allergy Asthma Immol/Lunol[J].2002,89:3-10.
[8]Kleber N,Maier S,Hinrichs J.Antigenic response of bovine β-lactoglobulin influenced by ultra-high pressure treatment and temperature[J].Innovative Food Science and Emerging Technologies,2007(8):39-45.
[9]Bugyi Z,Nagy J,k Törö K,et al.Towards development of incurred materials for quality assurance purposes in the analysis of food allergens[J].Analytica Chimica Acta,2010,672:25-29.
[10]Van Hengel A G.Food allergen detection method sand the challenge to protect food-allergic consumers[J].Analytical and Bioanalytical Chemistry,2007,389:111-118.
[11]徐仙,陈沁,雍克岚,等.PCR方法在区分牛奶牧场来源中的应用[J].食品科技,2008,33(12):258-261.
[12]田雨.从牛奶中分离DNA方法的建立[J].乳业科学与技术,2006,118(3):112-113.
[13]PirondiniA,BonasU,MaestriE,etal.Yieldand amplificability ofdifferentDNA extraction procedures for traceability in the dairy food chain[J].Food Control,2010,21: 663-668.
[14]王渭霞,赖凤香,洪利英,等.转基因水稻DNA样品浓度以及存放条件对PCR定性检测的影响[J].农业生物技术学报,2010,18(5):846-852.
[15]李苗,高丽美,李永锋,等.增强UV-B辐射对小麦幼苗基因组DNA的影响及RAPD分析体系的建立[J].生物技术通报,2010(5):87-92.
[16]Gawienowski M C,Eckhoff S R,Ping Y,et al.Fate of maize DNA during steeping wet milling and processing[J].Cereal Chem,1999,76(3):371-374.
[17]Kharazmi M,Bauer T,Hammol/Les W P,et al.Effect of food processing on the fate of DNA with regard to degradation and transformation capability in Bacillus subtilis[J].Syst Appl Microbiol,2003,26(4):495-501.
[18]Carl W Dieffenbach,Gabriela S Dveksler.PCR Primer:A laboratorymanual[M].Cold Spring Harbor Laboratory Press,1995.
[19]邵国峰,兰毅楠,曲晟,等.羊奶与牛奶比较有何优缺点[J].农家之友,2009,272(13):75.
PCR method for the detection of allergen in milk
XU Qing-jin,DENG Zhi-rui,ZHANG Wen-ju,CHEN Qin*
(School of Life Sciences,Shanghai University,Shanghai 200444,China)
Milk is considered to be a kind of important allergen,and β-lactoglobulin is one major component of allergens in milk.A pair of primers was designed based on the gene sequence of β-lactoglobulin in milk and PCR reaction system was optimized for detecting β-lactoglobulin allergen.The results showed that best results could be obtained by combining 25ng template DNA with 4mmol/L primers used for PCR analysis.The established method can not only be successfully applied in detecting β-lactoglobulin allergen in milk from different shelf lives,and resources,but also in detecting the allergen in the mixture at different ratios of cow milk and goat milk.
β-lactoglobulin;PCR;milk allergen
TS207.3
A
1002-0306(2012)06-0104-04
2011-05-18 *通讯联系人
许庆金(1984-),男,在读研究生,研究方向:食品安全检测。
