垂枝藓Rhytidium rugosum及塔藓Hylocomiumsplendens对CO2浓度升高的响应
2012-11-14赵红燕胡忠健茹雅璐吴玉环
赵红燕,胡忠健,茹雅璐,吴玉环,2
(1. 杭州师范大学生命与环境科学学院, 浙江 杭州 310036; 2. 中国科学院沈阳应用生态研究所, 辽宁 沈阳110016)
垂枝藓Rhytidium rugosum及塔藓Hylocomiumsplendens对CO2浓度升高的响应
赵红燕1,胡忠健1,茹雅璐1,吴玉环1,2
(1. 杭州师范大学生命与环境科学学院, 浙江 杭州 310036; 2. 中国科学院沈阳应用生态研究所, 辽宁 沈阳110016)
利用开顶式培养室,通入含不同浓度CO2的空气,研究在CO2浓度升高的条件下垂枝藓(Rhytidiumrugosum)及塔藓(Hylocomiumsplendens)的生长情况.结果表明:500 μmol·mol-1CO2时垂枝藓株高表现为下降趋势,而塔藓表现为升高趋势;在700 μmol·mol-1CO2时塔藓的生物量上升,而垂枝藓的生物量下降,两者的生物量与株高之比都有所增加.因此,在高CO2浓度环境中,塔藓的适应性更强;高浓度CO2促进植物侧向生长,但对叶绿素的含量影响不大.
CO2浓度升高;生物量;叶绿素;藓类
0 引 言
工业革命以来,由于化石燃料的使用日益增加,大气中CO2的浓度也日趋增高,从工业革命前的280 μmol·mol-1增加到目前的350 μmol·mol-1,预计到本世纪末将达到700 μmol·mol-1.CO2浓度升高不仅会因其温室效应引起全球气温升高1.5~4.5 ℃从而导致全球气候发生变化,并且会对全球生物圈产生很大影响.
研究表明,CO2浓度增加会使C3植物的光合作用提高、生物量增加、生理代谢途径及次生代谢产物发生改变.国外有关CO2浓度变化对苔藓植物的研究报道主要集中于泥炭沼泽[1-5],如Heijden等发现在CO2倍增时泥炭藓的碳水化合物含量明显增加,且植物体干质量增加10%~25%[6].CO2浓度升高可以补偿光合作用中的低光,使光补偿点下降,在生长季节延缓休眠, 并使苔藓的净CO2交换明显增加,且具明显种间特异性[7].Jauhiainen等报道了泥炭藓植物在CO2浓度升高及与养分或水分双因子下的光合作用、植物体干质量以及用水效率等的变化情况[8-11].本文就CO2浓度升高对长白山自然保护区两种常见藓类植物垂枝藓(Rhytidiumrugosum)及塔藓(Hylocomiumsplendens)的生长及生理特性进行初步的探讨,以进一步认识藓类植物对高浓度CO2的生物学反应,为揭示大气CO2浓度变化对植物生理特性的影响提供参考.
1 材料与方法
1.1 供试材料
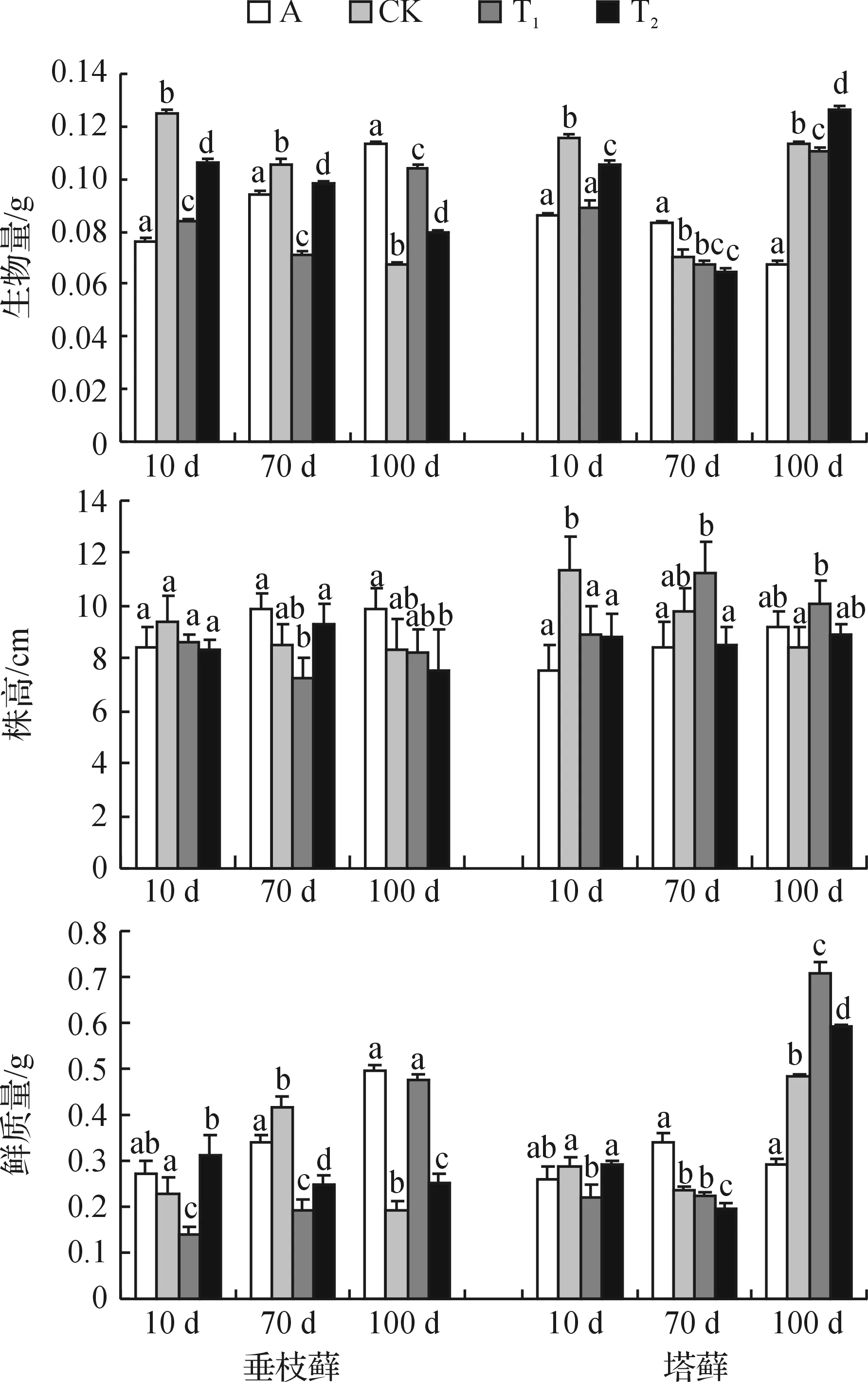
注:不同小写字母表示差异具统计学意义(P<0.05).图1 不同CO2浓度条件下垂枝藓和塔藓的生物量、株高及鲜质量的变化Fig. 1 Changes of plant biomass, height and fresh weight for R. rugosum and H. splendens with air of different CO2 concentration
本试验在中国科学院长白山森林生态系统开放研究站(简称长白山站,E128°28′、N42°24′,海拔736 m)进行.试材为垂枝藓和塔藓,均采自长白山北坡.其中,垂枝藓采自长白山站5号标准地岳桦林林下,塔藓采自长白山站3号标准地亚高山云冷杉林林下.
采集的两种藓类植物经适应培养7 d后,选取长势基本一致的植株进行试验处理. 本研究采用开顶式培养室(open-top chamber),在开顶箱底部四周固定内径2 cm的塑料管(均匀扎以小孔),箱外的气体由小孔注入培养箱.塑料管与箱外气袋相连接,气袋是工业CO2与空气的混合气体,通过调节二者的气流量获得所需的CO2浓度,并定期核对调节. 开顶箱共设3个组:正常大气,含350 μmol·mol-1CO2(CK);500 μmol·mol-1CO2(T1);700 μmol·mol-1CO2(T2).另设无开顶箱的裸地培养对照(A).
1.2 测量方法
1.2.1 生长指示的测定
开顶箱CO2浓度升高处理10, 70, 100 d后,分别测量植株高(PH)、植株群体鲜质量(FW)(以50株植株为单位计算) .将植株90 ℃烘干至恒重后称其总干质量(DW)(以50株植株为单位计算)即植物总生物量. 每个处理重复3次.
1.2.2 叶绿素的测定
取植株同一部位的配子体加入液氮研磨,再加入80%的丙酮抽提叶绿素,用紫外分光光度计测量其在663和645 nm处的光密度值,根据Lichtenthaler[11]公式计算叶绿素a和叶绿素b的含量. 每个处理重复3次.
2 结果与分析
2.1大气CO2浓度升高对垂枝藓、塔藓生长的影响
图1所示为不同CO2浓度条件下垂枝藓、塔藓的株高、鲜质量及生物量的变化情况.
从图1可以看出两种藓类植物的生物量在不同CO2浓度条件下表现不同:垂枝藓的生物量在500 μmol·mol-1CO2时升高22.8%,700 μmol·mol-1时下降25.0%,在正常CO2浓度下则下降了2.2%;塔藓的生物量随着CO2浓度升高而升高,500 μmol·mol-1CO2时升高24.4%, 700 μmol·mol-1时升高18.0%,在正常CO2浓度时生物量下降47.3%.从生物量角度来看,塔藓表现出较强的适应性.
在CO2浓度升高的环境中两种藓类植物植株的生长情况略有不同.从图1可以看出:在正常的CO2浓度下两种藓类植物株高呈下降趋势.500 μmol·mol-1和700 μmol·mol-1CO2时,垂枝藓总体表现为下降趋势.而塔藓在500 μmol·mol-1CO2时株高总体表现为上升趋势,上升幅度为9.7%;700 μmol·mol-1CO2时株高没有明显变化.进一步分析表明,垂枝藓和塔藓在CO2浓度升高时生物量与株高之比均增加,高于正常CO2浓度条件下的生物量和株高之比,这说明高浓度CO2对藓类植物侧向生长的促进作用大于垂直生长,即高浓度CO2下植物较粗壮.
植株鲜质量的变化与生物量的变化不同.在500 μmol·mol-1CO2时,塔藓的鲜质量增加最多,为2.45倍,垂枝藓增加2.30倍;700 μmol·mol-1时,塔藓的鲜质量增加1.01倍,垂枝藓降低了20.0%;而植物总生物量上升相对较少,特别是塔藓在700 μmol·mol-1CO2时鲜质量减少但并没影响生物量的积累.鲜质量与生物量之比在各种实验条件下都表现为上升,只有垂枝藓在700 μmol·mol-1CO2培养90 d时降低了29.2%.这说明随着CO2浓度的升高,植株体内含水量有较大幅度的增加,但CO2达到一定浓度时,不同藓类对水的吸收能力又表现出不同.
2.2大气CO2浓度升高对垂枝藓、塔藓光合作用色素含量的影响
利用最小显著性差异(LSD)法完成同一藓种在3种不同CO2浓度下叶绿素含量的差异显著性检验,结果列于表1.表中数据可以看出不同CO2浓度下植物体叶绿素a和叶绿素b含量没有明显的改变,这说明CO2浓度的升高对垂枝藓及塔藓叶绿素a和叶绿素b的含量影响不大.此外,叶绿素a/b比值在不同的CO2浓度下也没有显著的不同,说明CO2对叶绿素a和叶绿素b含量的影响基本一致.由此可见,CO2浓度的升高对垂枝藓及塔藓叶绿素的含量影响不大,植物体叶绿素含量并没有明显的改变.
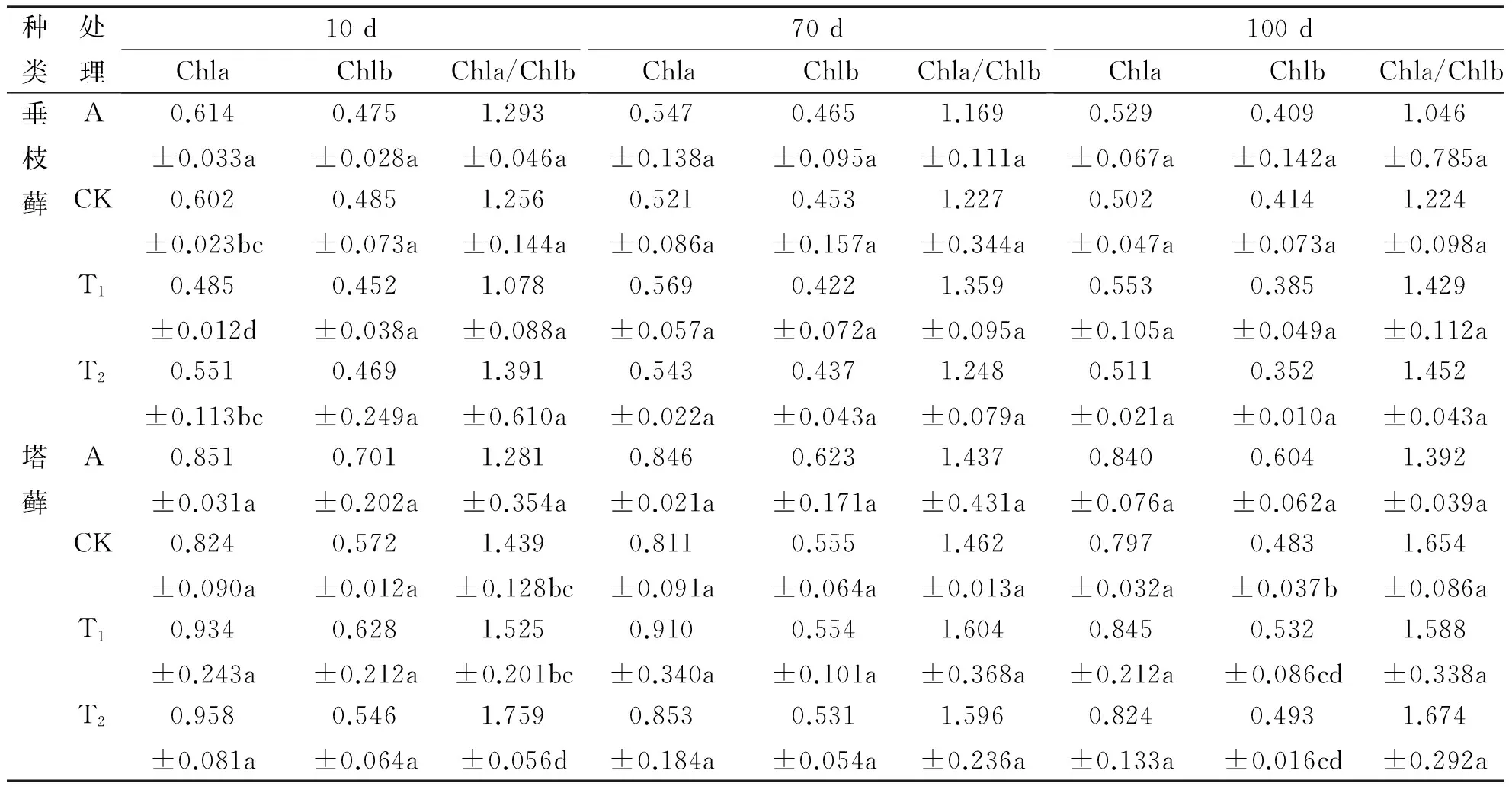
表1 CO2浓度升高对两种藓类植物叶绿素含量的影响Tab. 1 Effects of enhanced CO2 concentration on chlorophyll contents of two mosses /(mg·g-1FW)
注:同种同列数据后不同字母表示差异具统计学意义(P< 0.05).
3 结 语
CO2是植物光合作用的底物,CO2浓度的升高必然影响植物的光合作用.C3和C4植物光合作用的机制不同,其对CO2浓度升高的反应也不同. Poorter认为C3植物的生物量平均提高41%,C4植物22%,CAM植物15%[12].作为C3植物的苔藓,其光合作用必然受到CO2浓度升高的影响,但由于苔藓常匍匐紧贴于地面生长,形成密层,其基质枯枝落叶层在腐烂过程中不断产生CO2,因此苔藓长期暴露于高于大气的CO2浓度中,有可能对CO2浓度升高的敏感程度较低[9,13-16].CO2浓度的升高可在两方面影响C3植物的光合作用,一是增加了CO2对Rubisco酶结合位点的竞争从而提高羧化速度,二是通过抑制光呼吸提高净光合速率.研究长期处于高浓度CO2环境中的垂枝藓及塔藓的生物量发现,塔藓的生物量比在正常CO2浓度环境中植株体积累的生物量有所增加,特别是在500 μmol·mol-1CO2时增加得比较明显.这说明在现有CO2浓度下叶绿体基质中CO2浓度较低,没有达到CO2饱和点,在高浓度CO2环境中藓类植物光合速率随着CO2浓度的升高而直线升高,CO2的同化作用增强,植物生物量增加.垂枝藓在700 μmol·mol-1CO2时生物量下降25.0%,可能是“光合适应”现象.植物进行光合作用的能量来源于光合色素捕获的能量,叶绿素含量的高低直接关系着植物的光合功能.短期内增高CO2浓度会提高叶绿素的含量,但长期处于CO2浓度增高环境中的植物叶绿素含量并没有表现出优势.本研究表明两种藓类植物叶绿素含量没有明显的改变,也说明了长期处于高浓度CO2的环境中,植物体的叶绿素含量并不会增加,此结果有过类似报道[17].
大气中CO2浓度的高低影响着植物的形态.近年来的实验结果表明,苔藓植物的生长与CO2浓度升高之间没有明显的对应关系.如不同CO2浓度下Sphagnumbalticum的植株密度、植物体干质量和单株茎质量及长度相互间并不存在相关关系[8],CO2浓度升高后其植株变长,且生物量增加[9-11].CO2倍增时疣泥炭藓(Sphagnumpapillosum)干质量增加10%~25%,S.balticum没有反应[6],而塔藓在600 μmol·mol-1CO2时其茎长度和株重几乎减少75%.本研究也发现垂枝藓和塔藓在不同浓度CO2环境中的株高变化不同.在两种CO2浓度下塔藓的株高都呈上升趋势,而垂枝藓与之相反.两种藓类植物的生物量与株高的比例都有所增加,表明其更加表现为侧向生长.苔藓植物需要水分来进行光合作用,苔藓植物的变水特征决定了其含水量随着环境条件变化而变化.有关苔藓植物水分含量与光合作用关系的研究表明,植物体内含水量在一定范围时,很多苔藓植物的净光合速率随组织含水量的增加而提高[9].在研究中发现,500 μmol·mol-1CO2时两种藓类的鲜质量增加十分明显,但总的生物量相对增加缓慢,这有可能是吸收水分过多,过剩的水分含量会增加植物体对CO2吸收的阻力,因而引起光合速率的下降.
植物通过各种途径适应CO2浓度升高,如次生代谢加强、形态解剖特征改变等.本试验研究不同CO2浓度下垂枝藓、塔藓生长情况的变化,无论在株高、鲜质量、生物量及株高与生物量之比等方面,塔藓都优于垂枝藓,说明在高CO2浓度时塔藓生长情况优于垂枝藓.原因可能是塔藓多生长于潮湿落叶松林,常在阴冷潮湿的落叶林下形成被层;或生长在酸性较高的沼泽内.这些地方CO2浓度较高,因此塔藓有一定抗高CO2浓度的能力.而垂枝藓多生于白桦林、落叶松林,其生长环境中的CO2浓度并不很高,因此其抗高CO2的能力不强.由于两种藓类植物生长环境的不同,致使其对CO2浓度升高的响应程度不同.
[1] Berendse F, Breemen N, Rydin H,etal. Raised atmospheric CO2levels and increased N deposition cause shifts in plant species composition and production inSphagnumbogs[J]. Global Change Biology,2001,7(5):591-598.
[2] Heijmans M M P D, Klees H, Berendse F. Competition betweenSphagnummagellanicumandEriophorumangustifoliumas affected by raised CO2and increased N deposition[J]. Oikos,2002,97(3):415-425.
[3] Hoosbeek M R, Breeman N, Berendse F,etal. Limited effect of increased atmospheric CO2concentration on ombrotrophic bog vegetation[J]. New Phytologist,2001,150(2):459-463.
[4] Miglietta F, Hoosbeek M R, Foot J,etal. Spatial and temporal performance of the miniFACE (free air CO2enrichment) system on bog ecosystems in Northern and Central Europe[J]. Environmental Monitoring and Assessment,2001,66(2):107-127.
[5] Mitchell E A D, Buttler A, Grosvernier P,etal. Contrasted effects of increased N and CO2supply on two keystone species in peatland restoration and implications for global change[J]. Journal of Ecology,2002,90(3):529-533.
[6]Heijen E, Jauhiainen J, Silcola J,etal. Effects of elevated atmospheric CO2concentration and increased nitrogen deposition on growth and chemical composition of ombrotrophicSphagnumbalticumand oligomesotrophicSphagnumpapillasum[J]. Journal of Bryology,2000,22(3):175-182.
[7] Tuba Z, Slack N G, Stark L R. Bryophyte ecology and climate change[M]. New York: Cambridge University Press,2011:1-506.
[8] Jauhiainen J, Silvola J. Photosynthesis ofSphagnumfuscumat long-term raised CO2concentration[J]. Annales Botanica Fennici,1999,36(1):11-19.
[9] Jauhiainen J, Silvola J, Tolonen K,etal. Response ofSphagnumfuscumto water levels and CO2concentration[J]. Journal of Bryology,1997,18(2):183-195.
[10] Jauhiainen J, Silvola J, Vasander H. The effects of increased nitrogen deposition and CO2onSphagnumangustifoliumandS.warnstorfii[J]. Annales Botanica Fennici,1998,35(4):247-256.
[11] Jauhiainen J, Vasander H, Silvola J. Response ofSphagnumfuscumto N deposition and increased CO2[J]. Journal of Bryology,1994,18(3):183-195.
[12] Poorter H. Interspecific variation in the growth response of plants to an elevated ambient CO2concentration[J]. Plant Ecology,1993(104/105):77-75.
[13] Silvola J. CO2dependence of photosynthesis in certain forest and peat mosses and simulated photosynthesis at various actual and hypothetical CO2concentration[J]. Lindbergia,1985,11(2/3):86-93.
[14] Sonesson M, Gehrke C, Tjus M. CO2environment, microclimate and photosynthetic characteristics of the mossHylocomiumsplendensin a subarctic habitat[J]. Oecologia,1992,92(1):23-29.
[15] Tarnawski M, Melick D, Roser D,etal.Insitucarbon dioxide levels in cushion and turf forms ofGrimmiaantarcticiat Casey Station, East Antarctica[J]. Journal of Bryology,1992,17(2):241-249.
[16] 吴玉环,高谦,程国栋,等.苔藓植物对全球变化的响应及其生物指示意义[J].应用生态学报,2002,13(7):895-900.
[17] Csintalan Z, Tuba Z, Lichtenthaler H K, etal. Reconstitution of photosynthesis upon rehydration in the desiccated leaves of the poikiochlorophyllous monocot shrubXerophytascabridaat elevated CO2[J]. Journal of Plant Physiology,1996,148:345-350.
EffectsofElevatedCO2ConcentrationonRhytidiumrugosumandHylocomiumsplendens
ZHAO Hong-yan1, HU Zhong-jian1, RU Ya-lu1, WU Yu-huan1,2
(1. College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China;2. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China)
The growth characteristics ofRhytidiumrugosumandHylocomiumsplendensin open-top chambers in Changbai Mountain were studied. Two kinds of mosses were planted with different CO2concentrations respectively. The plant height ofR.rugosumdegraded but that ofH.splendensincreased in the treatment of 500 μmol·mol-1CO2. With 700 μmol·mol-1CO2concentration, the biomass ofR.rugosumdegraded while that ofH.splendensincreased, and both of the ratios of biomass and plant height increased. The results indicate thatH.splendensis much adapted to elevated CO2concentration thanR.rugosum, and elevated CO2concentration stimulates moss’s lateral growth much than vertical growth, but with unobvious changes in chlorophyll contents.
elevated CO2concentration; biomass; chlorophyll contents; mosses
2012-09-17
国家自然科学基金项目(30970188);杭州师范大学科研启动项目(YS05203130);杭州师范大学本科生创新能力提升工程项目.
吴玉环(1972—), 女, 教授,博士,主要从事植物系统分类与生态学研究.E-mail:yuhuanwu@yahoo.com.cn
10.3969/j.issn.1674-232X.2012.06.003
Q945.11
A
1674-232X(2012)06-0490-05
