CO2-H2O体系中硝基苯选择还原制备苯基羟胺
2012-11-09刘世娟蒋景阳
刘世娟,蒋景阳
(1. 吉林师范大学 化学学院,吉林 四平 136000;2. 大连理工大学 化工与环境生命学部 精细化工国家重点实验室,辽宁 大连 116012)
CO2-H2O体系中硝基苯选择还原制备苯基羟胺
刘世娟1,蒋景阳2
(1. 吉林师范大学 化学学院,吉林 四平 136000;2. 大连理工大学 化工与环境生命学部 精细化工国家重点实验室,辽宁 大连 116012)
在环境友好的常压、CO2-H2O体系中,硝基苯(NB)选择还原制得了苯基羟胺(PHA),考察了搅拌转速、锌粉粒径、水重复使用次数对该还原反应的影响,且比较了CO2-H2O体系和氯化铵水溶液体系中此还原反应的情况,得到了适宜的反应条件。实验结果表明,在NB用量 10 mmol、锌粉用量30 mmol、锌粉粒径1~10 μm、水用量20 mL、反应温度25 ℃、搅拌转速1 500 r/min、反应时间1.0 h的条件下,PHA选择性达到92%。此反应过程中水重复使用20次后,PHA收率基本不变。CO2-H2O体系中,加快搅拌转速和降低锌粉粒径都有利于此还原反应的进行,PHA收率也较高。与氯化铵水溶液体系相比,在CO2-H2O体系中,不仅此还原反应易于控制、PHA收率高,且该体系可重复使用,反应后无含氯废水排放。
二氧化碳-水体系;硝基苯;苯基羟胺;锌粉
苯基羟胺(PHA)是一种合成药物和精细化学品的重要中间体[1-3],通常由硝基苯(NB)选择还原制得,采用的方法有催化氢化法[4-7]、催化氢转移还原法[8-9]、金属还原法[10-11]、电解还原法[12-13]等。其中,锌粉在氯化铵水溶液中选择还原NB制备PHA是实验室常用的方法,但该方法需以氯化铵为反应促进剂,反应结束后产生大量含氯废水。
鉴于此,文献[14-15]曾提出以CO2-H2O体系为反应促进剂代替氯化铵水溶液。CO2与水形成的碳酸是原位酸,碳酸电离出H+促进NB进行选择还原反应;反应结束,释放CO2,碳酸基本消失,反应体系自中和。反应后的CO2和水可回收重复使用,无含氯废水生成,减少了环境污染。
本工作考察了在室温、常压的CO2-H2O体系中,搅拌转速、锌粉粒径和水重复使用次数对NB选择还原制备PHA的影响,并将此反应体系与氯化铵水溶液反应体系进行了比较。
1 实验部分
1.1 主要试剂
NB:分析纯,天津科密欧股份有限公司;锌粉:分析纯,沈阳新兴试剂厂,大颗粒锌粉在使用前用粒径大于40 μm的不同分子筛筛选,特细的(1~10 μm)锌粉用JSM-5600LV型扫描电子显微镜(JEOL公司)测定其粒径大小。
1.2 实验方法
向50 mL三口烧瓶中加入10 mmol NB、30 mmol锌粉和20 mL去离子水,将三口烧瓶放入25℃水浴中,接上CO2进气管和出气管。CO2进气管插入液面下,出气管接上鼓泡器,在室温、常压下通入CO2进行反应。反应结束后,反应液经减压过滤除去锌粉,用乙酸乙酯萃取反应混合物中的有机物。有机相经无水硫酸钠干燥后用Agilent公司1100型高效液相色谱仪分析各物质的含量,并用标准试样确证。
1.3 产品分析
NB选择还原后反应液的HPLC谱图见图1。由图1可见,保留时间为4.949 min的物质为PHA,保留时间为5.794 min的物质为苯胺,保留时间为11.063 min的物质为NB,保留时间为12.247 min的物质为亚硝基苯,保留时间为24.611 min的物质为氧化偶氮苯。通过实验发现,亚硝基苯和氧化偶氮苯的生成量很少且不随反应条件的变化而变化,因此,后续实验中,不做深入研究。
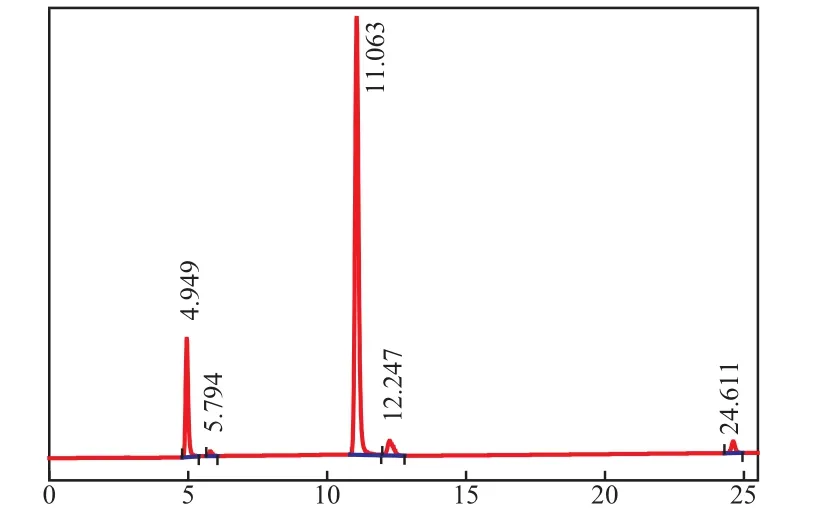
图1 NB选择还原后反应液的HPLC谱图Fig.1 HPLC chromatogram for the selective reduction of nitrobenzene(NB).
2 结果与讨论
2.1 搅拌转速对还原反应的影响
搅拌转速对还原反应的影响见表1。由表1可见,在CO2-H2O体系中,在无搅拌的情况下,NB转化率仅为5%;加快搅拌转速,反应速率明显加快。这是因为在CO2-H2O体系中,NB选择还原制备PHA的反应是由水相、有机相、固体和气体组成的多相反应。此还原反应涉及以下5个步骤:(1)反应物从溶液中传递到锌表面;(2)反应物吸附在零价锌(Zn0)表面;(3)还原反应在锌界面发生;(4)产品从金属锌表面脱附;(5)产品传递到溶液中。加快搅拌转速可加快上述5步中的传质步骤(即第(1),(4),(5)步骤)的进行,从而提高反应速率和PHA选择性。

表1 搅拌转速对还原反应的影响Table1 Effect of stir speed(R) on the reduction
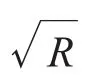

图2 搅拌转速平方根与还原反应速率常数的关系Fig.2 Relationship between the square roots of the stir speed() and the rate constants(k) of the reduction.
2.2 锌粉粒径对还原反应的影响
锌粉选择还原NB制备PHA的反应是在Zn0界面进行的,锌粉可用的表面积决定了反应速率,因此考察了锌粉粒径对还原反应的影响,实验结果见表2。由表2可见,锌粉粒径的大小对NB选择还原制备PHA的影响很大,锌粉粒径越小越有利于还原反应的快速进行。
在相同的反应条件下,当锌粉粒径小于10 μm时,NB的转化率为90%,PHA的选择性达92%。当锌粉粒径增大时,NB的转化率则明显降低;即使延长反应时间,NB的转化率仍很低。
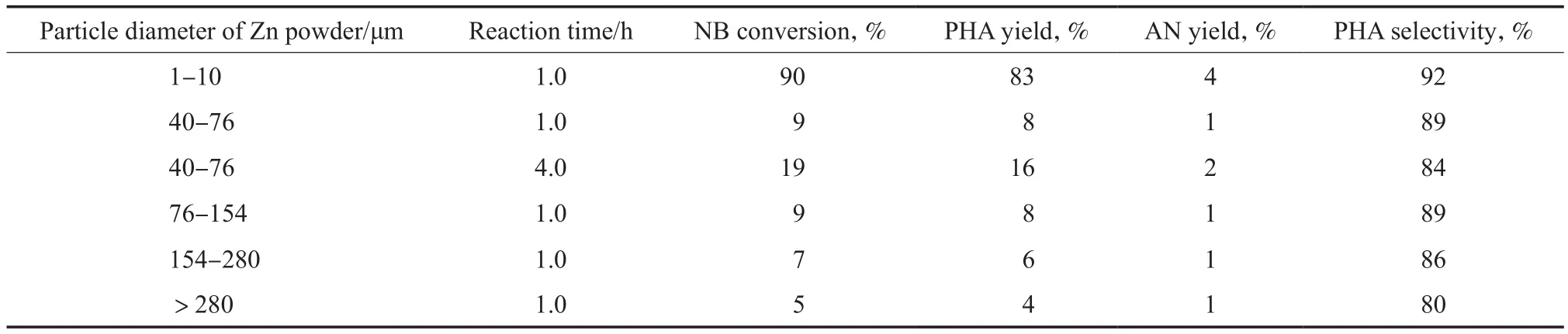
表2 锌粉粒径对还原反应的影响Table 2 Effect of the particle diameter of Zn powder on the reduction
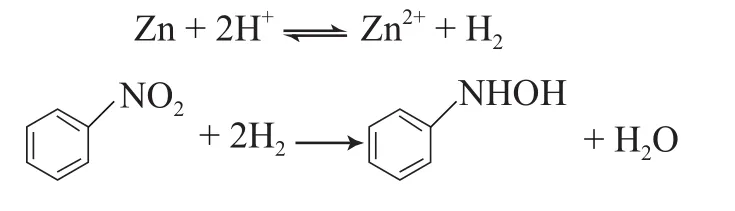
出现以上情况的可能原因是,在CO2-H2O体系中,锌粉选择还原NB制备PHA的反应是一个多相反应,反应发生在Zn0表面,锌粉粒径越小,其总表面积越大,增加了锌粉与溶液的接触面积,即增加了锌粉的还原能力,加快了活泼氢的产生速率,从而有利于NB选择还原反应的进行。实验过程中还发现,锌粉颗粒较大时,即使延长反应时间,NB转化率仍很低。这可能是因为此还原反应机理是一个电化学机理:首先溶液中的H+在Zn0表面形成活泼氢,Zn0被氧化成锌化合物(ZnO和ZnCO3),然后活泼氢与NB反应,NB被还原生成PHA。有利于活泼氢生成的条件都有利于此还原反应的进行。锌粉粒径小时,有利于活泼氢的生成,因此反应速率快;锌粉粒径大时,由于生成的锌化合物附着在Zn0表面,阻碍了Zn0与溶液的接触,使得只有表面层的部分Zn0参与反应,大部分Zn0不能参与反应,所以反应速率慢且NB的转化率低。在CO2-H2O体系中,此还原反应只能在Zn0表面一定范围内进行。NB选择还原制备PHA的反应机理如下。
2.3 水重复使用次数对还原反应的影响
在NB选择还原反应中水是过量的,水的重复使用对于减少废水的排放、降低环境污染具有重要意义。选择还原NB后,过滤悬浮物,水相经冰水浴冷却、过滤(得到固体PHA)后,直接用于下一次反应。水重复使用次数对还原反应的影响见图3。由图3可见,水重复使用20次后,PHA的收率基本不变。由此可见,在CO2-H2O体系中,NB选择还原制备PHA可以不使用有机溶剂,且水可重复使用,符合绿色化学的要求。
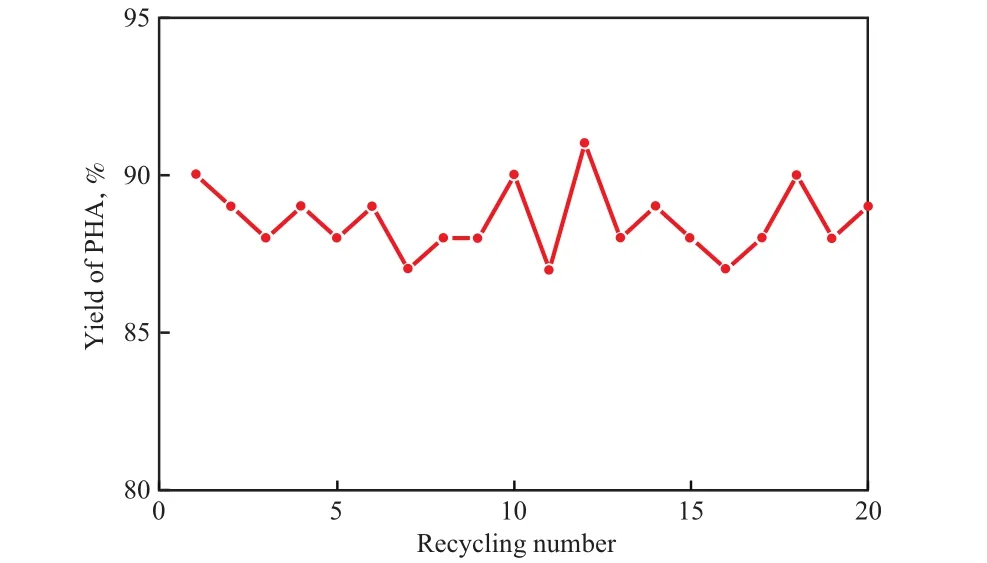
图3 水重复使用次数对还原反应的影响Fig.3 Effect of water reuse on the reduction.
2.4 CO2-H2O体系中与氯化铵水溶液中还原反应的比较
与传统氯化铵水溶液中NB选择还原制备PHA的反应[16]相比,在CO2-H2O体系中,PHA收率和选择性都有所提高,且CO2-H2O体系中锌粉是反应前一次性加入的,操作简单(在氯化铵水溶液中,锌粉被分批加入);但在CO2-H2O体系中反应时间长。这些情况可能与反应介质有关,因此对CO2-H2O体系和氯化铵水溶液中NB选择还原反应的情况进行了比较,实验结果见表3。为更好地比较两个体系中还原反应的情况,锌粉均在反应前一次性加入。由表3可见,在氯化铵水溶液中,NB选择还原反应速率较快,但PHA的选择性差。这可能是因为:(1) 氯能促进金属的腐蚀,增大了金属的表面积,进而加速此还原反应的进行;(2)此还原反应速率与溶液中的离子强度有关。由表3还可见,在CO2-H2O体系中加入中性盐,反应速率加快(见Entry 5和6),特别是在含Cl-的溶液中反应速率更快(见Entry 5),这表明氯化铵水溶液中的反应速率快与Cl-对金属的腐蚀和其溶液中的离子强度大有关。但在含Cl-的溶液中PHA的选择性差,这是因为在含Cl-的溶液中,反应速率快,生成的PHA来不及脱附Zn0表面就被进一步还原成苯胺所致。
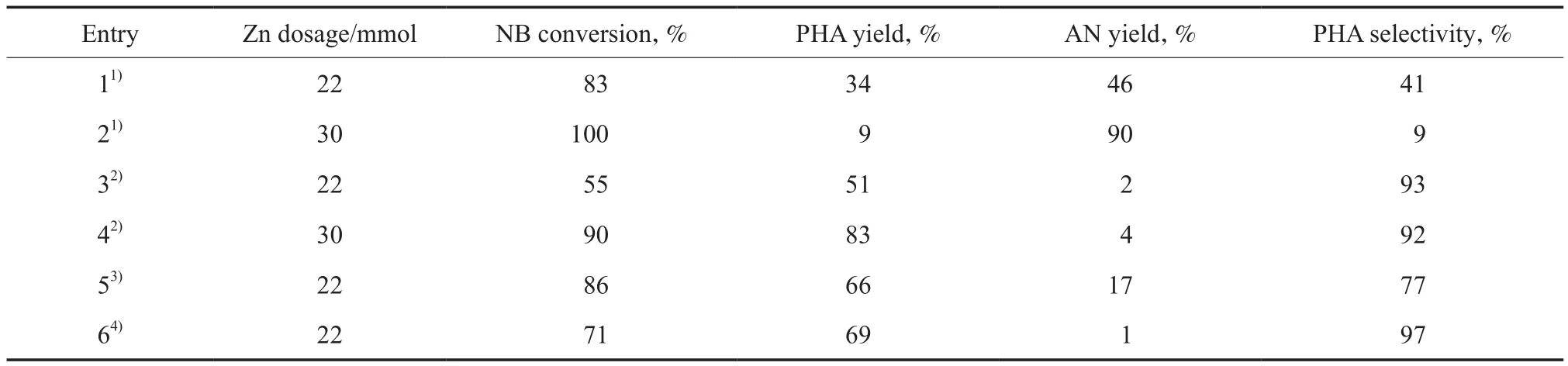
表3 不同反应条件下NB的选择还原反应Table 3 The selective reduction of NB under different reaction conditions
由此可见,在CO2-H2O体系中,NB选择还原反应速率较慢。但对于生产PHA,CO2-H2O体系中的还原反应更易于控制,且反应后无含氯溶液排放,减小了环境污染。
3 结论
(1) 在室温、常压、CO2-H2O体系中,加快搅拌速率和降低锌粉粒径都有利于NB选择还原制备PHA反应的快速进行,且可提高PHA的选择性。
(2) 在NB用量 10 mmol、锌粉用量30 mmol、锌粉粒径1~10 μm、水用量20 mL、反应温度25℃、搅拌转速1 500 r/min、反应时间1.0 h的条件下,NB选择还原制备PHA时,PHA选择性达到92%。反应过程中水重复使用20次后,PHA收率基本不变。
(3)与传统氯化铵水溶液中NB选择还原制备PHA反应相比,CO2-H2O体系中NB选择还原制备PHA的反应更易于控制,PHA收率和选择性都较高,且反应中无含氯废水排放,符合绿色化学的要求。
[1] 宋威,王旺银,张宇,等. NiB/C催化剂用于硝基苯加氢制备对氨基苯酚的研究[J]. 石油化工高等学校学报,2011,24(1):12 - 17.
[2] Spence J D,Raymond A E,Norton D E. Condensations ofN-Arylhydroxylamines for the Preparation of 5,5′-Di-tert-Butyl-2,2-Dihydroxyldiphenylamine[J].Tetrahedron Lett,2003,44:849 - 851.
[3] Knölker H,Reddy K R. Isolation and Synthesis of Biologically Active Carbazole Alkaloids[J].Chem Rev,2002,102(11):4303 - 4427.
[4] Takenaka Y,Kiyosu T,Choi J,et al. Selective Synthesis ofN-Arylhydroxylamines by the Hydrogenation of Nitroaromatics Using Supported Platinum Catalysts[J].Green Chem,2009,11(9):1385 - 1390.
[5] 那永良,李连斌,陈鹏,等. 硝基苯催化氢化生产对氨基苯酚[J]. 石油化工,2003,32(5):418 - 421.
[6] 郑纯智,张国华,刘丽荣. 硝基苯催化加氢合成对氨基苯酚[J]. 精细石油化工,2002(1):4 - 6.
[7] 杨斌,余正坤,徐筠,等. 双重负载双金属催化剂催化的硝基苯氢化还原[J]. 石油化工,1997,26(11):740 - 743.
[8] Entwistle I D,Gilkerson T,Johnstone R A W,et al. Rapid Catalytic Transfer Reduction of Aromatic Nitro Compounds to Hydroxylamines[J].Tetrahedron,1978,34(2):213 - 215.
[9] Rondestvedt C S,Johnson T A. Rapid Preparation of Chloroarylhydroxylamines by Hydrazine-Palladium Reduction of Chloronitroarenes[J].Synthesis,1977(12):850 - 851.
[10] 黎耀忠,程溥明,陈华,等. 硝基苯锌法合成对氨基苯酚的研究[J]. 石油化工,1998,27(8):557 - 560.
[11] 石奇勋. 芳硝基化合物温和条件下催化氢转移还原研究[D].大连:大连理工大学,2007.
[12] 张秋香,张新胜,史贤林,等. 硝基苯电解液和水循环制对氨基苯酚[J]. 石油化工,2000,29(9):680 - 682.
[13] Geske D H,Maki A H. Electrochemical Generation of Free Radicals and Their Study by Electron Spin Resonance Spectroscopy:The Nitrobenzene Aninon Radial[J].J Am Chem Soc,1960,82:2671 - 2676.
[14] Liu Shijuan,Wang Yanhua,Jiang Jingyang,et al. The Selective Neduction of Nitroarenes toN-Arylhydroxylamines Using Zn in a CO2-H2O System[J].Green Chem,2009,11(9):1397 - 1400.
[15] Liu Shijuan,Wang Yanhua,Hao Yuanping,et al. Promoting Effect of Ethanol on the Synthesis ofN-(2-Methylphenyl)Hydroxylamine fromo-Nitrotoluene in Zn-CO2-H2O System[J].Chin Chem Lett,2011,22(1):221 - 224.
[16] 樊能廷. 有机合成事典[M]. 北京:北京理工大学出版社,1995:729.
Selective Reduction of Nitrobenzene toN-Phenylhydroxylamine in a CO2-H2O System
Liu Shijuan1,Jiang Jingyang2
(1. College of Chemistry,Jilin Normal University;Siping Jinlin 136000,China;2. State Key Laboratory of Fine Chemicals,Faculty of Chemical Environmental and Biological Science and Technology,Dalian University of Technology,Dalian Liaoning 116012,China)
In an environmentally friendly CO2-H2O system with atmospheric pressure,N-phenylhydroxylamine(PHA) was prepared by the reduction of nitrobenzene(NB). The effects of stir speed,the particle diameter of Zn powder and the reuse of H2O on the reduction were studied. The reduction conditions in the CO2-H2O system were compared with those in NH4Cl aqueous solution system. The experimental results showed that the selectivity to PHA reached 92% under the reduction conditions of reaction temperature 25 ℃,reaction time 1.0 h,Zn powder with particle diameter of 1-10 μm 30 mmol,NB 10 mmol and stir speed 1 500 r/min. The yield of PHA was steady after H2O was reused for 20 times. In the CO2-H2O system,the increase of stir speed and the decrease of the particle diameter of Zn powder favor the reduction. Compared with the NH4Cl aqueous solution system,the CO2-H2O system can be reused with easy operation and high PHA yield,and without waste water containing chloride.
carbon dioxide-water system;nitrobenzene;N-phenylhydroxylamine;zinc powder
1000 - 8144(2012)11 - 1288 - 05
TQ 612
A
2012 - 04 - 01;[修改稿日期]2012 - 08 - 26。
刘世娟(1978—),女,辽宁省大连市人,博士,讲师,电话 0434 - 3292154,电邮liushijuan20032003@yahoo.com.cn。
教育部博士点基金项目(20070141046)。
(编辑 李明辉)
