BCL-6在经典型霍奇金淋巴瘤细胞株L428和过表达CD99的L428中的表达差异及其意义*
2012-11-06黄作平黄学平王志强周新华吴自勍朱梅刚
李 锋, 黄作平, 黄学平, 王志强, 钟 琳, 周新华, 吴自勍, 朱梅刚, 赵 彤△
(1南方医科大学附属南方医院病理科,广东 广州 510515;2武警广东省总队医院肿瘤科,广东 广州 510507)
1000-4718(2012)03-0409-06
2011-10-20
2012-01-05
国家自然科学基金资助项目(No.30770908;No.81071941)
△通讯作者 Tel:020-61648228;E-mail:zhaotongketizu@126.com
BCL-6在经典型霍奇金淋巴瘤细胞株L428和过表达CD99的L428中的表达差异及其意义*
李 锋1,2, 黄作平1, 黄学平1, 王志强1, 钟 琳1, 周新华1, 吴自勍1, 朱梅刚1, 赵 彤1△
(1南方医科大学附属南方医院病理科,广东 广州 510515;2武警广东省总队医院肿瘤科,广东 广州 510507)
目的探究BCL-6在经典型霍奇金淋巴瘤(classical Hodgkin’s lymphoma,cHL)细胞株L428和过表达CD99的L428(L428-CD99+)中的表达差异及其意义。方法应用免疫细胞化学和免疫荧光共聚焦检测BCL-6和CD99在cHL细胞株L428和L428-CD99+中的表达;运用实时荧光定量PCR和Western blotting检测细胞株L428和L428-CD99+中BCL-6和CD99的表达水平;MTT实验检测L428和L428-CD99+细胞增殖能力的差异;流式细胞术检测L428和L428-CD99+细胞的凋亡差异。结果免疫细胞化学和免疫荧光共聚焦显示CD99在L428细胞中为阴性表达,在L428-CD99+细胞中为阳性表达,并定位于细胞膜;BCL-6在L428细胞为阴性表达,在L428-CD99+细胞株中为阳性表达,并定位于细胞核。Western blotting显示CD99和BCL-6在L428细胞为阴性表达,在L428-CD99+细胞为阳性表达。实时荧光定量PCR结果显示,与L428细胞相比,CD99和BCL-6 mRNA在L428-CD99+细胞中的表达量增高(P<0.01)。MTT显示L428细胞增殖能力强于L428-CD99+细胞(P<0.01);流式细胞术显示L428-CD99+细胞凋亡较L428细胞增多(P<0.01)。结论过表达CD99诱发BCL-6表达增高,可导致L428细胞增殖能力下降及凋亡增加。
L428细胞株; CD99; BCL-6
原癌基因bcl-6位于3q27,编码706个氨基酸残基的锌指蛋白[1]。BCL-6蛋白为一核内转录因子,可作为序列特异性的转录抑制剂,参与非霍奇金淋巴瘤中弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)的发生发展[2]。CD99蛋白是一个分子量为32 000的跨膜糖蛋白,在大多数细胞表面表达。它作为一种细胞黏附分子,参与细胞黏附、凋亡过程,在肿瘤细胞的迁移、浸润、侵袭及肿瘤的发生发展过程中起重要作用[3]。文献和我们以往研究发现CD99表达缺失与经典型霍奇金淋巴瘤(classical Hodgkin’s lymphoma,cHL)的发生发展有关[4],为此我们构建了稳定表达CD99的cHL细胞株L428(L428-CD99+)[5]。本研究在以往研究基础上,采用免疫细胞化学、免疫荧光共聚焦、实时荧光定量PCR、Western blotting等方法比较CD99和BCL-6在L428和L428-CD99+细胞之间的表达差异及其意义,从而明确在霍奇金淋巴瘤中CD99和BCL-6之间的关系及对细胞增殖和凋亡的影响。
材 料 和 方 法
1材料
1.1细胞株 cHL细胞株L428细胞由南方医科大学广东省分子肿瘤病理重点实验室保存,过表达CD99的L428细胞株L428-CD99+由课题组前期构建,L428-CTR细胞为应用脂质体转染技术转染了空载体的L428细胞,均由南方医科大学广东省分子肿瘤病理重点实验室保存。
1.2主要仪器和试剂 胎牛血清为杭州四季青生物工程材料有限公司产品;兔抗人CD99单克隆抗体购自Abcam,鼠抗人CD99单克隆抗体购自北京中杉金桥生物技术有限公司,兔抗人BCL-6多克隆抗体购自北京博奥森生物技术有限公司,山羊抗兔IgG/辣根酶标记、山羊抗兔IgG/FITC和山羊抗鼠IgG/TRITC购自北京中杉金桥生物技术有限公司;免疫组化SP试剂盒购自北京中杉金桥生物技术有限公司;荧光共聚焦显微镜为Olympus FluoView 1000;流式细胞仪为Becton Dickinsion产品;总RNA提取试剂盒RNAisoTMPlus、逆转录试剂盒PrimeScript RT reagent Kit (Perfect Real Time)和荧光定量PCR试剂盒SYBR Premix Ex TaqTM均为大连宝生物工程有限公司产品;Western blotting I抗稀释液、II抗稀释液和发光液均购自碧云天生物技术有限公司。
2方法
2.1细胞培养 L428细胞、L428-CD99+细胞和L428-CTR细胞在含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基中,置37 ℃、5%CO2培养箱内培养,取对数期、生长状态良好的细胞进行实验。
2.2细胞蜡块制作 具体制作方法见参考文献[6]。
2.3免疫细胞化学 免疫细胞化学检测采用SP法,具体操作如下:细胞蜡块2 μm连续切片,石蜡切片脱蜡水化;用3%H2O2封闭内源性过氧化物酶;PBS洗后,分别用EDTA和柠檬酸溶液微波修复6 min和10 min,滴加I抗,37 ℃孵育1 h,PBS洗后,滴加过氧化物酶标记的II抗,37℃孵育45 min;PBS洗后,DAB显色;苏木素复染、脱水、透明、中性树胶封片。以已知阳性片作为阳性对照,以阴性表达的细胞作阴性对照。
2.4免疫荧光共聚焦检测细胞株中CD99和BCL-6的表达差异 (1)吸取培养瓶中的细胞悬液,经离心去上清转移至1.5 mL的EP管,0.02 mol/L PBS洗涤3次,每次5 min,用4%多聚甲醛0.5 mL室温固定30 min,再用0.02 mol/L PBS洗涤3次,每次5 min;(2)0.2% Triton X-100 0.5 mL室温破膜10 min,0.02 mol/L PBS洗3次,每次5 min;(3)10% 正常山羊血清0.2 mL封闭20 min,不洗;(4)I抗孵育:工作液鼠抗CD99抗体200 μL,稀释后兔抗BCL-6抗体200 μL,4 ℃孵育过夜,第2 d室温孵育30 min,0.02 mol/L PBS洗涤4次,每次3 min;(5)II抗孵育:在暗室内操作,I抗为CD99样品加山羊抗鼠IgG/TRITC 200 μL,I抗为BCL-6样品加山羊抗兔IgG/FITC 200 μL,室温避光,加上锡箔纸,孵育1 h,0.02 mol/L PBS洗3次,每次3 min;(6)每个样品加DAPI 200 μL,室温避光孵育5 min,0.02 mol/L PBS洗2次,每次5 min;(7)100 μL PBS重悬,转移至confocal皿,激光共聚焦显微镜观察。
2.5逆转录和荧光定量PCR检测细胞株中CD99和BCL-6 mRNA的表达差异 取培养细胞悬液5 mL,离心去上清,每107细胞中加入1 mL RNAiso Plus试剂,用移液器反复吹吸,室温静置5 min,向上述裂解液加入200 μL的氯仿,盖紧离心管盖,剧烈振荡15 s,室温静置5 min,12 000 r/min、4 ℃离心15 min。吸取上层无色上清液至一新离心管,加入等体积的异丙醇,混匀,室温静置10 min,12 000 r/min、4 ℃ 离心10 min,去上清,缓慢沿离心管壁加入1 mL预冷75 %乙醇,2 000 r/min、4 ℃离心5 min后小心弃去乙醇,室温干燥沉淀5 min,加入无RNA酶的水30 μL,待RNA完全溶解后于-80 ℃保存。CD99、BCL-6及内参照GAPDH引物序列见表1。细胞株的RNA按试剂盒步骤逆转录合成cDNA,作为模板进行荧光定量PCR 扩增,扩增程序如下:使用二步法进行检测,预变性95 ℃ 30 s;变性95 ℃ 5 s;退火58 ℃(CD99)或55 ℃(BCL-6) 34 s,共40个循环。反应结束后,立即进行扩增曲线和融解曲线分析。以GAPDH作为内参照,由公式2-ΔΔCt计算CD99和BCL-6 mRNA在这些细胞株中的相对表达量。

表1 荧光定量PCR的引物序列
2.6Western blotting检测细胞株中CD99和BCL-6的表达差异 取L428细胞、L428-CTR细胞和L428-CD99+细胞悬液,离心去上清,提蛋白前将PMSF 1 μL加入100 μL蛋白裂解液RIPA,将混合液加入细胞,冰上超声裂解细胞30次,每次大概0.5 s,间隔1 s,冰上裂解30 min,12 000 r/min离心30 min,取上清。BCA法测定蛋白浓度,酶标仪测定波长为570 nm,根据标准曲线计算出蛋白浓度。灌制10%分离胶,5%浓缩胶的SDS-PAGE 凝胶。吸取40 μg总蛋白,恒压80 V 30 min。当溴酚蓝前沿进入分离胶,把电压提高到120 V,继续电泳60 min直到溴酚蓝到达分离胶底部。切胶湿转恒流100 mA 120 min,将蛋白从SDS-PAGE 凝胶转至PVDF膜。TBST配制5%的脱脂奶粉封闭。用I抗稀释液按1∶100稀释BCL-6抗体,1∶1 000稀释CD99抗体,抗体和PVDF膜4 ℃孵育过夜。1 ∶5 000稀释山羊抗兔IgG/辣根酶标记II抗,孵育1 h,增强化学发光(enhanced chemiluminescence, ECL) 显影。UVI 凝胶成像系统摄像,Image-Pro Plus 5.10软件分析。
2.7MTT检测细胞株的增殖能力 RPMI-1640培养液将L428细胞、L428-CTR细胞和L428-CD99+细胞悬液调整为4×107cells/L,接种到96孔板上,每孔加细胞悬液200 μL,每组共设置3个复孔。空白对照加PBS 200 μL。随后,每孔加入20 μL 5 g/L的MTT溶液,继续培养4 h,吸去上清,每孔加150 μL DMSO,振荡10 min,酶联免疫仪检测570 nm波长的吸光度值(A值),每组实验重复3次。
2.8流式细胞术检测细胞株凋亡 取对数生长期L428细胞和L428-CD99细胞,离心去上清。将105~106个细胞悬浮于1 mL的RPMI-1640培养基中,再加入10 μL Hoechst 33342染液,混匀,37 ℃孵育15 min。加入1 mL buffer A工作液(用双蒸水将10×buffer A 稀释10倍)悬浮细胞,加入5 μL PI染液,室温避光放置5~15 min后混匀。上机,流式细胞术检测细胞的凋亡。
3统计学处理
用SPSS 13.0进行统计学处理。MTT实验采用析因分析,荧光定量PCR实验和流式细胞术测定细胞凋亡实验采用One-way ANOVA,以P<0.05为差异有统计学意义。
结 果
1免疫细胞化学检测CD99和BCL-6在细胞株中的表达
CD99在L428表达阴性(图1A),而在L428-CD99+为阳性表达(图1B),并定位于细胞膜;而BCL-6在L428表达阴性(图1C),在L428-CD99+为阳性表达(图1D),并定位于细胞核。
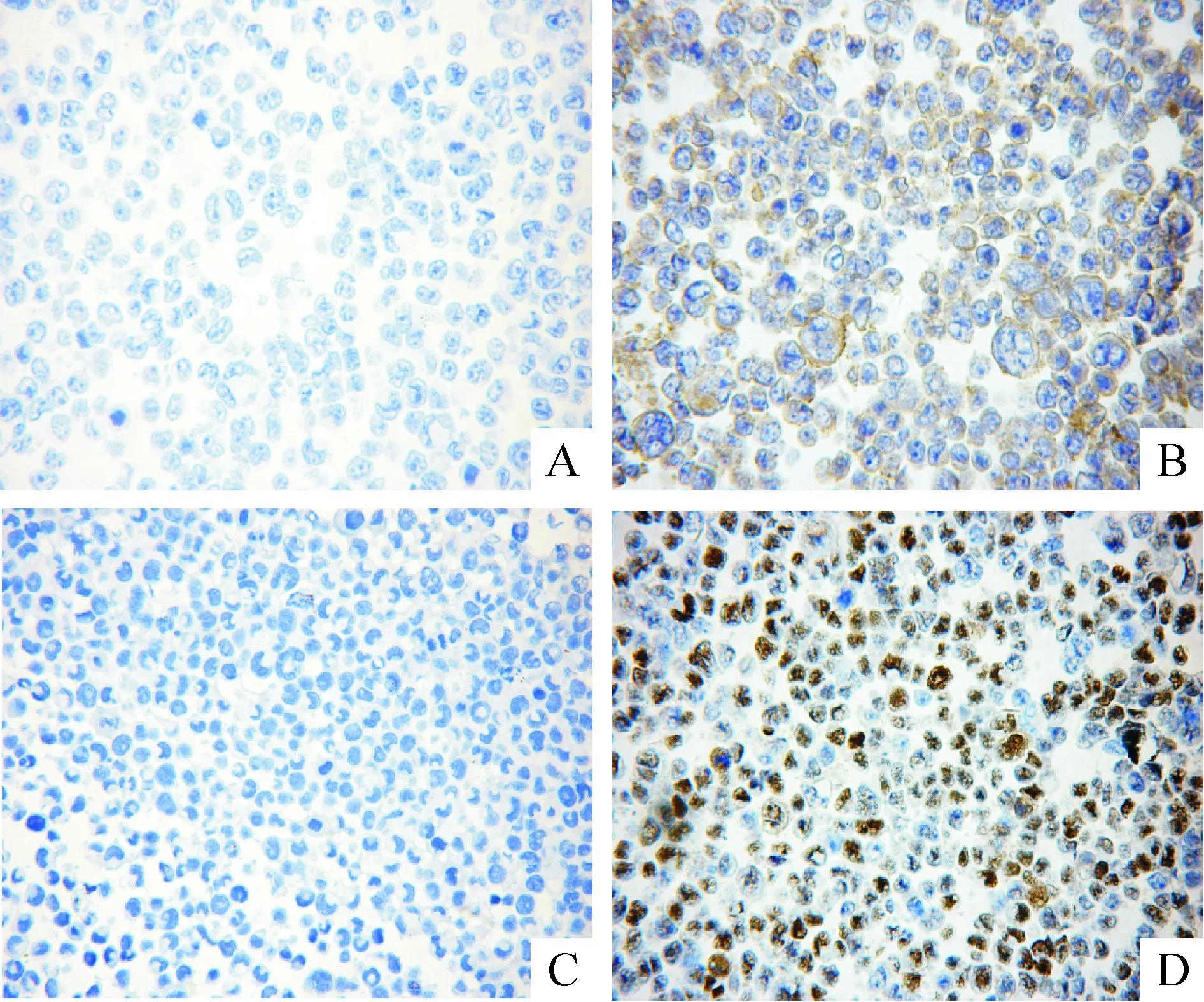
Figure 1. The expression of CD99 (A,B) and BCL-6 (C,D) in the cell lines of L428 (A,C) and L428-CD99+(B,D) detected by immunocytochemistry (SP,×400).
图1免疫细胞化学检测cHL细胞株L428和L428-CD99+中CD99和BCL-6的表达
2免疫荧光共聚焦检测L428和L428-CD99+细胞中CD99和BCL-6的表达
在L428细胞中,CD99表达为阴性,而在L428-CD99+细胞(图2A)表达阳性,且在细胞膜表达;BCL-6在L428细胞中表达为阴性,而在L428-CD99+细胞中表达为阳性(图2B),且在细胞核表达。
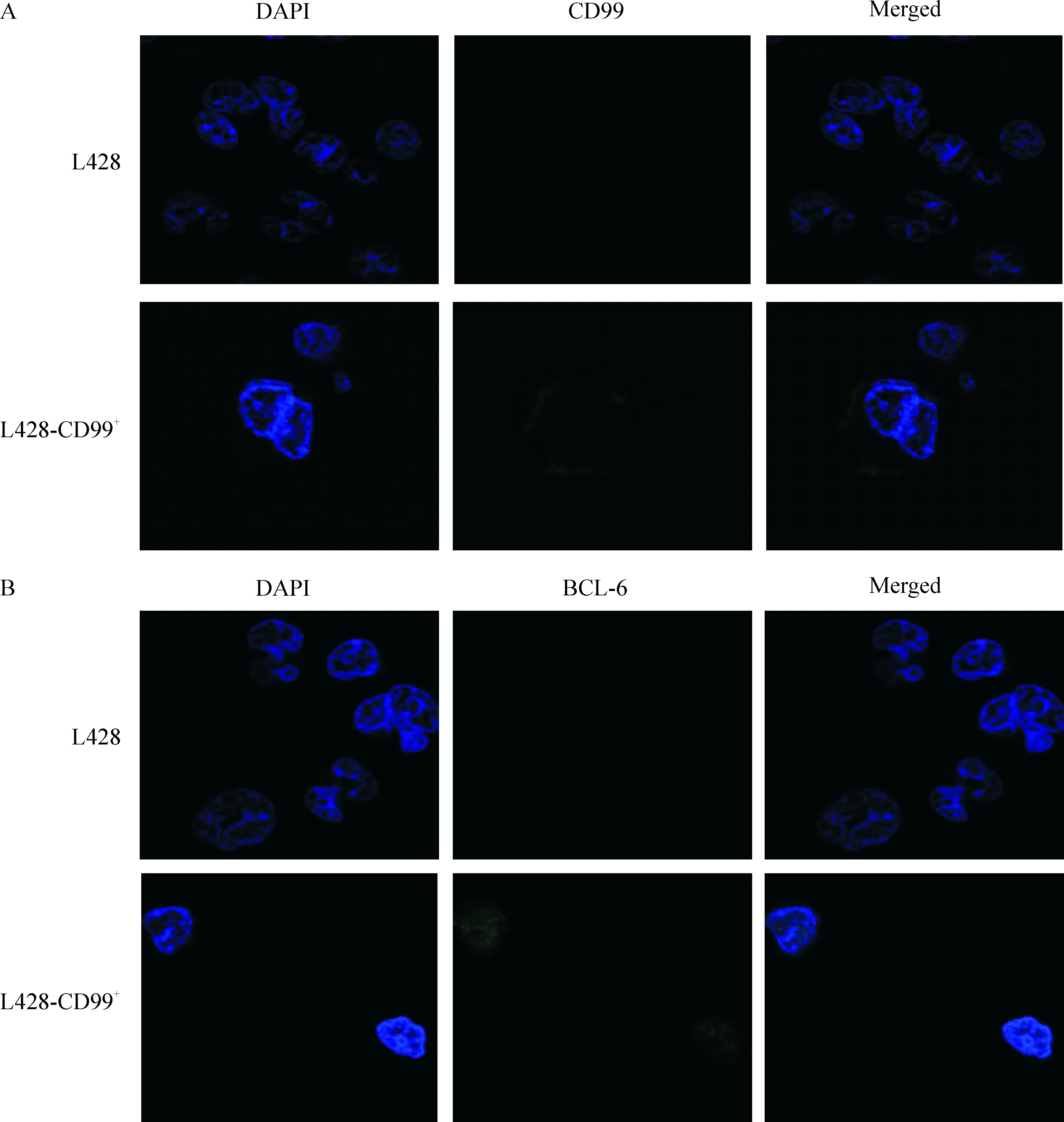
Figure 2. The expression of CD99 (A) and BCL-6 (B) in the cell lines of L428 and L428-CD99+detected by confocal immunofluorescence (×1 000).
图2免疫荧光共聚焦检测cHL细胞株L428、L428-CTR和L428-CD99+中CD99和BCL-6mRNA的表达
3荧光定量PCR检测L428、L428-CTR和L428-CD99+细胞中CD99和BCL-6mRNA的表达
与L428和L428-CTR细胞相比,L428-CD99+细胞的CD99 mRNA表达量明显增高,差异有统计学意义(P<0.01);与L428和L428-CTR细胞相比,L428-CD99+细胞的BCL-6 mRNA表达量明显增高,差异有统计学意义(P<0.01),见图3。
4Westernblotting检测L428、L428-CTR和L428-CD99+细胞中CD99和BCL-6的表达
在L428细胞和L428-CTR细胞中,CD99为阴性表达,而在L428-CD99+细胞中,CD99为阳性表达;在L428细胞和L428-CTR细胞中,BCL-6为阴性表达,而在L428-CD99+细胞中,BCL-6为阳性表达,见图4。

图3荧光定量PCR检测细胞株L428、L428-CTR和L428-CD99+中CD99和BCl-6mRNA的表达

Figure 4. Expression of CD99 and BCL-6 in the cell lines of L428, L428-CTR and L428-CD99+detected by Western blotting. β-actin was used as loading control.
图4Westernblotting检测细胞株L428、L428-CTR和L428-CD99+中CD99+和BCl-6的表达差异
5MTT检测L428、L428-CTR和L428-CD99+细胞的增殖能力
MTT 法检测L428、L428-CTR和L428-CD99+细胞体外增殖能力,经析因设计方差分析,结果显示不同细胞组之间差异显著(F=427.671,P<0.01);不同时点组对细胞体外增殖的影响差异显著(F=2029.134,P<0.01);细胞各组与各时点两因素交互效应显著(F=75.515,P<0.01)。3组细胞经多重比较显示,L428-CD99+细胞的增殖能力低于L428及L428-CTR细胞,差异有统计学意义(P<0.05),而L428和L428-CTR的增殖能力差异无统计学意义(P>0.05),见图5。
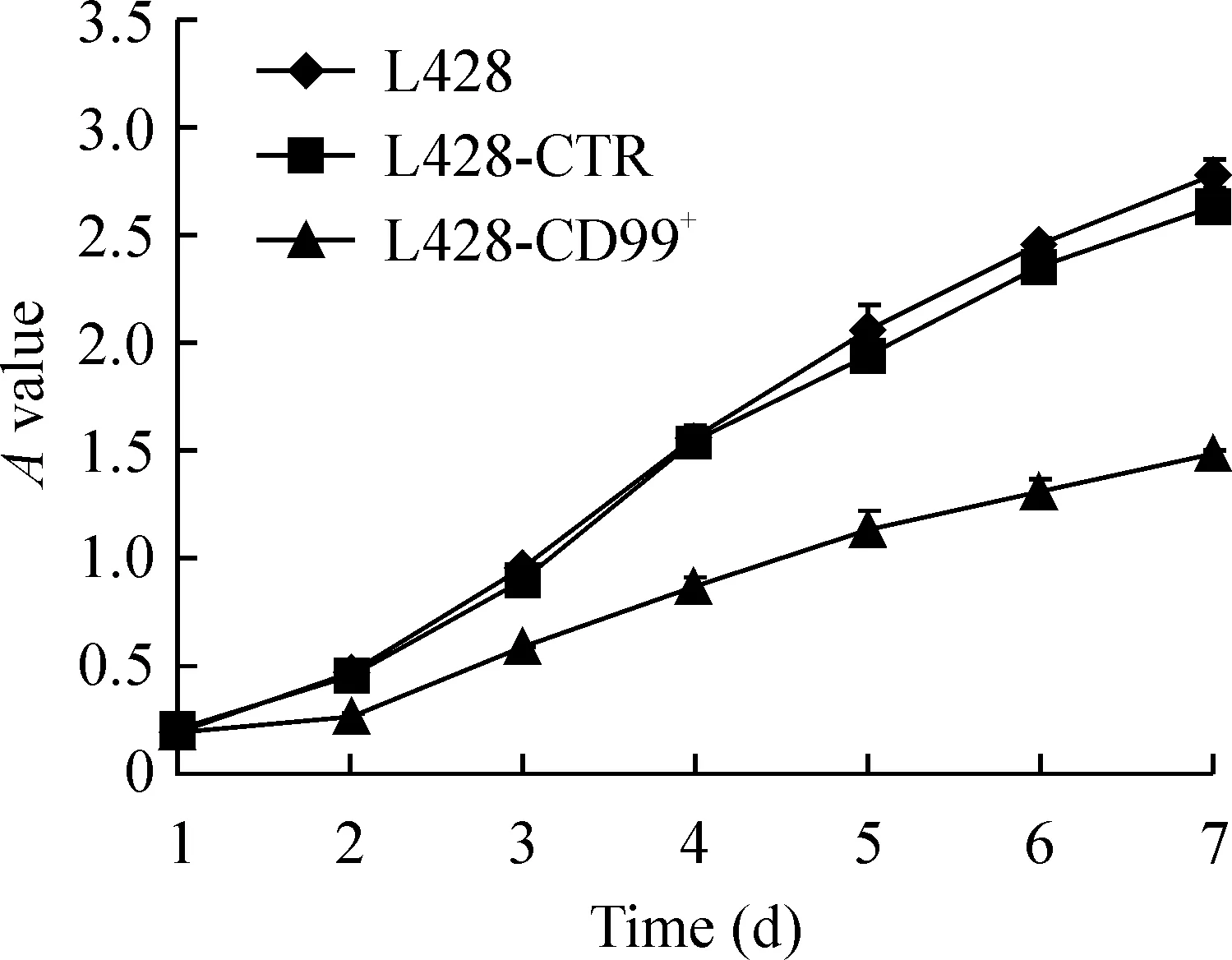
图5MTT实验检测细胞株L428、L428-CTR和L428-CD99+增殖能力的差异
6流式细胞术检测L428、L428-CTR和L428-CD99+细胞凋亡
结果可见L428-CD99+细胞凋亡率明显高于L428及L428-CTR细胞,差异有统计学意义(P<0.01),而L428和L428-CTR细胞的凋亡率差异无统计学意义(P>0.05),见图6。

图6流式细胞术检测细胞株L428、L428-CTR和L428-CD99+的凋亡率
讨 论
CD99的表达缺失是cHL发生发展的重要条件之一。1998年Kim 等[4]首先发现Hodgkin/Reed-sternberg(H/RS)细胞形态的发生与CD99表达缺失有关。本课题组前期也发现cHL病变组织内的H/RS细胞及cHL细胞株L428中CD99表达缺失[7-8],进一步证实了CD99在cHL中扮演了重要的角色。本课题组前期研究将小鼠B淋巴瘤细胞株A20的mCD99L2基因沉默,下调CD99的表达诱导了H/RS样细胞的产生[9-10]。上述研究在人和鼠验证了H/RS肿瘤细胞形态的发生与CD99表达缺失有关。本课题探究cHL细胞株L428中CD99过表达前后BCL-6的表达差异并探讨其对细胞增殖及凋亡的影响。
BCL-6 的生物学功能是调节淋巴结生发中心B细胞的分化和发育成熟,故生发中心B细胞表达BCL-6[11]。本课题揭示了过表达CD99后L428 的BCL-6表达水平增高,诱导残疾B细胞起源的cHL细胞株L428[12]向生发中心B细胞分化。BCL-6和细胞的凋亡也有着密切的关系,BCL-6的靶基因多数是抗凋亡基因如bcl-2或bcl-XL,BCL-6的表达增高往往伴随着Bcl-2或Bcl-XL的表达下降,从而导致细胞凋亡增加[13]。
本课题用荧光定量PCR、免疫细胞化学、免疫荧光共聚焦和Western blotting等方法从基因和蛋白水平验证了过表达CD99后的L428细胞BCL-6的表达水平增高,并且从MTT实验和流式细胞术检测细胞的凋亡率证实了过表达CD99后L428增殖能力减弱,细胞凋亡增加。这揭示了在L428细胞中,CD99过表达导致BCL-6的表达增高,有助于抑制细胞的增殖能力并促进细胞的凋亡,其原因可能是:一方面在cHL中NF-κB信号通路是持续激活的[14],而BCL-6是转录因子抑制剂,可抑制cHL赖以生存的NF-кB信号通路的转录[15],从而使cHL持续激活的NF-кB信号通路失活,从而影响细胞增殖能力和促进细胞凋亡;另一方面,Bcl-XL蛋白是一抗凋亡蛋白,在其启动子区包含BCL-6蛋白的结合位点,也就是说Bcl-XL蛋白是BCL-6的靶蛋白,所以BCL-6能直接结合bcl-XL的启动子区并抑制其表达。所以BCL-6表达增高,靶蛋白Bcl-XL表达就减少,抗凋亡的作用也减弱了,从而可促进细胞凋亡[16]。研究也显示BCL-6的表达可以作为DLBCL独立的预后因子,BCL-6在非霍奇金淋巴瘤中的高表达往往提示较好的预后[17]。Lossos等[18]研究表明在DLBCL中BCL-6蛋白高表达者比低表达者有更长的无病生存期,这也从临床上进一步证明了BCL-6有促进肿瘤细胞凋亡的作用,使预后变好。
[1] Ye BH, Rao PH, Chaganti RS, et al. Cloning ofbcl-6, the locus involved in chromosome translocations affecting band 3q27 in B-cell lymphoma[J]. Cancer Res, 1993, 53(12): 2732-2735.
[2] Zhang A, Ohshima K, Sato K, et al. Prognostic clinicopathologic factors, including immunologic expression in diffuse large B-cell lymphomas[J]. Pathol Int, 1999, 49(12): 1043-1052.
[3] Lee I, Kim MK, Choi EY, et al. CD99 expression is positively regulated by Sp1 and is negatively regulated by Epstein-Barr virus latent membrane protein 1 through nuclear factor-κB[J]. Blood, 2001, 97(11): 3596-3604.
[4] Kim SH, Choi EY, Shin YK, et al. Generation of cells with Hodgkin’s and Reed-Sternberg phenotype through downregulation of CD99 (Mic2)[J]. Blood, 1998, 92(11): 4287-4295.
[5] 黄作平, 何 滢, 周新华, 等.mic2/CD99基因克隆及在霍奇金淋巴瘤L428细胞株中表达[J]. 南方医科大学学报, 2009,29(12): 2407-2409.
[6] 王志强, 黄学平, 黎相照, 等. 悬浮培养细胞的细胞块制作及其应用[J]. 临床与实验病理学杂志,2009,25(6): 667-668.
[7] 李先茂, 李 燕, 赵 彤, 等. 霍奇金淋巴瘤CD99基因表达缺失的意义[J]. 第四军医大学学报,2004,25(23): 2136-2137.
[8] 沈丽佳, 何 滢, 蒋会勇,等. mic2/CD99 在经典型霍奇金淋巴瘤H/RS 细胞中的表达及与Eber-1/LMP-1相关性的研究[J].中国病理生理杂志, 2006, 22(4): 776-780.
[9] 何 滢, 沈丽佳, 李祖国, 等.mCD99L2基因沉默对小鼠B淋巴瘤细胞系A20细胞转化为H/RS样细胞的影响[J]. 基础医学与临床,2007,27(6):610-615.
[10]刘 芳,沈丽佳,陈小艳,等. 低表达mCD99L2鼠B淋巴瘤细胞亚系的建立及鉴定[J].中国病理生理杂志, 2008, 24( 8): 1501- 1505.
[11]Ye BH, Lista F, Lo CF, et al. Alterations of a zinc finger-encoding gene,BCL-6, in diffuse large-cell lymphoma[J]. Science, 1993, 262(5134): 747-750.
[12]Tinguely M, Rosenquist R, Sundstrom C, et al. Analysis of a clonally related mantle cell and Hodgkin lymphoma indicates Epstein-Barr virus infection of a Hodgkin/Reed-Sternberg cell precursor in a germinal center [J]. Am J Surg Pathol, 2003, 27(11): 1483-1488.
[13]Bai M, Agnantis NJ, Skyrlas A, et al. Increased expression of the bcl6 and CD10 proteins is associated with increased apoptosis and proliferation in diffuse large B-cell lymphomas[J]. Mod Pathol, 2003, 16(5): 471-480.
[14]Krappmann D, Emmerich F, Kordes U, et al. Molecular mechanisms of constitutive NF-κB/Rel activation in Hodgkin/Reed-Sternberg cells [J]. Oncogene,1999, 18(4): 943-953.
[15]Li Z,Wang X,Yu RY, et al. BCL-6 negatively regulates expression of the NF-κB1 p105/p50 subunit[J]. J Immunol, 2005,174(1):205-214.
[16]Tang TT, Dowbenko D, Jackson A, et al. The forkhead transcription factor AFX activates apoptosis by induction of the BCL-6 transcriptional repressor [J]. J Biol Chem, 2002, 277(16): 14255-14265.
[17]Chen YW, Hu XT, Liang AC, et al. High BCL6 expression predicts better prognosis, independent ofBCL6 translocation status, translocation partner, orBCL6-deregulating mutations, in gastric lymphoma[J]. Blood, 2006, 108(7): 2373-2383.
[18]Lossos IS, Jones CD, Warnke R, et al. Expression of a single gene, BCL-6, strongly predicts survival in patients with diffuse large B-cell lymphoma [J]. Blood, 2001, 98(4): 945-951.
DifferentialexpressionofBCL-6incelllinesofclassicalHodgkin’slymphomaL428andL428
LI Feng1, 2, HUANG Zuo-ping1, HUANG Xue-ping1, WANG Zhi-qiang1, ZHONG Lin1, ZHOU Xin-hua1, WU Zi-qing1, ZHU Mei-gang1, ZHAO Tong1
(1DepartmentofPathology,NanfangHospitalAffiliatedtoSouthernMedicalUniversity,Guangzhou510515,China;2DepartmentofOncology,GuangdongProvincialArmedForcesHospital,Guangzhou510507,China.E-mail:zhaotongketizu@126.com)
AIM: To investigate the expression of BCL-6 in classical Hodgkin’s lymphoma (cHL) cell lines, L428 (negative expression of CD99) and L428-CD99+(overexpression of CD99).METHODSThe expression of CD99 and BCL-6 at protein and mRNA levels was detected in the cell lines of L428 and L428-CD99+by the methods of immunocytochemistry, confocal immunofluorescence, real-time fluorescence quantitative PCR and Western blotting. MTT assay was used to determine the difference of proliferation between the cell lines of L428 and L428-CD99+. Apoptosis was analyzed by flow cytometry in the cell lines.RESULTSThe results of immunocytochemistry and confocal immunofluorescence showed that the expression of CD99 and BCL-6 was negative in L428 cell line, but positive in L428-CD99+cell line. The CD99 was localized in the membrane while BCL-6 expression was in the nucleus. The results of real-time fluorescence quantitative PCR showed that the mRNA expression levels of BCL-6 and CD99 in L428-CD99+cells were significantly higher than those in L428 cells (P<0.01). MTT assay showed that the proliferation capacity of L428 cells was higher than that of L428-CD99+cells (P<0.01). More apoptotic cells in L428-CD99+cell line than that in L428 cell line (P<0.01) were found.CONCLUSIONThe increased expression of CD99 and BCL-6 may lead to lower proliferation capacity and higher apoptotic rate of cHL, which are expected to be helpful in prevention and treatment of cHL.
L428 cell line; CD99; BCL-6
R363
A
10.3969/j.issn.1000-4718.2012.03.005
