成人循环内皮祖细胞的性别差异和雌二醇的体外动员作用*
2012-11-06费晓红叶红华阮列敏楼燕如张宜生沈旭平
费晓红, 叶红华△, 阮列敏, 杨 璐, 楼燕如, 张宜生, 沈旭平
(宁波市第一医院1心血管内科,2精神卫生科,3中心实验室,4妇产科,浙江 宁波 315010)
1000-4718(2012)03-0393-05
2011-10-06
2011-12-21
宁波市医学科技计划项目(No.2009A04)
△通迅作者 Tel: 0574-87085220; E-mail: yehonghua@medmail.com.cn
成人循环内皮祖细胞的性别差异和雌二醇的体外动员作用*
费晓红1, 叶红华1△, 阮列敏2, 杨 璐2, 楼燕如3, 张宜生4, 沈旭平1
(宁波市第一医院1心血管内科,2精神卫生科,3中心实验室,4妇产科,浙江 宁波 315010)
目的探讨成人循环内皮祖细胞(EPCs)数量及功能的性别差异、女性月经周期对其的影响和雌二醇的体外动员作用。方法选择月经周期正常的健康女性和年龄匹配的同等条件男性各10名,男性1次采血,女性在月经周期内3个性激素变化阶段(卵泡初期、排卵前期和黄体中期)分别采血。用流式细胞仪计数循环CD34+/CD133+/含有激酶插入结构域的受体(KDR)+的EPCs数量,放射免疫法测定雌二醇水平;经体外培养7 d,计数EPCs,并观察其黏附能力;分别通过跨膜迁移实验和增殖实验观察不同浓度雌二醇的影响。结果女性组循环EPCs数量明显高于男性组(P<0.01),月经周期内排卵前期和黄体中期明显高于卵泡初期(P<0.05)。经体外培养测定EPCs功能,男性与女性无明显差异。较高浓度的雌二醇(≥1×10-9mol/L)能显著增强EPCs的跨膜迁移能力和增殖能力(P<0.05)。结论成人循环EPCs数量存在性别差异并且受女性月经周期影响,雌二醇对EPCs的动员有重要作用。
内皮祖细胞; 雌二醇; 性别差异; 月经周期
干细胞或祖细胞的研究是目前生命科学研究中最具活力的研究领域之一。在诸多的干细胞研究中,内皮祖细胞(endothelial progenitor cells,EPCs)的研究正越来越多地受到人们的关注,尤其是外周血中的EPCs。EPCs是一类具有增殖分化能力并可分化为内皮细胞的前体细胞,参与损伤血管的再生和修复。近年来,EPCs在心脑血管疾病、肿瘤血管形成和创伤愈合等血管类疾病的治疗中展现出广泛的应用前景。流行病学资料显示育龄期女性和年龄相仿的男性相比动脉粥样硬化性心血管疾病的风险降低,证实了雌激素具有多种机制的心血管保护作用,其中之一可能通过EPCs实现[1],故雌激素和动脉粥样硬化性心血管疾病的研究转向新的可能机制和途径。
EPCs的性别差异近年来正在成为动脉粥样硬化性疾病性别差异的一个研究焦点。目前对健康成人循环EPCs数量的研究甚少,循环EPCs的性别差异尚不确定,女性月经周期对EPCs影响尚不确定。所以本研究从性别和女性月经周期不同阶段这两个方面切入,研究循环EPCs数量和功能的性别差异, 以及与雌激素的可能关系。
材 料 和 方 法
1标本来源
选择无高血压、糖尿病,不吸烟,无肥胖,无早发心血管疾病家族史,月经周期正常的育龄期健康女性和年龄匹配的同等条件男性各10名。女性在月经周期的卵泡初期(menstrual,M)、排卵前期(pre-ovulatory,PO)和黄体中期(mid-luteal,ML)分别抽取外周血25 mL;男性一次性抽取外周血25 mL。
2材料与试剂
CD133- PE购自eBioscience;CD34-ECD购自Coulter;含有激酶插入结构域的受体(kinase insert domain-containing receptor,KDR)- FITC购自BD;胎牛血清购自Gibco;EGM-2培养基购自Lonza;EGM2-MV Bullet Kit(CC-3202)购自Clonetic;人淋巴细胞分离液(Ficoll分离液)购自天津灏洋公司;DiI-acLDL购自Molecular Probe;人纤维连接蛋白、雌二醇、胰蛋白酶、FITC-UEA-I购自Sigma;MTT试剂盒购自Trevigen;MatrigelTMBasement Membrane Matrix购自Becton Dickison;Coster Transwell购自Corning。
3方法
3.1血标本收集 清晨空腹抽取外周血25 mL,分装2个试管,1管3 mL送性激素水平测定,另1管22 mL加肝素抗凝送循环EPCs计数和EPCs的分离、培养。
3.2性激素水平的测定 放射免疫法测定雌二醇水平。
3.3循环EPCs计数 取2 mL外周抗凝血,用流式细胞仪计数外周血中标记为CD34+/CD133+/KDR+的EPCs。
3.4循环EPCs分离、培养 20 mL外周抗凝血,与Hanks’液1∶1混匀,以4∶3比例小心加于Ficoll分离液上,2 000 r/min离心30 min,吸取单个核细胞层,用3倍体积的Hanks’液洗涤2次,每次都以1 500 r/min离心10 min,末次离心后弃去上清液,加入EGM-2培养液混悬,调整浓度为3×109/L,取2 mL接种于包被人纤维连接蛋白(1 mg/L)的6孔培养板中,在37 ℃、5%CO2条件下培养,48 h后换液,洗去非贴壁细胞,以后隔天换液继续培养至7 d。
3.5EPCs的鉴定 免疫荧光细胞化学染色法鉴定EPCs。培养7 d的贴壁细胞,更换含10 mg/L DiI-acLDL的培养液,37 ℃孵育4 h,PBS清洗后用4%多聚甲醛固定10 min,PBS浸洗2次,加入含10 mg/L FITC-UEA-I的培养液,37 ℃孵育1 h,PBS浸洗后在激光共聚焦显微镜下观察DiI-acLDL、FITC-UEA-I双荧光染色阳性即为EPCs。培养7 d的细胞,相差显微镜下对EPCs进行记数(随机选取10个200倍视野)。
3.6黏附能力 EPCs培养7 d后用0.25%胰蛋白酶消化收集贴壁细胞,悬浮于1 mL培养液中计数,然后将同等数量的EPCs接种于包被人纤维连接蛋白的6孔培养板,37 ℃培养30 min,计数10个随机200倍视野中的贴壁细胞。
3.7雌二醇的体外动员作用 选取培养7 d的细胞,用0.25%胰蛋白酶消化收集贴壁细胞,分别通过跨膜迁移实验和增殖实验观察雌二醇对EPCs的影响。
3.7.1跨膜迁移能力检测 用50 mg/L Matrigel包被Transwell小室底部,37 ℃风干备用。将Transwell小室放在24孔培养板中,然后将100 μL、1×109/L细胞悬液接种于Coster Transwell(膜直径6.5 mm,孔径8 μm)的上层,下层加入600 μL的培养液,并分别在培养液中加入雌二醇(终浓度分别为1×10-10、1×10-9、1×10-8mol/L),在37 ℃、5%CO2条件下孵育24 h。拭去上室滤膜面的未迁移细胞,保留定向迁移至滤膜下表面的细胞,4%多聚甲醛固定30 min,Giemsa染色,每片膜计数5个随机200倍视野中的迁移细胞。以加入PBS代替雌二醇作为对照组。
3.7.2增殖能力检测 MTT比色实验。取1 mL、 2×107/L细胞悬液接种于包被人纤维连接蛋白的96孔培养板中,加入雌二醇(浓度为1×10-10、1×10-9、1×10-8mol/L),在37 ℃、5%CO2条件下孵育24 h。每孔加MTT溶液(5 g/L)20 μL,混匀后继续孵育4 h,吸弃孔内培养液,加入二甲基亚砜150 μL,振荡10 min,在自动酶联检测仪上选择490 nm波长测定各孔的吸光度(A)值。以加入PBS代替雌二醇作为对照组。
4统计学处理
结 果
1循环EPCs数量和雌二醇水平
女性组在月经周期内3个不同阶段(卵泡初期、排卵前期、黄体中期)循环EPCs数量均明显高于男性组(P<0.01),提示EPCs的性别差异。在这3个阶段中,排卵前期、黄体中期循环EPCs的数量要明显高于卵泡初期(P<0.05)。同步测定外周血雌二醇水平,男性组低于女性组平均水平,女性组在排卵前期、黄体中期明显高于卵泡初期(P<0.01),和循环EPCs数量变化一致。所以女性循环EPCs数量受月经周期影响,并与雌二醇水平呈正相关(r=0.428,P<0.05),见图1、表1。

Figure 1. Flow cytometric analyses of EPCs. B: cells displayed the CD34+phenotype. Quadrant D2: cells displayed the CD34+/CD133+/KDR+phenotype.
图1流式细胞术分析图
表1成人循环EPCs数量、雌二醇水平


GroupAge(year)BMI(kg/m2)EPCs(×103/L)Estradiol(ng/L)Men23.4±1.120.8±1.6226±6542.5±5.8Women-M23.3±0.920.3±1.3510±166**37.6±12.4Women-PO23.3±0.920.3±1.3727±133**##246.6±90.0##Women-ML23.3±0.920.3±1.3638±163**#191.3±91.8##
**P<0.01vsmen group;#P<0.05,##P<0.01vswomen-M group. M: menstrual; PO: pre-ovulatory; ML: mid-luteal; BMI: body mass index.
2EPCs的鉴定、计数和黏附能力的测定
分离获得的单个核细胞培养7 d后呈梭型,见图2,用激光共聚焦显微镜鉴定,DiI-acLDL染色呈红色荧光,FITC-UEA-I染色呈绿色荧光,双荧光染色阳性的细胞呈黄色,被认为是正在分化的EPCs,见图3。经体外培养7 d后,细胞数量(cells/×200视野)男性组为61.5±12.3,女性组在卵泡初期、排卵前期、黄体中期分别为61.4±10.7、64.5±10.5、63.9±10.9;黏附能力(cells/×200视野)男性组为25.9±5.6,女性组分别为25.0±4.1、21.6±4.0、23.6±2.9。组间无明显差异。

Figure 2. The mononuclear cells culturedinvitrofor 7 d (phase contrast microscopy, ×200).
图2单个核细胞体外培养7d后细胞形态
3雌二醇的体外动员作用
不论是男性组还是女性组,EPCs的跨膜迁移能力和增殖能力与雌二醇浓度呈正相关(r=0.779,P<0.01;r=0.585,P<0.01),当雌二醇浓度≥1×10-9mol/L时,与对照组相比差异有统计学意义(P<0.05),但男女2组之间及月经周期内不同阶段之间无明显差异,见表2、3)。所以雌激素能增强EPCs的跨膜迁移能力和增殖能力,但这种体外动员作用不存在性别差异。

Figure 3. Immunocytochemical fluorescence staining showing EPCs culturedinvitrofor 7 d (confocal laser scanning microscopy, ×400). A: EPCs containing DiI-acLDL express red signals; B: EPCs containing FITC-UEA-I express green signals; C: EPCs containing DiI-acLDL and FITC-UEA-I express orange signals.
图3体外培养7d后免疫荧光细胞化学染色鉴定EPCs
表2雌二醇对EPCs跨膜迁移能力的影响
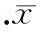

GroupControlConcentrationofestradiol(mol/L)1×10-101×10-91×10-8Men262.5±45.4298.8±51.9353.7±31.8**408.2±30.4**Women-M269.6±38.4307.9±47.7335.2±35.1**405.9±42.4**Women-PO288.1±39.9320.6±21.7336.8±47.1*381.1±27.5**Women-ML287.5±35.4323.4±32.6376.4±40.7**408.3±33.0**
*P<0.05,**P<0.01vscontrol group. M: menstrual; PO: pre-ovulatory; ML: mid-luteal.
表3雌二醇对EPCs增殖能力的影响
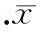

GroupControlConcentrationofestradiol(mol/L)1×10-101×10-91×10-8Men0.508±0.0770.563±0.0620.601±0.050**0.630±0.045**Women-M0.539±0.0440.589±0.0520.628±0.042**0.642±0.063**Women-PO0.556±0.0400.582±0.0510.621±0.064*0.654±0.044**Women-ML0.546±0.0540.588±0.0520.617±0.059*0.632±0.052**
*P<0.05,**P<0.01vscontrol group. M: menstrual; PO: pre-ovulatory; ML: mid-luteal.
讨 论
1997年Asahara等首次提出了具有血管新生作用的EPCs,自此有关EPCs的研究成为热点。EPCs是发源于中胚层的一群发源部位紧邻、并具有发育和分化为外周血管内皮细胞功能的细胞群。根据目前的研究,EPCs主要来源于外周血、骨髓、髓外单核系(CD14阳性)细胞、组织干细胞,这些不同来源的EPCs组成了一个有很强异质性的细胞群,具有启动新血管形成的潜能和靶向修复受损血管的能力。
EPCs自从被发现以来,一直没找到特异的标记。最初EPCs被标记为既表达造血干细胞的表面抗原如CD34,又表达内皮系的表面抗原如KDR。但是CD34在成熟血管内皮细胞也有低水平的表达。后来发现另一个造血干细胞标记CD133在成熟血管内皮细胞不表达,而且纯的CD133+细胞在体外可以分化为内皮细胞。故认为CD133+KDR+细胞似乎更能代表EPCs,CD34+KDR+细胞似乎也代表从血管壁脱落的成熟内皮细胞,而CD34+/CD133+/KDR+则可能是更为精确的EPCs表型[2]。也有学者将DiI-acLDL和FITC-UEA-I双染色阳性细胞视为正在分化的内皮祖细胞,但是这两个特性也都能见于成熟内皮细胞。
大量研究显示了血管疾病及其相关危险因素导致EPCs的减少,如糖尿病[3]、脑卒中[4]、高脂血症[5]、吸烟[6]等。冠状动脉疾病的患者外周血中EPCs的数量和疾病的严重程度呈负相关[7],稳定型心绞痛患者侧支循环形成的程度与EPCs数量呈正相关[8]。因此提出循环 EPCs数量可以综合反映危险因素,作为内皮损伤的标志,是动脉粥样硬化发生的始动环节。从而推测,EPCs在动脉粥样硬化和冠心病发生和发展中扮演了重要角色,是一个可能的预测因子。而目前还没有关于健康人EPCs数量的系统研究。所以本研究就健康成人为研究对象,测定其外周血CD34+/CD133+/KDR+EPCs的数量,明确了EPCs的性别差异,为今后进一步深入研究奠定了基础。经体外培养测定细胞功能不存在性别差异,与体内细胞数量结果不一致,推测可能原因为体外培养脱离了雌激素的影响,致性别差异不明显,且两种方法测定目的不一样(数量和功能),会存在结果不一致可能。
已有研究结果表明,雌激素能提供多种机制的心血管保护作用,其中可能与EPCs有关[1]。雌激素可能通过EPCs的雌激素受体作用,刺激血管内皮生长因子(vascular endothelial growth factor,VEGF)等释放,促进EPCs的动员、增殖、血管修复作用,并通过抗凋亡作用等影响EPCs数量[9]。Masuda等[10]的研究显示在正常妇女的外周血中,EPCs的数量与雌激素水平呈正相关。有关月经周期和心血管事件的研究显示,患有冠心病的绝经前女性患者心肌缺血事件与低雌激素水平相关[11],急性冠脉事件在月经周期早期发生率升高[12]。从本研究结果分析,循环EPCs数量男性明显低于女性,在女性月经周期中卵泡初期明显低于排卵前期和黄体中期,与心血管风险增加相关,由此推测EPCs可能是心血管疾病的一个保护因子。有关雌二醇对EPCs的体外动员作用,本研究显示当雌二醇浓度低于1×10-9mol/L时,这种动员作用较弱,但随着雌二醇浓度的增加,对EPCs的动员是非常明显的,推测动员EPCs可能是雌激素发挥作用的路径之一。
EPCs 在新生血管的形成及其在缺血性心血管疾病的治疗和预防中发挥重要作用。早在2000年由Kalka等[13]将体外扩增后人的外周血EPCs移植到裸鼠下肢缺血模型体内,发现血管密度增加,缺血明显改善,下肢残缺率减少。而后的TOPCARE-AMI研究显示,经冠状动脉内移植骨髓干细胞或外周血来源的EPCs治疗急性心肌梗死患者,分别随访4个月和1年,移植组患者左室射血分数(left ventricular ejection fraction,LVEF)明显改善[14]。所以,通过体外扩增为缺血组织提供EPCs以促进血管形成、修复,成为治疗动脉粥样硬化性心血管疾病的一种新策略。更有研究证实人外周血来源的EPCs能被诱导分化为心肌细胞,从而为EPCs细胞移植治疗心肌坏死性疾病提供了充分的实验依据[15]。
总之,EPCs具有广泛的应用前景。本研究显示了循环EPCs的性别差异和月经周期对其的影响,肯定了雌二醇的体外动员作用,进一步深入研究参与EPCs动员的因素,对临床利用EPCs治疗缺血性心血管疾病具有重要意义。
[1] Fadini GP, Kreutzenberg S, Albiero M, et al. Gender differences in endothelial progenitor cells and cardiovascular risk profile: the role of female estrogens[J]. Arterioscler Thromb Vasc Biol, 2008, 28(5): 997-1004.
[2] Fadini GP, Baesso I, Albiero M, et al. Technical notes on endothelial progenitor cells: Ways to escape from the knowledge plateau[J]. Atherosclerosis,2008, 197(2):496-503.
[3] Loomans CJ, de Koning EJ, Staal FJ, et al. Endothelial progenitor cell dysfunction: a novel concept in the pathogenesis of vascular complications of type 1 diabetes[J]. Diabetes, 2004, 53(1):195-199.
[4] Ghani U, Shuaib A, Salam A, et al. Endothelial progenitor cells during cerebrovascular disease[J]. Stroke, 2005, 36(1):151-153.
[5] Chen JZ, Zhang FR, Tao QM, et al. Number and activity of endothelial progenitor cells from peripheral blood in patients with hypercholesterolaemia[J]. Clin Sci, 2004, 107(3): 273-280.
[6] Kondo T, Hayashi M, Takeshita K, et al. Smoking cessation rapidly increases circulating progenitor cells in peripheral blood in chronic smokers[J]. Arterioscler Thromb Vasc Biol, 2004, 24(8):1442-1447.
[7] Vasa M , Fichtlscherer S, Aicher A , et al. Number and migratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease[J]. Circ Res, 2001, 89(1): E1-E7.
[8] 陈继舜,杨汉东,闵新文,等. 稳定性心绞痛患者内皮祖细胞与侧支循环之间的关系探讨[J]. 中国病理生理杂志,2008,24(12): 2475-2477.
[9] Imanishi T, Tsujioka H, Akasaka T. Endothelial progenitor cell senescence: Is there a role for estrogen?[J]. Ther Adv Cardiovasc Dis, 2010, 4(1):55-69.
[10]Masuda H, Kalka C, Takabashi T, et al. Estrogen-mediated endothelial progenitor cell biology and kinetics for physiological postnatal vasculogenesis[J]. Circ Res, 2007, 101(6):598-606.
[11]Kawano H, Motoyama T, Ohgushi M, et al. Menstrual cyclic variation of myocardial ischemia in premenopausal women with variant angina[J]. Ann Intern Med, 2001, 135(11):977-981.
[12]Hamelin BA, Methot J, Arsenault M, et al. Influence of the menstrual cycle on the timing of acute coronary events in premenopausal women[J]. Am J Med, 2003, 114(7):599-602.
[13]Kalka C, Masuda H, Takahashi T, et al. Transplantation ofexvivoexpanded endothelial progenitor cells for therapeutic neovascularization [J]. Proc Natl Acad Sci U S A, 2000, 97(7):3422-3427.
[14]Schächinger V, Assmus B, Britten MB, et al. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction: final one-year results of the TOPCARE-AMI Trial[J]. J Am Coll Cardiol, 2004, 44(8):1690-1699.
[15]邵诗颖,王红祥,李宾公,等. 人外周血来源内皮祖细胞诱导分化为心肌样细胞的实验研究及机制探讨[J]. 中国病理生理杂志,2007,23(10): 2054-2056,2062.
Genderdifferencesinadultcirculatingendothelialprogenitorcells(EPCs)andeffectofestradiolonarousingofEPCsinvitro
FEI Xiao-hong1, YE Hong-hua1, RUAN Lie-min2, YANG Lu2, LOU Yan-ru3, ZHANG Yi-sheng4, SHEN Xu-ping1
(1DepartmentofCardiology,2DepartmentofPsychiatry,3CentralLaboratory,4DepartmentofObstetrics&Gynecology,NingboFirstHospital,Ningbo315010,China.E-mail:yehonghua@medmail.com.cn)
AIM: To investigate the gender differences and influence of menstrual cycle on the number and activity of adult circulating endothelial progenitor cells (EPCs), and the effect of estradiol on EPCs.METHODSTen men and 10 women were enrolled in the study. Peripheral blood samples of the men were collected only once and peripheral blood samples of the women were collected at each menstrual cycle phase (menstrual, pre-ovulatory and mid-luteal phases). The number of CD34+/CD133+/kinase insert domain-containing receptor (KDR)+EPCs was determined by flow cytometry analysis and the level of circulating estradiol was measured by radioimmunoassay. Mononuclear cells were isolated from the blood and culturedinvitro. After cultured for 7 days, the number and the adhesive capacity of EPCs were observed. The effect of estradiol on the EPCs were detected by transmembrane migration assay and proliferation assay.RESULTSThe number of circulating EPCs was significantly higher in women than that in men (P<0.01), and it was higher at the pre-ovulatory phase and the mid-luteal phase than that at the menstrual phase (P<0.05). After culturedinvitro, the activity of EPCs did not reveal gender difference. In the cells treated with estradiol at concentration of ≥1×10-9mol/L, the capacities of transmembrane migration and proliferation were significantly increased (P<0.05).CONCLUSIONThere are the gender differences of adult circulating EPCs between men and women. The number and activity of adult circulating EPCs may be regulated by menstrual cycle. In addition, estrogen plays an important role in the arousing of EPCs.
Endothelial progenitor cells; Estradiol; Gender differences; Menstrual cycle
R363.2
A
10.3969/j.issn.1000-4718.2012.03.002
