黄芪多糖对脑缺血再灌注大鼠脑皮质中HSP70、PKB和P53蛋白表达的影响*
2012-11-06黄德彬刘锦红周庆华
颜 玲, 黄德彬, 刘锦红, 周庆华
(1湖北民族学院医学院,湖北 恩施 445000; 2荆楚理工学院医学院,湖北 荆州 434000)
1000-4718(2012)09-1610-08
2012-03-30
2012-07-06
湖北省自然科学基金资助项目(No.2008ABA197)
△通讯作者 Tel: 0718-8437479;E-mail:hdb66910@163.com
黄芪多糖对脑缺血再灌注大鼠脑皮质中HSP70、PKB和P53蛋白表达的影响*
颜 玲1△, 黄德彬1, 刘锦红1, 周庆华2
(1湖北民族学院医学院,湖北 恩施 445000;2荆楚理工学院医学院,湖北 荆州 434000)
目的探究黄芪多糖(AP)改善脑缺血再灌注大鼠神经功能和阻止脑皮质神经元凋亡的分子机制。方法将120只雄性Wistar大鼠随机分成假手术组(SOG)、模型组(MG-1 d、3 d、7 d)、低剂量AP治疗组(L-APTG-1 d、3 d、7 d)和高剂量AP治疗组(H-APTG-1 d、3 d、7 d)。MG和APTG阻断右侧大脑中动脉形成缺血性脑损伤后,L-APTG和H-APTG分别腹腔注射AP 5 mg·kg-1和15 mg·kg-1。于1 d、3 d和7 d分别脑血流再灌注,神经功能缺损评分后处死取材,电镜观察神经元结构变化,流式细胞术分析神经元凋亡,免疫组化和Western blotting法检测脑皮质神经元热休克蛋白70(HSP70)、蛋白激酶B和P53蛋白表达。结果H-APTG神经功能缺损评分和脑皮质神经元凋亡数显著低于MG和L-APTG(P<0.05);电镜下神经元结构(核糖体内质网、核仁、高尔基复合体、线粒体等)优于MG和L-APTG;在1 d、3 d和7 d,H-APTG脑皮质神经元HSP70和PKB蛋白表达显著高于L-APTG,后者又显著高于MG(P<0.05);H-APTG P53蛋白表达显著低于L-APTG,后者又显著低于MG(P<0.05)。结论AP能改善脑缺血再灌注神经功能损伤和抑制神经元凋亡,其机制与促进脑皮质神经元HSP70和PKB蛋白表达,抑制P53蛋白表达有关。
脑缺血再灌注; 黄芪多糖; 大脑皮质; 热休克蛋白70; 蛋白激酶β; 抑癌蛋白P53
脑缺血可导致持续缺血缺氧,继而引起原发缺血性损伤和继发缺血再灌注性损伤,最终导致脑细胞不可逆的坏死与凋亡[1]。临床表现为难以恢复的脑损伤后遗症。目前对其治疗方法主要是通过促进缺血区脑组织供血、保护脑组织和加速脑组织重建等。但这些仍未有充分的证据证实其有效性。黄芪多糖(Astragaluspolysaccharide,AP)有调节免疫、抗氧化和延缓衰老作用[1]。我们曾研究发现AP能调控海马部分神经递质和c-fos mRNA表达[1]。本实验发现AP能显著减少脑缺血再灌注大鼠脑皮质细胞凋亡,稳定和逆转其超微结构,与增加热休克蛋白70(heat-shock protein 70,HSP70)和蛋白激酶B(protein kinase B,PKB)蛋白表达有关。
材 料 和 方 法
1材料
1.1动物 经过行为学筛选合格的封闭群雄性Wistar大鼠120只(180~220 g,重庆医科大学实验动物中心提供)。
1.2器材与试剂 石蜡包埋机(EG1150-H)、切片机(RM2245)和显微镜(DM2000)均为Leica产品。Pharmacia Gene Quant II型 RNA/DNA 检测仪(Pharmacia Gene Quant Pro)。S-450D超声波细胞破碎仪(PhD国际科技有限公司)。TP600型PCR基因扩增仪(TaKaRa)。3K30型低温高速离心机(Sigma)。F200酶标仪(帝肯)。流式细胞仪(ELITEESP, Coulte)。台式低温高速离心机(Heraus)。电泳仪及电泳槽(江苏仪器厂)。超低温冰箱(SANYO)。倒置荧光显微镜(Leica)。Du-7500 紫外分光光度计(Beckman)。H-600透射电镜(日立)。BH-2光学显微镜(Olympus)。全自动生化分析仪(美国思博名科学器材公司)。AP(Sigma-Aldrich)。氯化2,3,5-三苯基四氮唑(TTC,Sigma-Aldrich)。水合氯醛(上海金贸泰化工有限公司)。RNA酶A(RNase A,Sigma)。SP免疫组化检测试剂盒(博士德生物工程有限公司)。
2方法
2.1动物处理与神经功能分级[2-3]10%水合氯醛(350 mg·kg-1,ip)麻醉仰卧位固定,右腹股沟切开暴露股动脉插管采血(作对照分析)后备用。颈正中纵行切口(1~1.5 cm)逐层分离,充分暴露右颈总动脉、颈外动脉及颈内动脉。选取90只大鼠作为右侧大脑中动脉阻塞模型(right middle cerebral artery occlusion,RMCAO),在颈外动脉与颈内动脉分叉处结扎颈外动脉,同时结扎劲总动脉近心端,以动脉夹阻流远心端,并于近心端与远心端之间预置一缝合丝线后,在劲总动脉上剪一“V”字形切口。用Longa和Nagasawa线栓法[3],以酒精灯烧灼单股尼龙丝线(直径0.235 mm,长2 cm),使其前端光滑呈圆球状并消毒后,将丝线栓球面端插入“V”字形切口,将颈内动脉上的动脉夹松开,顺势将丝线栓由劲总动脉缓慢插入颈内动脉,直至大脑中动脉起始部,略有阻力感即停止(插入线栓长度自颈外与颈内动脉分叉处至大脑中动脉起始部约为18 mm±1 mm),阻断右侧大脑中动脉血供[4]。随即扎紧预置在劲总动脉上的缝合丝线(防止线栓滑脱和出血),将各组织复位,逐层缝合。弃用术中呼吸困难、出血过多的大鼠。另30只大鼠作为假手术组(sham operation group,SOG)仅仅只将栓线插入颈内动脉6 mm,而未达大脑中动脉起始部。各组动物室温均保持在25 ℃左右,维持正常肛温为(37±0.5)℃。分别于动物意识恢复后30 min,药物治疗1 d、3 d、7 d断头取血前12 h进行神经功能缺陷评分。0分:无神经功能障碍;1分:左前爪外展不充分;2分:左转圈式行走;3分:左倾倒式行走;4分:无法自主行走伴有意识障碍。
2.2动物分组及治疗 RMCAO中筛选出1~3分合格大鼠共72只,随机分成3组模型组(MG-1 d、3 d、7 d,n=8)、3组低剂量AP治疗组(L-APTG-1 d、3 d、7 d,n=8)和3组高剂量AP治疗组(H-APTG-1 d、3 d、7 d,n=8)。SOG中筛选出1~3分合格大鼠共27只,随机分成3组假手术组(SOG-1 d、3 d、7 d,n=9)。L-APTG和H-APTG术后分别每天2次 AP 5 mg·kg-1和15 mg·kg-1(ip,以生理盐水稀释成2 mL),直至处死取材。SOG和MG术后每天2次注射等容量生理盐水(ip)。
2.3HE染色与透射电镜观察 分别于术后1 d、3 d和7 d,最后1次腹腔注射药物后,禁食12 h断头取血,使头置于冰块上开颅取出脑,迅速置于垫有冰盘的滤纸上,以生理盐水冲洗3~5次后,剥离出大脑皮层,左侧大脑皮层组织作为对照切片。生理盐水冲洗3~5次,分别取出部分大脑皮层额叶、顶叶、枕叶以及视交叉。用LKBⅢ型超薄切片机从前至后连续冠状切片各3张(5~8 μm),放入4%多聚甲醛固定液中固定24 h后,石蜡包埋,HE染色,光学显微镜下观察。取出相应脑皮质组织以2%戊二醛溶液固定24 h后,PBS(0.1 mol/L)漂洗,1%锇酸固定(1.5 h),用丙酮和乙醇逐级脱水,环氧丙烷与环氧树脂(Epon 812)等比混合浸透和包埋,超薄切片机切片(50~70 nm),醋酸铀和柠檬酸铅后染色电镜下观察和拍片。
2.4细胞凋亡率检测 于各时点分别取出少量大脑额顶叶皮质(60 mg)于冰盘上用眼科剪剪碎,将碎片组织置于300目铜网,以PBS液冲洗3次,制成单细胞悬液(网搓法),加入PBS(0.1 mol/L)稀释成10 mL,反复30次吹打后,沉淀10 min,再经10 min离心(3 000 r/min),弃去上清液,加冷却的乙醇5 mL (75%)混匀,于4 ℃冰箱静置12 h后, 经10 min离心(3 000 r/min),第2次弃上清液。加入PBS(0.1 mol/L)5 mL稀释混均,再次离心10 min,弃上清液。吸取沉淀物,将细胞浓度调整为2×109·L-1,吸取取细胞悬液1 mL加入1.6 mL RNase (1 g·L-1),置入水浴箱中,孵育30 min(37 ℃)后离心 10 min,吸取沉淀物加到PBS 0.4 mL中稀释,加200 μL PI染色液染色30 min(4 ℃,通光)。上流式细胞仪,绘制DNA含量图,以G1峰前亚二倍体峰(Ap)百分比作为细胞凋亡率(功率300 mW,离子激发光波长488 nm)。其染色阳性细胞数通过计算机软件处理。剩下脑皮质组织分别迅速放入5 mL的清洁塑料离心管,置于冰箱备用(-85 ℃),分别检测脑皮质匀浆HSP70、PKB和P53蛋白表达。
2.5脑皮质HSP70、PKB和P53蛋白表达的测定
2.5.1免疫组化测定 玻片以3-氨丙基三乙氧基甲硅烷(3-aminopropyltrimethoxysilane,APES)挂胶和捞片后,上烤片机1 h(60 ℃),经过一系列的固定、脱水、透明、包埋和切片后,于载玻片上(经过防脱片剂处理)放入烤箱(24 h,60 ℃),于4 ℃冰箱保存备用。石蜡切片脱蜡水化,3%H2O2室温孵育15 min,分别以蒸馏水和PBS各冲洗3次(每次5 min),中低火微波修复抗原(15 min),冷却至室温。以PBS冲洗3次,滴入Ⅰ抗工作液(HSP70、PKB和P53浓度分别为1∶100、1∶20和1∶50)。置于4 ℃冰箱24 h,以PBS冲洗3次后,滴入山羊抗兔IgG抗体,室温下经过20 min孵育,以PBS冲洗3次,DAB 底物工作液滴于切片上,显微镜下控制显色,自来水终止显色反应。乙醇梯度脱水,用二甲苯透明,中性树脂封片后观察。将棕黄色的细胞核或细胞浆定为阳性细胞。光镜放大400倍,选择5个不重叠的缺血梗死灶周边区皮质视野作为计数阳性细胞,记录每100个细胞中阳性细胞数的平均值。
2.5.2Western blotting测定 将样品放入4 ℃预冷处理后的匀浆器,以PBS匀浆至清澈后去除上清液,加入裂解缓冲液裂解约40 min后,离心15 min(12 000 r/min)取上清分装。以BCA试剂盒测定蛋白质含量。于提取的蛋白样品中加入等体积2×loading buffer混匀。变性处理(100 ℃沸水中煮3 min)后置于-80 ℃冰箱保存备用。用12% SDS聚丙烯酰胺凝胶电泳分离蛋白质,HSP70、PKB和P53蛋白分别按每孔蛋白上样量为50 μg、30 μg和20 μg,以积层胶80 V、分离胶120 V恒压分别电泳,待溴酚蓝移至胶底部后终止电泳。以甲醇将PVDF膜激活1 min后转膜,300 mA恒流转膜2.5 h(4 ℃),将凝胶上蛋白质移至PVDF膜上。待转膜结束后,以TBST脱脂奶粉(5%)封闭液封闭PVDF膜2 h后,加入相应兔抗HSP70、PKB和P53多克隆抗体(1∶1 000) 、β-actin (1∶600) 4 ℃过夜。用5%TBST洗涤3次(15 min×1次,10 min×2次),Ⅱ抗以生物素标记羊抗兔IgG(1∶2 000)孵育1 h,再以5%TBST洗3次(每次5 min),经ECL 发光试剂盒显影,X射线底片曝光。以β-actin为内参照。实验重复6次后,将蛋白印迹显影图像扫描。用Quantity One软件半定量分析,用相应蛋白灰度值与内参照β-actin灰度值比值表示各组样品相应蛋白的表达水平。
3统计学处理
结 果
1AP对RMCAO大鼠神经功能缺损的影响
除SOG外,各大鼠麻醉清醒后均出现不同程度的神经功能缺损症状。表现为:左侧肢体无力,行走时左倾斜或左转圈,少数出现意识障碍,不能行走;右侧眼裂变窄,瞳孔缩小(Horner’s征阳性);提尾时左前肢活动障碍,左前爪不能全伸展,有的后肢屈曲。随给药时间的变化,大鼠神经功能缺损也随之变化。术后1 d、3 d和7 d,H-APTG神经功能缺损评分显著低于其它各组(P<0.05或P<0.01);术后3 d和7 d,L-APTG神经功能缺损评分显著低于MG(P<0.05),表明AP对脑缺血再灌注引起的脑神经功能缺损有改善作用,而且呈剂量依赖性,见表1。
表1AP对RMCAO大鼠神经功能评分的影响


Groupn30min1d3d7dSOG90000MG82.53±0.522.48±0.362.36±0.541.97±0.18L-APTG82.68±0.682.29±0.532.07±0.61∗1.46±0.24∗H-APTG82.57±0.492.12±0.39∗1.62±0.43∗△1.03±0.17∗△
*P<0.05vsMG and SOG;△P<0.05vsL-APTG.
2术后7dAP对RMCAO大鼠大脑皮质病理学变化的影响
2.1HE染色观察结果 术后7 d,MG大脑皮质神经纤维仍有大量空泡,部分变性坏死的神经细胞被吸收,很多细胞着色变浅,排列紊乱,部分细胞膜与周围融合,多数细胞核固缩,核仁几乎全部消失,梗死灶的外周可见大量凋亡的细胞和皱缩的细胞浆,细胞核明显固缩集边;与MG相比,L-APTG病理改变明显减轻,大脑皮质仅见少量散在的神经纤维空泡,明显少于MG,其散乱的细胞排列、水肿的组织、暗淡的着色、缩小的细胞以及固缩的细胞核数量显著少于MG,而多于H-APTG,见图1。

Figure 1. Effects ofAstragaluspolysaccharide on histopathological changes of cerebral cortex in rats (HE staining,×200).
图1AP对大鼠大脑皮质病理学改变的影响
2.2透射电镜观察结果 术后7 d,MG大脑皮质细胞膜模糊,细胞浆内可见大量空泡;细胞核皱缩成马蹄形或分叶状,所有染色质凝聚成各种形态,附于核膜外周,染色加深;细胞内的细胞器明显变形、减少或消失,网状结构模糊或缺失;可见气球样肿胀的线粒体,嵴少甚至缺失;粗面内质网几乎消失,质膜结构模糊不清或不连续,甚至消失;L-APTG大脑皮质细胞膜大多模糊不清,细胞浆内可见部分空泡;部分细胞核皱缩,多数染色质凝聚成多种形态,染色较MG变浅;细胞内的细胞器部分变形或减少,网状结构不明显而且较模糊;可见轻微肿胀的线粒体,嵴少散在;粗面内质网尚存,质膜结构稍模糊。H-APTG大脑皮质细胞膜较清晰,细胞浆内未见空泡;胞浆轻微浓缩,细胞膜、细胞器膜和核膜均完整;少数细胞核皱缩,仅见细胞核少数常染色质固缩不规则,疏松,罕见染色质凝聚,染色深度接近SOG;细胞内的细胞器近乎完整清晰,网状结构较明显;线粒体无明显肿胀,呈圆或卵圆形,嵴多而清晰,近于SOG;粗面内质网、核糖体和质膜结构较完整,核糖体肿胀不明显,少数溶解;胞浆蛋白与核蛋白成分较SOG略为松散,见图2。
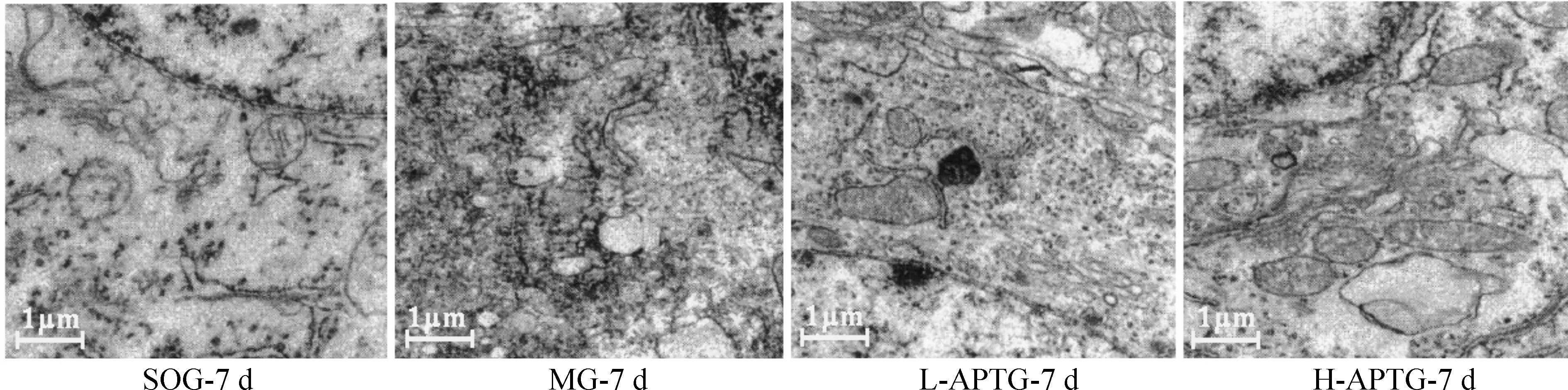
Figure 2. Effects ofAstragaluspolysaccharide on neuronal ultrastructure of cerebral cortical neurons after right middle cerebral artery occlusion in rats (transmission electron microscopy,×16 500).
图2AP对RMCAO大鼠大脑皮质神经元超微结构的影响
3AP对RMCAO大鼠大脑皮质神经元凋亡率的影响
流式细胞术分析结果显示,各时点的细胞凋亡率SOG显著低于其它各组(P<0.05);术后1 d,MG与L-APTG相当(P>0.05),而H-APTG显著低于MG(P<0.05);术后3 d和7 d,L-APTG显著低于MG(P<0.05),而H-APTG又显著低于L-APTG和MG(P<0.05),显示AP有明显抗RMCAO大鼠大脑皮质神经元凋亡作用,而且呈现剂量依赖趋势,见图3、表2。
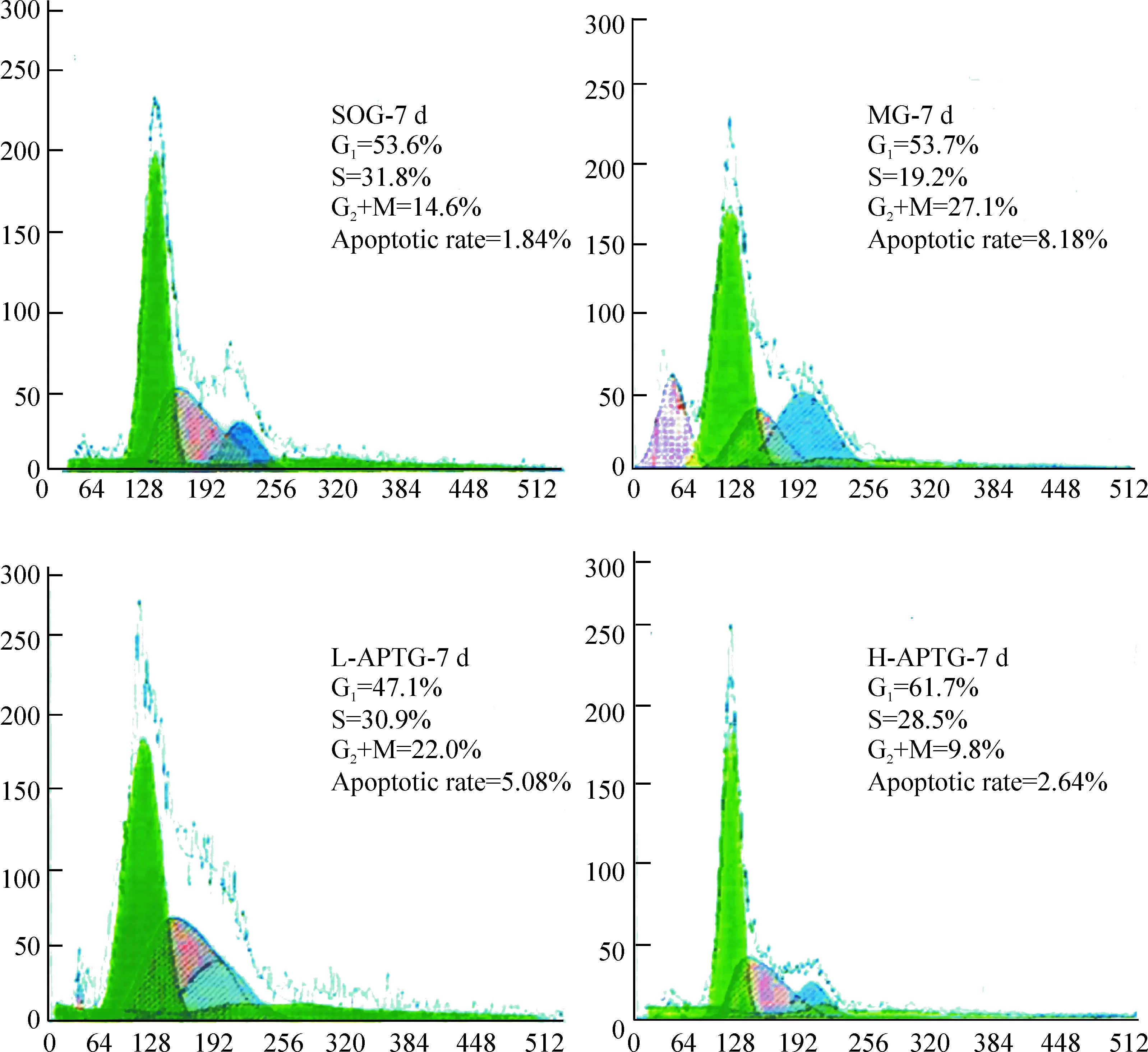
Figure 3. Effects ofAstragaluspolysaccharide on apoptotic rate of cerebral cortical neurons after right middle cerebral artery occlusion in rats.
图3AP对RMCAO大鼠大脑皮质神经元凋亡率的影响
表2AP对RMCAO大鼠大脑皮质神经元凋亡率的影响


Groupn1d3d7dSOG91.78±0.031.96±0.061.84±0.08MG89.73±0.49∗8.83±0.63∗8.18±0.71∗L-APTG88.97±0.67∗6.56±0.33∗▲5.08±0.45∗▲H-APTG87.84±0.35∗▲5.01±0.51∗△▲2.64±0.63∗△▲
*P<0.05vsSOG;△P<0.05vsL-APTG;▲P<0.05vsMG.
4AP对RMCAO大鼠大脑皮质神经元HSP70表达的影响
在各时点,SOG的HSP70表达无显著变化,其它各组在术后HSP70表达先升高,然后逐渐减低;在各个时点,SOG显著低于其它各组(P<0.05),L-APTG和H-APTG显著高于MG,而H-APTG又显著高于L-APTG(P<0.05),表明AP呈剂量依赖性促进或维持HSP70的表达,见图4、表3。
Figure 4. Effects ofAstragaluspolysaccharide on HSP70 expression in cerebral cortical neurons after right middle cerebral artery occlusion in rats (SABC,×400).
图4AP对RMCAO大鼠大脑皮质神经元HSP70表达的影响
表3AP对RMCAO大鼠大脑皮质神经元HSP70表达的影响


Groupn1d3d7dSOG92.23±0.612.17±0.462.72±0.65MG827.34±3.56∗22.86±4.74∗19.89±2.57∗L-APTG834.78±5.32∗27.53±3.42∗▲25.63±4.57∗H-APTG839.76±4.36∗△▲36.74±5.69∗△▲34.51±3.74∗△▲
*P<0.05vsSOG;△P<0.05vsL-APTG;▲P<0.05vsMG.
5AP对RMCAO大鼠大脑皮质神经元PKB蛋白表达的影响
PKB蛋白表达结果显示,在各时点,SOG无显著变化,显著低于其它各组(P<0.05);随时间推移,MG、L-APTG与H-APTG的PKB蛋白表达呈现持续小幅度增加,3组之间有显著差异,显示MG 图5AP对RMCAO大鼠大脑皮质神经元PKB蛋白表达的影响 Figure 6. Effects ofAstragaluspolysaccharide on PKB protein expression in cerebral cortical neurons after right middle cerebral artery occlusion in rats(SABC,×400). 图6AP对RMCAO大鼠大脑皮质神经元PKB蛋白表达的影响 6AP对RMCAO大鼠大脑皮质神经元P53蛋白表达的影响 在各时点,SOG P53蛋白表达无显著变化,显著低于其它各组(P<0.05);随时间推移,MG、L-APTG与H-APTG P53蛋白表达呈现持续降低,3组之间差异显著,为MG>L-APTG>H-APTG(P<0.05)。免疫组化切片染色也显示相似结果。这表明脑缺血再灌注导致大鼠脑损伤,AP能抑制大脑皮质神经元P53蛋白表达,且剂量越大,这种抑制作用越强,见图7、8。 图7AP对RMCAO大鼠大脑皮质神经元P53蛋白表达的影响 Figure 8. Effects ofAstragaluspolysaccharide on P53 protein expression in cerebral cortical neurons after right middle cerebral artery occlusion in rats(SABC,×400). 图8AP对RMCAO大鼠大脑皮质神经元P53蛋白表达的影响 大脑皮质神经元对缺血缺氧性损害很敏感,若脑缺血使得脑能量代谢障碍,直接导致神经元内外离子的平衡失调,大量Na+、Ca2+积聚于神经元内,引起神经元水肿,甚至破裂[5-6],随即发生皮质神经元的凋亡。当缺血损伤消除后,损伤神经元逐渐修复与再生,其修复与再生过程伴随相关蛋白的表达(c-Fos,Bcl-2,P53,PKB,HSP70)而调控着神经元的修复与再生[7]。使用有效药物干预这些相关蛋白的表达,是促进损伤神经元修复与再生的基础。AP是从中药黄芪(Astragalusmongholicus)中提取的多糖类物质,有保护脑组织、延缓衰老、抗氧化、改善细胞代谢以及调节免疫等多重药理作用[8]。本研究结果发现,通过下列因素发挥对脑的保护作用,表现为呈剂量依赖性降低缺血再灌注导致的脑损伤大鼠的神经功能评分,减轻神经组织的水肿,阻止神经元胞核的固缩,降低神经元的凋亡率,延缓神经元胞浆的浓缩进程,阻止神经元胞核的皱缩和线粒体的肿胀,维持神经元内细胞器结构的完整性,降低神经元凋亡率。其作用机制可能与下列因素有关。 1诱导大脑皮质神经元HSP70表达,阻止神经元自杀途径的开启,增强神经元对缺血再灌注的耐受性,减少神经元凋亡 中枢神经的HSP70是抗凋亡蛋白,通过热休克反应能保护或减轻神经细胞的损伤[9]。其主要功能是:直接保护神经元,启动产生其它保护机制;增强神经元对应激原的耐受性;应激状态下维持神经元内蛋白的自稳,结合变性蛋白,防止变性蛋白进一步折叠而失去功能;转运细胞内新合成蛋白质,迅速清除和恢复受损蛋白质,以维持细胞的正常生存;调节神经元细胞周期;充当分子伴侣,参与调节免疫[10]。脑缺血可引起热休克反应,增强HSP70表达,阻止神经元开启自杀途径,减轻神经元凋亡[7]。有研究发现,HSP70抑制剂能加速脑缺血后神经元的凋亡进程[8]。本实验结果显示,在脑缺血后1 d、3 d和7 d,假手术组HSP70表达显著低于其它各组(P<0.05),低剂量和高剂量AP治疗组显著高于模型对照组,而高剂量AP治疗组又显著高于低剂量AP治疗组(P<0.05),表明AP呈剂量依赖性促进或维持HSP70的表达。这有助于保护缺血引起的神经元损伤,增加脑组织的修复与再生能力,提示AP增强脑缺血神经功能的机制,与诱导神经元HSP70的表达而保护神经元、阻止神经元凋亡有关。 2激活脑皮质神经元PKB蛋白表达,阻止神经元凋亡,增强神经元的生存功能 PKB(Akt)是存在于神经细胞的一种苏氨酸/丝氨酸蛋白激酶,其Thr308和Ser473位点能在PI3K作用下磷酸化而激活,随即发挥抗细胞凋亡、促细胞生存等多种生物效应[7]。研究已经证实,激活的PKB作用于多种底物(forkhead转录因子、eNOS、GsK-3、BAD、CREB、caspase-9等)或下游环节而促进神经细胞生存[8]。短暂脑缺血早期,相对损伤较轻部位(大脑皮质)磷酸化的PKB表达也相对增加,这种脑缺血早期的特殊保护反应,与促进神经细胞存活有关[1,10]。有研究发现,短暂全脑缺血早期阶段,缺血损伤相对较轻的部位(如大脑皮质区)磷酸化PKB表达增高[9]。沙土鼠全脑缺血再灌注模型实验发现,磷酸化的PKB核表达明显增加,表明PKB的激活与增强脑缺血的耐受性有关[3,9]。以上事实说明,脑缺血早期PKB的激活是机体对脑缺血的一种保护性反映,与促进细胞存活有关。本实验结果显示,在脑缺血后1 d、3 d和7 d,假手术组PKB蛋白表达少于模型对照组(P<0.05),表明脑缺血可以诱导PKB蛋白表达。低剂量和高剂量AP治疗组PKB蛋白表达显著高于模型对照组,而高剂量AP治疗组又显著高于低剂量AP治疗组(P<0.05),表明AP呈剂量依赖性加快并维持脑缺血再灌注大鼠脑皮质神经元PKB蛋白高水平表达。这提示AP抗脑缺血再灌注神经损伤的机制与促进PKB蛋白的表达和细胞存活有关。 3抑制脑皮质神经元P53蛋白表达,从而阻止其下游基因介导的凋亡基因的表达 脑缺血再灌注导致神经元凋亡的关键环节受凋亡基因p53的调控,是诱导脑缺血再灌注神经元凋亡的主要因素[8-9]。P53在正常组织中的表达极低,这对阻止基因突变和稳定染色体DNA具有重要意义[9-10]。如果DNA受到外来影响(辐射、缺氧、缺血等),作为转录因子的P53可诱导下游基因表达,导致细胞凋亡或细胞周期停滞[9]。有研究证实,脑缺血可增加P53表达,P53表达抑制剂具有保护脑组织作用[8]。P53还能减少Bcl-2蛋白(抗细胞凋亡蛋白)表达,增强Bax蛋白(促细胞凋亡蛋白)表达,并调节 Bax、caspase等系列下游基因而促进神经细胞凋亡[10]。因此,p53基因具有促进神经细胞凋亡作用。本实验结果显示,在脑缺血后1 d、3 d和7 d,假手术组P53蛋白表达低于其它各组(P<0.05),模型对照组显著高于低剂量AP治疗组,而低剂量AP治疗组又显著高于高剂量AP治疗组(P<0.05),表明AP呈剂量依赖性抑制脑缺血再灌注大鼠脑皮质神经元P53蛋白的表达。这提示AP抗脑缺血再灌注神经损伤的机制与抑制P53蛋白表达相关。 [1] 颜 玲,黄德斌.黄芪多糖对缺血脑损伤大鼠海马神经递质及c-fos mRNA表达的影响[J].中国病理生理杂志,2012,28(2):263-268. [2] Jin R, Jiang XY,Ma X, et al.Effect of gamma-hydroxybutyric acid receptor on focal cerebral ischemia-reperfusion injury in rats [J].Acta Pharm Sin,2007,42(8):838-842. [3] 李 花,邓常清,陈北阳,等.三七总皂苷对大鼠脑缺血再灌注后Caspase表达的影响[J].中国药理学通报,2006,22(2):189-193. [4] 黄德斌,董 志. 尼莫地平对缺血性脑损伤大鼠神经细胞黏附分子表达的影响[J]. 中国药理学通报,2008,24(5):640-643. [5] Hou XY,Zhang GY,Yan JZ, et al.Activation of NMDA receptors and L-type voltage-gated calcium channels mediates enhanced formation of fyn-PSD95-NR2A complex after transient brain ischemia[J].Brain Res,2002,955(1-2):123-132. [6] 汤 諹,李树清,李 凡,等.缺血后适应对树鼩海马CA1区神经元Akt信号转导调控的机制研究[J].中国病理生理杂志,2011,27(3):560-565. [7] Chung YH,Shin CM,Kim MJ, et al.Enhanced expression of L-type Ca2+channels in reactive astrocytes after ischemic injury in rats[J].Neurosci Lett,2001,302(2-3):93-96. [8] 焦俊霞,高维娟,钱 涛,等.黄芪有效成分对缺氧缺糖/复氧复糖大鼠海马神经元cyt-c、CcO表达的影响[J].中国药理学通报,2011,27(2):211-215. [9] 焦俊霞,高维娟,李玉明,等.黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元Bcl-2和Bax表达的影响[J].中国病理生理杂志,2011,27(5):905-910. [10]苏 方,张 培,姜治伟,等.海马神经元缺血/再灌注后自噬的表达及其作用[J].中国应用生理学杂志,2011,27 (2):187-190. EffectsofAstragaluspolysaccharideonexpressionofHSP70,PKBandP53inratcerebralcortexwithcerebralischemiaandreperfusion YAN Ling1, HUANG De-bin1, LIU Jin-hong1, ZHOU Qing-hua2 (1MedicalCollegeofHubeiUniversityforNationalities,Enshi445000,China;2MedicalCollegeofJingchuUniversityofTechnology,Jingzhou434000,China.E-mail:hdb66910@163.com) AIM: To explore the molecular effects ofAstragaluspolysaccharide (AP) on improving nervous functions and preventing neuronal apoptosis in rat cerebral cortex with cerebral ischemia and reperfusion.METHODSOne hundred and twenty male Wister rats were randomly divided into sham operation group (SOG), model groups (MG-1 d, 3 d and 7 d), low-dose AP treatment groups (L-APTG-1 d, 3 d and 7 d), and high-dose AP treatment groups (H-APTG-1 d, 3 d and 7 d). The right middle cerebral artery of the rats in MG and AGTG was intercepted by operation to induce ischemic brain injury. The rats in L-APTG and H-APTG were treated with AP at the doses of 5 mg/kg and 15 mg/kg by intraperitoneal injection, respectively. On the 1st day, 3rd day and 7th day after operation, those animals were sacrificed to collect the brain specimens for the study after cerebral blood flow reperfusion and determination of neurological deficit scores. The structural changes of the neurons were observed under electron microscope. Apoptosis was analyzed by flow cytometry. The protein levels of heat-shock protein 70 (HSP70), protein kinase B (PKB) and P53 in cerebral corical neurons were determined by immunohistochemical staining and Western blotting.RESULTSThe neurological deficit scores and the apoptotic rate of cerebral cortical neurons in H-APTG were significantly lower than those in MG and L-APTG (P<0.05). The structures of the neurons in H-APTG, such as ribosome endoplasmic reticulum, nucleolus, Golgi complex, mitochondria, etc, were better than those in MG and L-APTG. On the 1st day, 3rd day and 7th day, the protein levels of HSP70 and PKB in cerebral cortical neurons in H-APTG were significantly higher than those in L-APTG, which were significantly higher than those in MG (P<0.05). However, the P53 protein level in H-APTG was significantly lower than that in L-APTG, which was significantly lower than that in MG (P<0.05).CONCLUSIONAP improves nervous functions and inhibits neuronal apoptosis during ischemia and reperfusion. The molecular mechanisms are associated with variations of protein expression in cerebral cortical neurons, such as promotion of HSP70 and PKB and inhibition of P53. Brain ischemia reperfusion;Astragaluspolysaccharide; Cerebral cortex; Heat-shock protein 70; Protein kinase B; Tumor suppressor protein P53 R363 A 10.3969/j.issn.1000-4718.2012.09.013





讨 论
