左归丸含药血清通过ERK/TGF-β/Smads信号级联调控MC3T3-E1细胞增殖与分化*
2012-11-06蒿长英任艳玲刘立萍王智民
蒿长英, 任艳玲△, 刘立萍, 宋 囡, 王智民
(辽宁中医药大学 1基础医学院,2附属第二医院,3第一临床学院,辽宁 沈阳 110032)
1000-4718(2012)09-1670-06
2012-04-18
2012-07-20
国家自然科学基金资助项目(No.30873226);教育部高等学校博士学科点专项科研基金资助项目(No.20102133110001);辽宁省高等学校优秀人才支持计划资助项目(No.LR201025)
△通讯作者 Tel: 024-31207267; E-mail: yanlingren@tom.com
左归丸含药血清通过ERK/TGF-β/Smads信号级联调控MC3T3-E1细胞增殖与分化*
蒿长英1, 任艳玲1△, 刘立萍1, 宋 囡2, 王智民3
(辽宁中医药大学1基础医学院,2附属第二医院,3第一临床学院,辽宁 沈阳 110032)
目的研究细胞外信号调节激酶(ERK)/转化生长因子β(TGF-β)/Sma和Mad相关蛋白(Smads)信号级联在左归丸含药血清干预成骨前体细胞系MC3T3-E1细胞增殖与分化中的作用。方法以倍美力为阳性对照药,对Sprague-Dawley (SD)雌性大鼠灌服高、中、低剂量的左归丸混悬液,7 d后腹主动脉取血分离含药血清。采用噻唑蓝(MTT)法检测左归丸含药血清对MC3T3-E1细胞的增殖作用,采用改良钙钴染色法检测碱性磷酸酶(ALP)表达,采用茜素红染色法检测钙化结节,采用Western blotting法检测核结合因子α1(Cbfα1)和Ⅰ型胶原(ColⅠ)蛋白表达,采用real-time RT-PCR法检测TGF-β1、Smad4和Smad2 mRNA表达。结果左归丸含药血清对MC3T3-E1细胞的促增殖作用呈剂量和时间相关性,其中以低剂量且体积分数为15%作用48 h后对MC3T3-E1的促增殖作用最大;左归丸含药血清能促进MC3T3-E1细胞ALP表达,增强细胞基质钙化,提高Cbfα1和ColⅠ蛋白分泌,上调TGF-β1、Smad4和Smad2 mRNA表达;加入ERK1/2信号通路特异性阻滞剂PD98059后,MC3T3-E1细胞增殖降低,ALP表达下降,细胞基质钙化减弱,Cbfα1和ColⅠ蛋白分泌降低,Smad4和Smad2 mRNA表达下调,TGF-β1mRNA表达进一步上调。结论左归丸可能通过干预ERK/TGF-β/Smads信号级联而调控成骨细胞的增殖和分化,这可能是其防治骨质疏松症的机制之一。
左归丸; 细胞外信号调节激酶类; 转化生长因子β; Smad蛋白类; MC3T3-E1细胞
细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)以及Sma和Mad相关蛋白(Sma-and Mad-related proteins,Smads)在信号网中发挥基本的作用。ERK以一种调控的方式使细胞外信号转变为细胞质或细胞核信号,激活特异的靶点和基因过程[1]。相比其它组织,转化生长因子β(transforming growth factor β,TGF-β)在骨基质中最丰富,以非活化的形式存在,从骨基质释放,在骨微环境中被激活;其由成骨细胞(osteoblast, OB)分泌,以多种形式调控骨代谢,诱导骨骼发育和骨重建[2]。Smad2/3蛋白为转录因子,与通用型Smad4蛋白结合形成异源三聚体,将TGF-β超家族[包括骨形成蛋白4(bone marphogenic protein4,BMP-4)]激活的细胞外信号转导进入细胞核以调控目的基因转录[3]。前期研究显示,补肾健脾和补肾益气生精中药可以从蛋白及mRNA水平提高大鼠OB或骨组织中的TGF-β1及其信号转导分子 Smad2和Smad4表达。买霞等[4]研究发现,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF) 可活化 Ras/ERK 信号转导通路,促进骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs) 向OB分化。本文拟探讨左归丸含药血清对小鼠成骨前体细胞系MC3T3-E1细胞ERK1/2和TGF-β1/Smads信号通路的干预作用,以期明确左归丸治疗骨质疏松症的机制。
材 料 和 方 法
1材料
SD雌性大鼠SPF级,180~200 g,购于上海西普尔-必凯实验动物有限公司,许可证号为SCXK(沪)2008-0016。小鼠成骨前体细胞系MC3T3-E1 Subclone 14购于中科院上海细胞库。
2药物、主要试剂及仪器
左归丸(上海雷允上封浜);倍美力(Premarin,BML)结合雌激素片(爱尔兰惠氏药厂);改良型α-MEM培养液和胎牛血清(fetal bovine serum,FBS)(HyClone);胰酶、MTT、PD98059(ERK1/2信号通路特异性阻滞剂)、茜素红 (Sigma);兔抗核结合因子α1(core binding factor α1,Cbfα1)抗体和兔抗I型胶原(collagenⅠ,Col I)抗体(Abcam);ECL发光液(Pierce);real time RT-PCR试剂盒(TaKaRa);引物委托TaKaRa公司设计合成,具体信息见表1。3111型CO2培养箱(Thermo);HFsafe-1200型生物安全柜(上海力申);DFC320型倒置显微镜(Leica);Western blotting系统(Bio-Rad);BioSpec-nano型紫外可见分光光度计 (岛津);iMark型酶标仪(Bio-Rad);Mx3000P型real-time PCR仪(Agilent)。
3主要方法
3.1含药血清的制备 将大鼠随机分为5组:空白对照组(control)30 只、左归丸高、中、低剂量组[ZG(H、M、L)]各31只和倍美力组(BML)31只。大鼠左归丸的等临床剂量为1.6 g·kg-1,此设为ZG(L),以其2倍为ZG(M),4倍为ZG(H);BML组给予结合雌激素56.25 μg·kg-1;control组灌服蒸馏水10 mL·kg-1。药物制成混悬液,每天2 次灌服,持续灌胃7 d。于第8 d给药2 h后,10%水合氯醛腹腔注射麻醉,腹主动脉取血,室温静置2 h,2 500 r/min 4 ℃离心20 min,收集血清,同组混匀,56 ℃水浴灭活30 min,过滤除菌,分装,-86 ℃保存。
3.2左归丸含药血清有效作用浓度和时间的筛选 MC3T3-E1细胞第3 代经胰酶消化,用含10%(V/V)FBS的基础培养液(含1×105U·L-1青霉素、100 mg·L-1硫酸链霉素的α-MEM培养液)稀释成2×108L-1的细胞悬液,以每孔200 μL接种于96孔培养板,调零孔不加细胞,24 h后换用含0.2%(V/V)FBS的基础培养液;24 h后换用含10%、15%或20%各组含药血清的基础培养液100 μL,每一浓度8复孔,继续培养24、48、72或96 h。每孔加入5 g·L-1的MTT溶液10 μL,培养箱内孵育4 h后,弃孵育液,每孔加入100 μL DMSO,振荡混匀15 min。待沉淀完全溶解后,酶标仪上490 nm测定吸光度(A)值。
3.3实验分组及药物干预 细胞随机分为control组、PD98059(PD)组、ZG(L)组、ZG(L)+PD98059组、BML组和BML+PD98059组。MC3T3-E1细胞经胰酶消化,用含10%(V/V) FBS的基础培养液稀释成2×108L-1的细胞悬液,接种。24 h后换含0.2%(V/V) FBS的基础培养液饥饿培养,使细胞同步化;24 h后换用含或不含10 μmol/L PD98059(溶于DMSO,DMSO体积浓度≤0.0001,-20 ℃避光保存)的基础培养液,预孵育30 min后加入各组含药血清,继续培养。每3 d换1次液。
3.4改良钙钴法检测MC3T3-E1细胞碱性磷酸酶(alkaline phosphatase,ALP)表达 ALP染色孵育液由3%β-甘油磷酸钠、2%巴比妥钠、2%无水氯化钙、2%硫酸镁和蒸馏水5 mL组成(pH 9.4)。ALP阴性对照液不含β-甘油磷酸钠。MC3T3-E1细胞以每孔500 μL接种于24孔培养板,药物干预14 d后,弃原培养液,95%乙醇固定15 min,干燥;加入新鲜配制的孵育液,于37 ℃恒温培养箱内孵育4 h;流水洗10 min;2%硝酸钴作用5 min;蒸馏水洗片刻;1%硫化铵水溶液(现配用)处理1 min;蒸馏水冲洗。晾干,显微镜下拍照(10×20)。
3.5茜素红染色法检测MC3T3-E1细胞钙化结节 0.1%茜素红溶液:茜素红100 mg,Tris-HCl (pH 8.3) 100 mL;混匀,充分溶解,4 ℃避光保存。MC3T3-E1细胞以每孔1 000 μL接种于24孔培养板,药物干预14 d后,弃原培养液,PBS洗2次;95%乙醇固定10 min;PBS洗3次;0.1%茜素红-Tris-HCl(pH 8.3) 37℃孵育30 min;自来水冲洗,室温干燥。在低倍镜视野(4×10)下拍照。
3.6MC3T3-E1细胞ColⅠ和Cbfα1蛋白表达检测 MC3T3-E1细胞第6代以每瓶3×106接种于25 cm2培养瓶,药物干预48 h后弃原培养液,蛋白提取试剂提取总蛋白,4 ℃ 12 000×g离心10 min,取上清;BCA试剂盒测定蛋白浓度;与5×SDS上样缓冲液100 ℃煮沸5 min,60 μg/well加入12%SDS-PAGE凝胶中,电泳,转膜3 h,5%质量浓度的脱脂奶粉37 ℃封闭1 h,Ⅰ抗4 ℃孵育过夜,TBST洗3次,Ⅱ抗37 ℃孵育2 h,TBST洗4次,暗室中ECL发光并用X胶片曝光,胶片扫描并分析结果。
3.7TGF-β1、Smad4、Smad2 mRNA表达 RNAiso Plus试剂盒提取细胞总RNA,吸光度测定方法检测RNA质量。理想的RNA纯度A260/A280应在1.8 ~2.2范围内。基因组DNA去除体系:5 μL 200 mg/L total RNA,2.0 μL 5×gDNA Eraser Buffer,1.0 μL gDNA Eraser,2.0 μL RNase Free dH2O;PCR仪反应:(1)42 ℃ 2 min;(2)4 ℃保存。RT反应体系:去除基因组DNA的总RNA,4 μL 5×PrimeScript Buffer 2(for real time),1 μL PrimeScript RT Enzyme MixⅠ,1 μL RT Primer Mix,RNase Free dH2O 4 μL;PCR仪反应:(1)37 ℃ 15 min;(2)85 ℃ 5 s;(3)4 ℃保存。标准品cDNA 5倍梯度稀释,稀释6个梯度;各组cDNA样品5倍稀释;在每个0.2 mL 8联PCR反应管中加入23 μL PCR反应液[9.5 μL RNase Free dH2O,0.5 μL上游引物,0.5 μL下游引物,12.5 μL SYBR Premix Ex TaqⅡ(2×Tli RNaseH Plus),并在每个反应管中加入2 μL cDNA[negative control(NTC)加2 μL EASY dilution],PCR仪中real-time PCR反应:(1)95 ℃ 2 min;(2)95 ℃ 30 s;60 ℃ 30 s,40个循环。根据NTC反应有无荧光信号检出,并结合熔解曲线确认反应体系是否有污染;标准曲线的相关系数(R2)>0.98;扩增效率(E)应在0.8~1.2范围。采用双标准曲线法换算样品中mRNA含量,再以GAPDH作为内参照计算样品中mRNA相对表达量。

表1 引物序列
4统计学处理
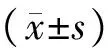
结 果
1左归丸含药血清对MC3T3-E1细胞增殖的影响
体积分数为15%的ZG(H、M、L)含药血清对MC3T3-E1细胞的促增殖作用均明显高于10%和20%的作用。其中,以15%ZG(L)含药血清作用48 h后对MC3T3-E1细胞的促增殖作用最强(P<0.01),且与control组比较有显著差异(P<0.05),与BML组比无显著差异。故采用15%ZG(L)含药血清[以ZG(L)表示]进行细胞干预实验,见图1~3。
2ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞ALP表达的影响
细胞合成的ALP经改良钙钴法染色,呈棕黑色细微颗粒,阴性对照组无棕黑色颗粒。与control组比,ZG(L)含药血清作用于MC3T3-E1细胞14 d后,细胞密度增大,细胞突触多且长,棕黑色颗粒增多。加入PD98059后,各组与未加组比较,细胞突触明显回缩,棕黑色颗粒沉积减少,见图4。
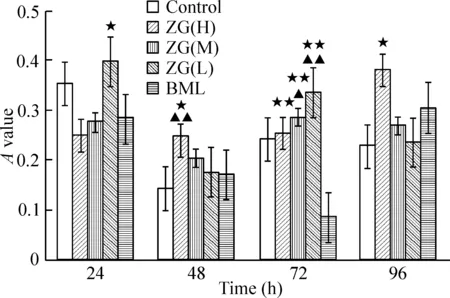

图110%左归丸含药血清对MC3T3-E1细胞增殖的影响
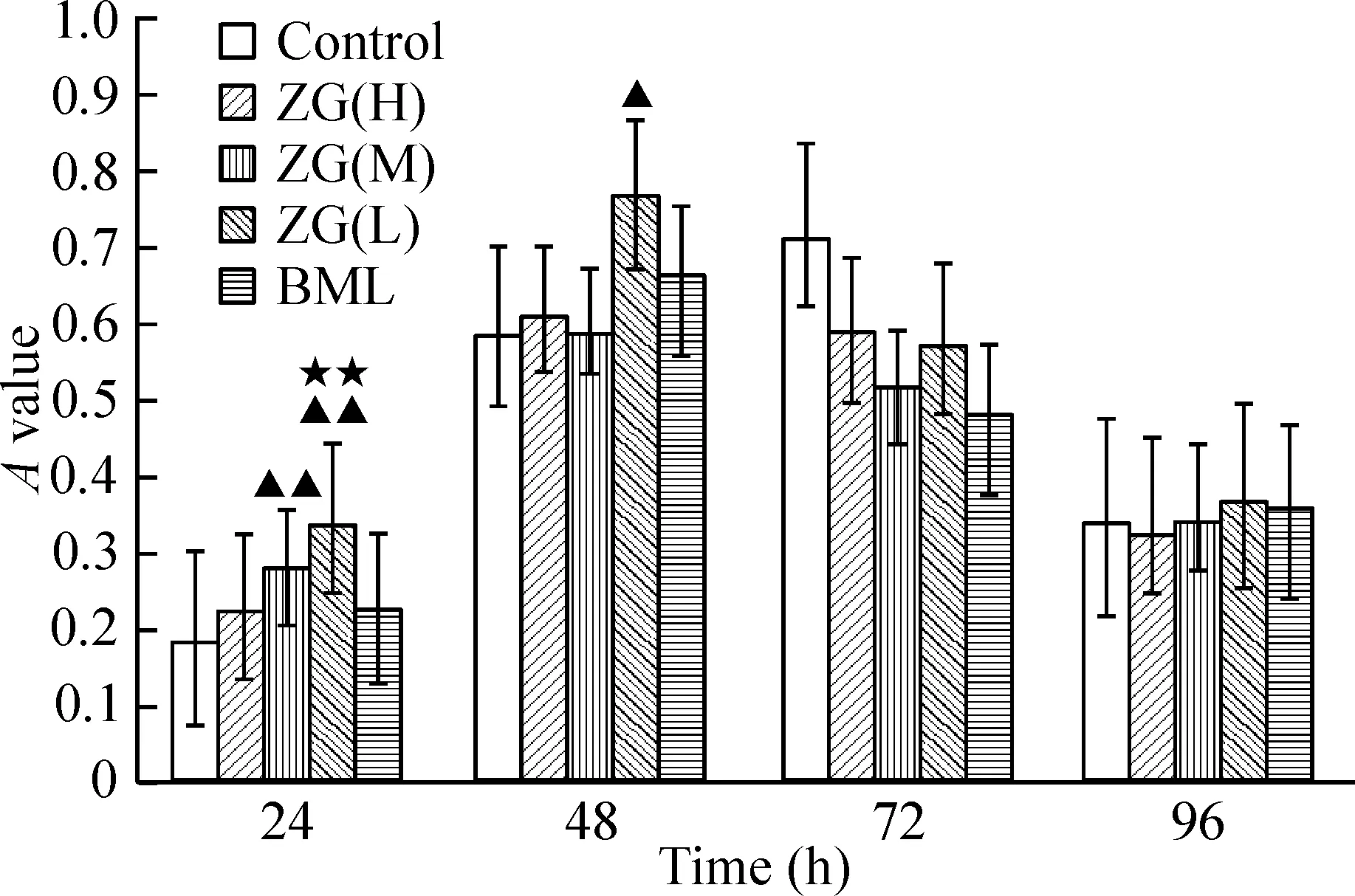
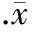
图215%左归丸含药血清对MC3T3-E1细胞增殖的影响
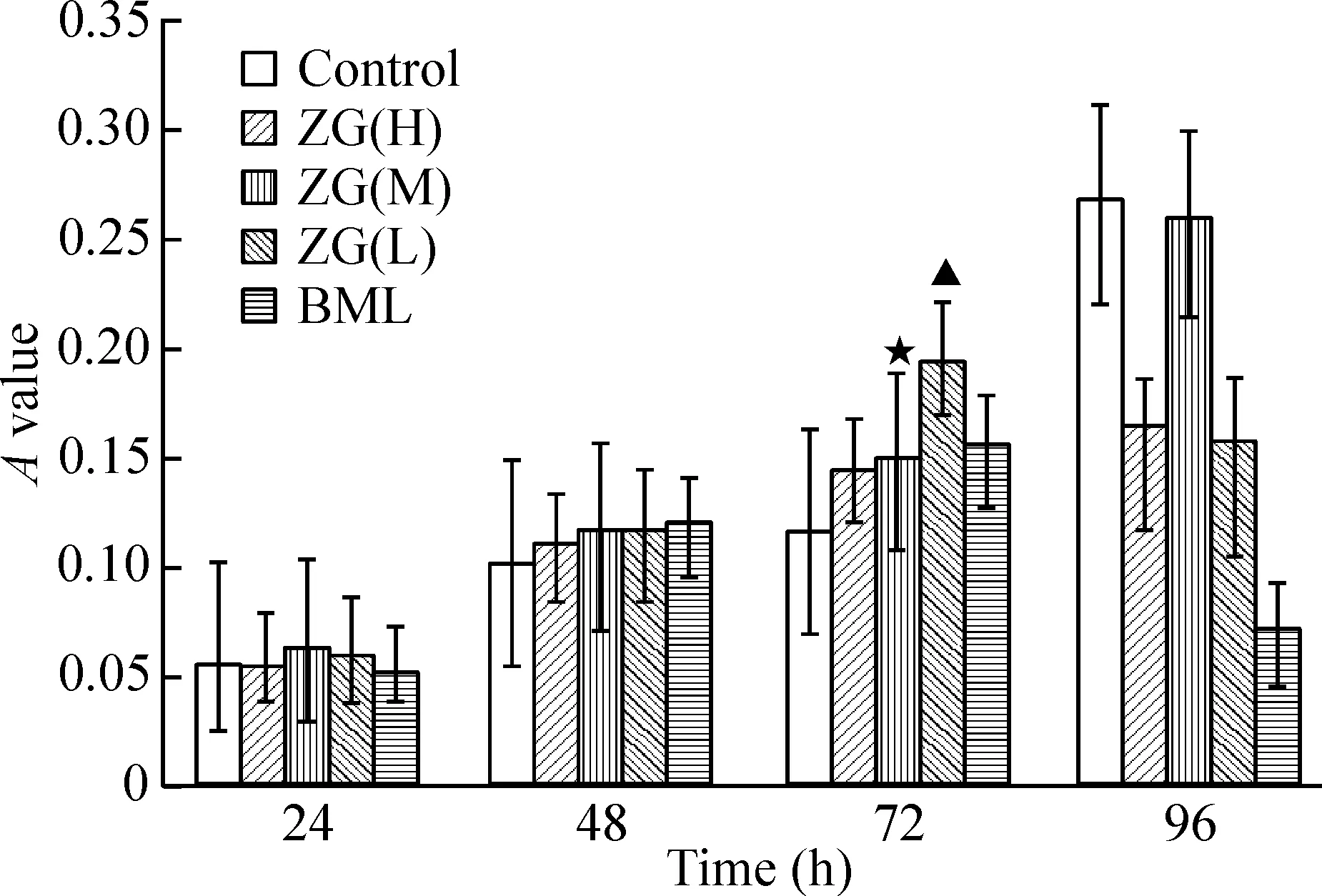

图320%左归丸含药血清对MC3T3-E1细胞增殖的影响

Figure 4. Involvement of ERK1/2 in MC3T3-E1 cell ALP production induced by ZG-medicated serum(×200).A:control;B:PD98059 (PD); C:ZG(L);D:ZG(L)+PD; E:BML; F:BML+PD.
图4ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞ALP表达的影响
3ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞钙化结节的影响
形成的钙化结节经茜素红染色呈红色。与control组比,ZG(L)含药血清作用于MC3T3-E1细胞14 d后,钙化结节明显增多。加入PD98059后,各组与未加组比较,钙化结节明显减少,见图5。
Figure 5. Involvement of ERK1/2 in MC3T3-E1 cell mineralization induced by ZG-medicated serum(×40).A:control;B:PD; C:ZG(L);D:ZG(L)+PD; E:BML; F:BML+PD.
图5ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞钙化结节的影响
4ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞ColⅠ和Cbfα1蛋白表达的影响
与control组比,ZG(L)能明显促进MC3T3-E1细胞ColⅠ和Cbfα1蛋白的表达(P<0.05);加入PD98059后,各组较未加PD98059组比较,ColⅠ和Cbfα1蛋白表达明显下降(P<0.05),见图6、7。
5ERK1/2阻滞剂对左归丸含药血清干预的MC3T3-E1细胞TGF-β1、Smad4和Smad2mRNA表达的影响
与control组比,ZG(L)与BML均能显著上调MC3T3-E1细胞TGF-β1、Smad4和Smad2 mRNA表达(P<0.05或P<0.01);加入PD98059后,ZG(L)及BML组较未加PD98059组比较,Smad4和Smad2 mRNA表达明显下降(P<0.05),TGF-β1mRNA表达进一步上调,且有显著差异(P<0.05),见图8~10。
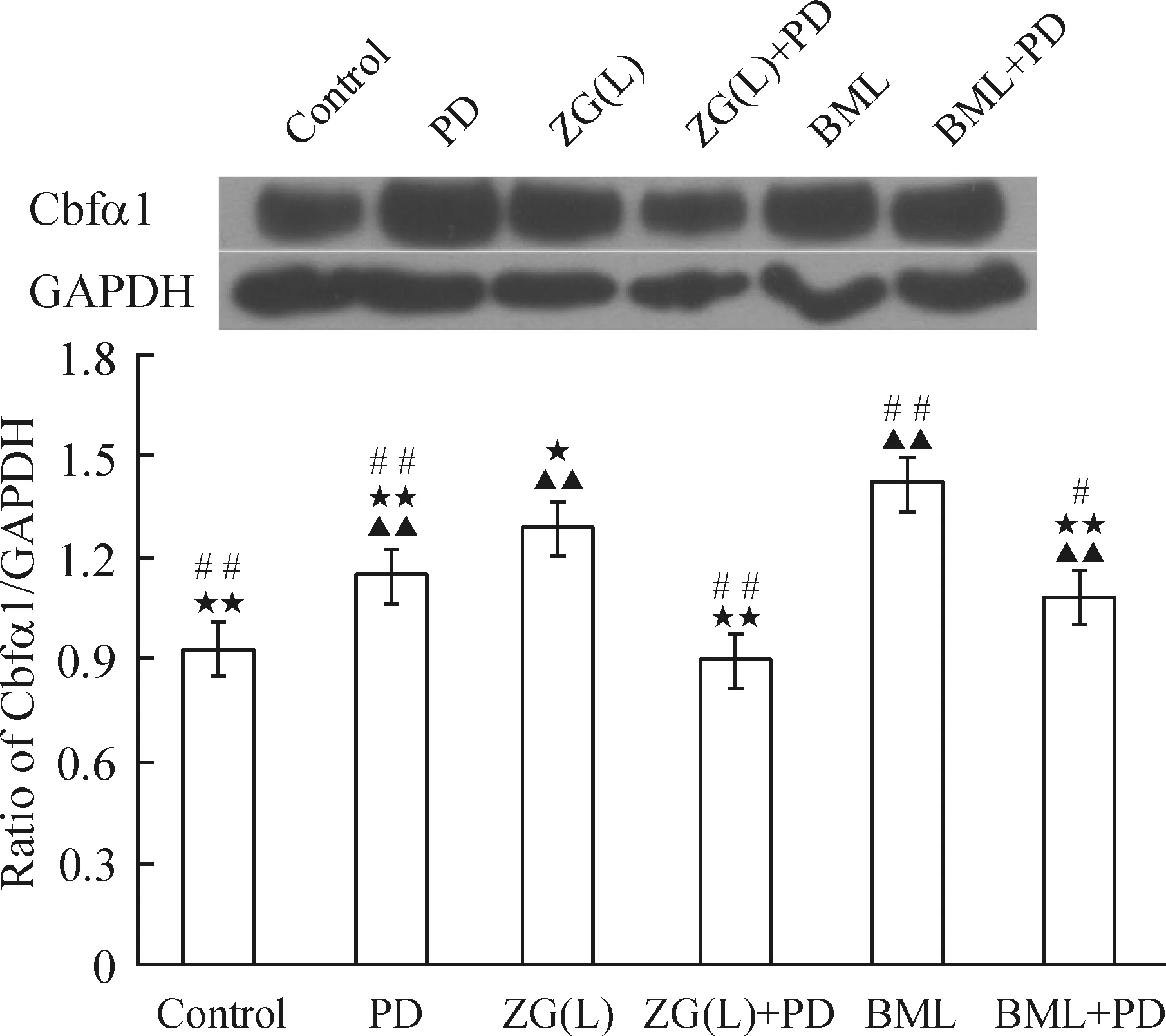

图6ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞Cbfα1蛋白表达的影响
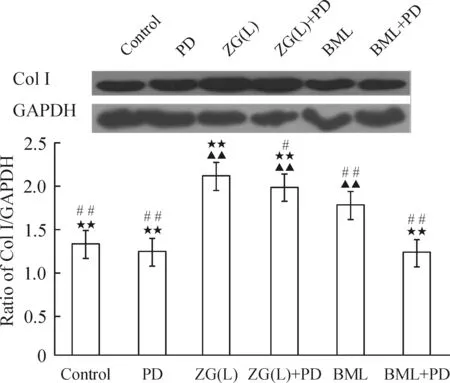

图7ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞ColⅠ蛋白表达的影响
讨 论
1左归丸治疗骨质疏松症的机制
补肾方左归丸始载于明·张介宾《景岳全书·新方八阵·补阵》,能滋肾补阴,用于真阴不足证,症见腰酸膝软、盗汗、神疲口燥。骨质疏松发病的主要原因是雌激素缺乏引发OB的骨形成不足和破骨细胞(osteoclast, OC)的骨吸收亢进导致的骨重建失衡[5]。OB不仅决定骨的形成,同时也调节OC对骨的吸收,是骨代谢的主要功能细胞,OB增殖和分化在很大程度上决定了最终形成的骨量。赵宏艳等[6]通过体外“OC+OB+骨片”共培养的方法,观察大鼠正常组血清、卵巢切除(ovariectomized,OVX)组血清和OVX+左归丸含药血清对共培养体系的影响。其研究结果显示,在OVX状态下,左归丸含药血清对OC有直接抑制作用,且可通过OB介导对OC的抑制作用。吴昆鹏等[7]研究发现,小分子肽可通过增加骨保护素的表达来影响骨保护素/核转录因子κB受体活化因子配体系统,间接抑制OC的数量和功能。本实验结果显示,左归丸含药血清能促进MC3T3-E1细胞增殖,提高ALP活性,增强细胞基质钙化,促进Cbfα1和ColⅠ蛋白分泌,上调TGF-β1、Smad4和Smad2 mRNA表达。由此提示,左归丸可能是通过提高TGF-β1、Smad4和Smad2 mRNA水平而治疗骨质疏松症。
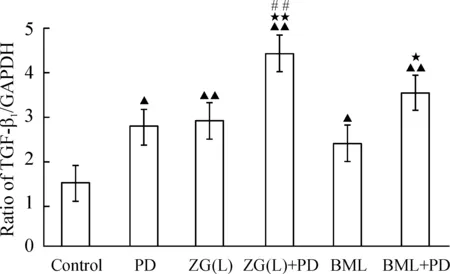

图8ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞TGF-β1mRNA表达的影响


图9ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞Smad4mRNA表达的影响
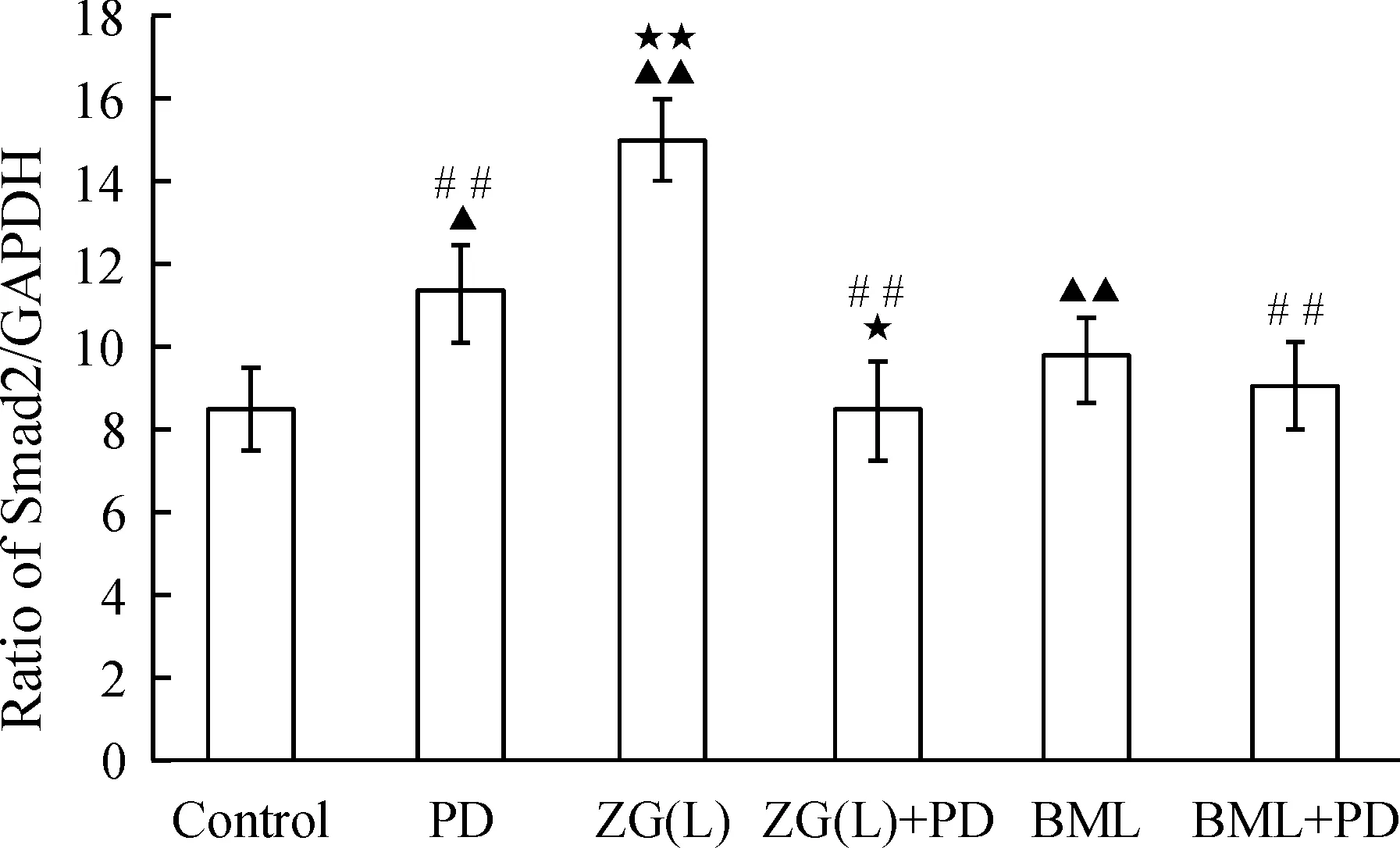

图10ERK1/2信号通路对左归丸含药血清干预的MC3T3-E1细胞Smad2mRNA表达的影响
2ERK1/2和TGF-β1/Smads信号通路在OB中的作用
ERK1/2信号通路主要参与细胞的增殖、转化和存活等过程[8]。近年研究发现,TGF-β能通过激活ERK信号通路在多数细胞效应中发挥作用。Okamoto等[9]研究表明,TGF-β1使ERK和Smad磷酸化,从而诱导人脑膜细胞基质金属蛋白酶9的表达,从而引发脑室内出血后的心室扩张,其中基质金属蛋白酶是水解骨胶原的特异性酶,和组织金属蛋白酶抑制因子的平衡状态调控着骨基质胶原的降解。Cicek等[10]研究发现,TGF-β处理的早期应答基因通过抑制MEK/ERK等信号通路抑制OC生存。Ghayor等[11]揭示,TGF-β通过激活ERK通路促进OB增殖,而这种效应还有赖于蛋白激酶C。朱晓峰等[12]研究MC3T3-E1前体成骨细胞株发现,淫羊藿素可以通过雌激素受体激活BMP/Smad信号通路而促进ALP、ColⅠ和骨钙素的表达。然而,对于在OB中ERK与TGF-β/Smads 级联的研究却少有报道。本实验结果显示,把ERK1/2特异性阻滞剂PD98059加入到左归丸含药血清后,MC3T3-E1细胞的ALP活性降低,钙化减弱,Cbfα1和ColⅠ蛋白分泌下降,Smad2和Smad4 mRNA表达下调,而TGF-β1mRNA表达却进一步上调。尽管大量的文献证实,Smads是TGF-β唯一的信号转导分子,但越来越多的数据暗示,独立的Smad通路也可能存在[11]。也有研究发现,TGF-β对ERK1/2的激活,下调Smads对小鼠OB细胞ALP活性和矿化的诱导[13]。因此,ERK1/2磷酸化水平降低后TGF-β1mRNA表达进一步上调的机制可能是,在左归丸含药血清干预MC3T3-E1细胞48 h的时间里,ERK1/2通过发挥正向调节作用调控Smad2 mRNA和蛋白表达,通过负反馈环路调控TGF-β1mRNA和蛋白表达;也可能是,ERK1/2能激活TGF-β1/smads通路,ERK1/2通路被阻滞后,Smad2(R-Smads)磷酸化降低,致使游离的TGF-β1增多;也可能是ERK1/2非依赖于TGF-β1而激活Smad2以发挥生物学效应。总之,ERK1/2与TGF-β1/Smads在左归丸干预MC3T3-E1细胞中的具体机制还有待于进一步研究,如增加左归丸干预的时点、优化培养条件等。
[1] Kolch W. Coordinating ERK/MAPK signaling through scaffolds and inhibitors[J]. Nat Rev Mol Cell Biol, 2005, 6(11):827-837.
[2] Centrella M, Horowitz MC, Wozney JM, et al. Transforming growth factor-β gene family members and bone[J]. Endocr Rev, 1994,15(1):27-39.
[3] Massagué J, Seoane J, Wotton D. Smad transcription factors[J]. Genes Dev, 2005,19(23):2783-2810.
[4] 买 霞,陈 莉,扎拉嘎胡,等.bFGF 通过上调Ras/ERK 信号通路诱导 BMSCs 表达Ⅰ型胶原[J]. 中国药理学通报,2011,27(3): 1405-1408.
[5] 廖二元,谭利华.代谢性骨病学[M].北京:人民卫生出版社,2003.
[6] 赵宏艳,鞠大宏,刘梅洁,等. 左归丸含药血清对破骨细胞骨吸收功能的影响以及成骨细胞对其的介导作用[J]. 中国中医基础医学杂志, 2006,12(9): 662-664.
[7] 吴昆鹏,杨巧珠,马凤燕,等. 小分子肽对成骨前体细胞MC3T3-E1骨保护素和核转录因子κB受体活化因子配体表达的影响[J]. 中国组织工程研究与临床康复,2011,15(24):4375-4378.
[8] 姜 勇,罗深秋.细胞信号转导的分子基础与功能调控[M].北京:科学出版社,2005.
[9] Okamoto T, Takahashi S, Nakamura E, et al. Transforming growth factor-β1induces matrix metalloproteinase-9 expression in human meningeal cells via ERK and Smad pathways[J]. Biochem Biophys Res Commun, 2009, 383(4): 475-479.
[10] Cicek M, Vrabel A, Sturchio C, et al. TGF-β inducible early gene 1 regulates osteoclast differentiation and survival by mediating the NFATc1,AKT, and MEK/ERK signaling pathways[J]. PLoS One, 2011,6(3): e17522.
[11] Ghayor C, Rey A, Caverzasio J. Prostaglandin-dependent activation of ERK mediates cell proliferation induced by transforming growth factor β in mouse osteoblastic cells[J].Bone, 2005,36(1):93-100.
[12] 朱晓峰,张荣华,孙升云,等. 淫羊藿素通过雌激素受体和骨形态发生蛋白信号诱导MC3T3-E1 Subclone 14 细胞分化[J].中国病理生理杂志,2011,27(12):2351-2356.
[13] Sowa H, Kaji H, Yamaguchi T, et al. Activations of ERK1/2 and JNK by transforming growth factor β negatively regulate Smad3-induced alkaline phosphatase activity and mineralization in mouse osteoblastic cells[J].J Biol Chem, 2002, 277(39):36024-36031.
EffectsofZuoguipill-medicatedserumonproliferationanddifferentiationofMC3T3-E1cellsviaERK/TGF-β/Smadssignalingcascade
HAO Chang-ying1, REN Yan-ling1, LIU Li-ping1, SONG Nan2, WANG Zhi-min3
(1SchoolofBasicMedicine,2theSecondAffiliatedHospital,3theFirstClinicalInstitute,LiaoningUniversityofTraditionalChineseMedicine,Shenyang110032,China.E-mail:yanlingren@tom.com)
AIM: To study the effects of Zuogui pill (ZG)-medicated serum on the proliferation and differentiation of MC3T3-E1 cells via ERK/TGF-β/Smads signaling pathway.METHODSUsing Premarin (conjugated estrogens tablets) as a positive control, the SD female rats were fed with high-, medium- or low-dose of ZG suspension. ZG-medicated serum was separated from abdominal aortic blood 7 d after feeding of ZG. MTT assay was applied to test the effect of ZG-medicated serum on the viability of MC3T3-E1 cells. The production of alkaline phosphatase (ALP) was detected by a modified calcium and cobalt dyeing method. The calcified nodules were observed by the method of alizarin red staining. The levels of core binding factor α1 (Cbfα1) and collagen type I (Col I) protein were analyzed by Western blotting. The mRNA expression of TGF-β1, Smad4 and Smad2 was measured by real-time RT-PCR.RESULTSZG-medicated serum promoted the proliferation of MC3T3-E1 cells in a dose-and time-dependent manner. Compared with other groups, treatment with 15% ZG (low dose) for 48 h increased the proliferation of MC3T3-E1 cells significantly. The protein levels of ALP, Cbfα1 and Col I,the calcified nodules, and the mRNA expression of TGF-β1, Smad4 and Smad2 in MC3T3-E1 cells were all significantly increased after treatment with ZG-medicated serum. After the addition of PD98059 (a specific blocker of ERK1/2 signaling pathway), all those were down-regulated except for mRNA expression of TGF-β1.CONCLUSIONZG regulates MC3T3-E1 cell proliferation and differentiation via the intervention of ERK/TGF-β/Smads signaling cascade, which may be one of the mechanisms that ZG effectively prevents and treats osteoporosis.
Zuogui pill; Extracellular signal-regulated kinases Transforming growth factor beta; Smad proteins; MC3T3-E1 cells
R363
A
10.3969/j.issn.1000-4718.2012.09.023
