胚胎期铅暴露对斑马鱼胚胎及幼鱼NMDA受体mRNA表达的影响*
2012-11-06张小晶张佳佳贾聪聪何金彩黄陈平
张小晶, 林 林, 张佳佳, 贾聪聪, 何金彩, 黄陈平△
(1温州医学院环境与公共卫生学院,浙江 温州 325035;2温州医学院附属第一医院,浙江 温州 325000)
1000-4718(2012)09-1577-05
2012-04-08
2012-07-06
国家自然科学基金资助项目(No. 30972509)
△通讯作者 Tel: 0577-86689901;E-mail: wzhcp@263.net
胚胎期铅暴露对斑马鱼胚胎及幼鱼NMDA受体mRNA表达的影响*
张小晶1, 林 林1, 张佳佳2, 贾聪聪1, 何金彩2, 黄陈平1△
(1温州医学院环境与公共卫生学院,浙江 温州 325035;2温州医学院附属第一医院,浙江 温州 325000)
目的了解胚胎期铅暴露对斑马鱼胚胎及幼鱼N-甲基-D-天冬氨酸(NMDA)受体mRNA表达的影响。方法野生型AB品系斑马鱼胚胎醋酸铅暴露浓度分别为0、0.1、0.5、2.5和12.5 μmol/L,提取各组受精后24、48、72、96和120 h(hpf)斑马鱼胚胎或幼鱼总RNA,实时定量PCR检测NMDA受体亚基NR1.1、NR1.2和NR2B的mRNA表达量。结果(1)对照组NR1.1和NR1.2及NR2B表达量在胚胎发育过程中逐渐升高,在孵化期(72 hpf)表达量增加明显,在幼鱼早期(96 hpf)时达到高峰(与24 hpf时比较,P<0.01),在120 hpf时仍处于较高水平。 (2)随着铅暴露浓度增高,NR1.1表达量增加并有高峰前移的趋势,2.5 μmol/L和12.5 μmol/L铅暴露组NR1.1表达高峰期在72 hpf,并且显著高于对照组(P<0.05);铅暴露组NR1.2和NR2B动态表达也呈类似规律,但NR1.2表达高峰期呈平台化趋势,横跨72 hpf至120 hpf阶段,NR2B表达高峰期出现在72 hpf和120 hpf阶段。(3) NR1.1、NR1.2及NR2B mRNA表达量之间Pearson相关系数值分别为rNR1.1-1.2=0.681、rNR1.1-2B=0.637和rNR1.2-2B=0.514,均有统计学意义(P<0.01)。结论在斑马鱼胚胎发育过程NR1.1、NR1.2及NR2B mRNA表达水平逐渐升高,在幼鱼早期达到高峰;胚胎和幼鱼阶段NR1.1、NR1.2及NR2B之间mRNA表达水平存在关联;铅有上调NR1.1、NR1.2和NR2B mRNA表达作用并使表达峰期前移,改变了正常的NMDA受体表达规律。
铅; 斑马鱼; 受体,NMDA; 基因表达; 胚胎
铅是常见的环境污染物,具有明显的神经发育毒性。胚胎阶段铅暴露是导致出生后神经行为发育障碍的关键环节,但其机制尚不清楚[1- 2]。N-甲基-D-天冬氨酸(N-methyl-D-aspartiate, NMDA)受体在中枢神经系统中广泛参与神经发育、突触可塑性及神经回路形成等过程[3]。NMDA受体是由NR1、NR2和NR3构成的异聚体阳离子通道,NR1为NMDA受体的基本功能单位,NR2和NR3对受体功能起调节修饰作用[4]。近年来斑马鱼胚胎发育毒理学技术发展迅速,在神经发育毒性机制研究方面具有独特的优势[5]。已知斑马鱼NR1有2个旁系同源基因NR1.1(Gene ID: 767745)和NR1.2(Gene ID: 100005675)。NR2有NR2A~D四个亚型,NR2B是胚胎期及生后早期主要的NMDA受体调节亚基[6]。本文通过比较研究铅暴露组与对照组斑马鱼胚胎及幼鱼NR1.1、NR1.2和NR2B mRNA动态表达水平,探讨早期铅暴露对NMDA受体亚基mRNA表达的影响。
材 料 和 方 法
1动物
野生型AB品系斑马鱼引自美国俄勒冈州立大学,由温州医学院水域科学与环境生态研究所斑马鱼实验室(浙江省模式生物技术与应用重点实验室)按斑马鱼工具书[7]描述的方法进行养殖。取健康性成熟的斑马鱼,于饲养系统关灯前(约18∶00)按雌雄1∶2的比例放入孵化器,次晨受光刺激后完成交配和产卵,收集胚卵,选取发育时间一致的正常胚胎进行实验。
2主要试剂与仪器
醋酸铅[Pb(CH3CO2)2·3H2O,PbAc, Sigma], TRIzol试剂(碧云天生物技术研究所),荧光定量PCR试剂盒(DRR041A,TaKaRa),实时荧光定量反转录试剂(TaKaRa)。人工气候箱(RXZ智能型,宁波江南仪器厂),倒置相差显微镜(TS100,Nikon),NanoDrop 2000超微量分光光度计(Thermo),荧光定量PCR仪(7500,ABI)。
3主要方法
3.1斑马鱼胚胎铅染毒 按照斑马鱼工具书要求配制正常胚胎培养液(embryo medium, EM)(0.137 mol/L NaCl, 5.4 mmol/L KCl, 0.25 mmol/L Na2HPO4,0.44 mmol/L KH2PO4,1.3 mmol/L MgSO4,4.2 mmol/L NaHCO3),用EM液溶解醋酸铅,配制铅质量浓度分别为0.1、0.5、2.5及12.5 μmol/L的含铅EM液。斑马鱼胚胎自受精后1 h(1 hour post fertilization,1 hpf)进行染毒,以不含铅的EM液孵养的胚胎作为对照,染毒胚胎孵化后改用EM液孵养至120 hpf。培养皿置于(28±1)℃人工气候箱内,光周期为明14 h∶暗10 h,每天更换培养液。
3.2总RNA提取及cDNA合成 分别收集各组发育至24、48、72、96和120 hpf的斑马鱼胚胎或幼鱼各35枚(条),用TRIzol法提取总RNA,逆转录合成cDNA,反应条件: 37 ℃ 15 min,85 ℃ 5 s。cDNA于-20 ℃贮存备用。
3.3实时定量PCR检测NR1.1、NR1.2和NR2BmRNA的表达量 根据斑马鱼NR1.1、NR1.2、NR2B的cDNA序列,设计荧光定量PCR引物,以β-actin作为内参照,引物由南京金斯瑞生物科技有限公司根据设计合成,引物序列见表1。根据荧光定量PCR试剂盒操作步骤,用荧光定量PCR仪对发育至24、48、72、96和120 hpf的斑马鱼胚胎或幼鱼NR1.1、NR1.2和NR2B mRNA表达量进行检测。PCR反应体系为20 μL:SYBR Premix Ex TaqTM(2×) 10 μL,引物(10 μmol/L)各0.8 μL,ROX Reference Dye(50×) 0.4 μL,cDNA 2 μL,加用焦碳酸二乙酯处理的水至20 μL。反应条件:预变性95 ℃ 30 s;PCR反应,95 ℃ 3 s,60 ℃ 30 s,循环40次。重复检测3次,每次做3个复孔,分别计算同一样品3个复孔的Ct均值,以同一样本中的β-actin Ct值作为内参照,以24 hpf对照组胚胎标本为基准。设基准组2-ΔΔCt为1,按式: 2-[( 检测组NR Ct-检测组β-actin Ct)-(基准组NR Ct-基准组β-actin Ct)]分别计算各组2-ΔΔCt,用以表示NR1.1、NR1.2和NR2B mRNA相对表达量[8]。
4统计学处理

表1β-actin、NR1.1、NR1.2和NR2B的实时荧光定量PCR引物序列
Table 1. Primer sequences of β-actin, NR1.1, NR1.2 and NR2B used in real-time quantitative PCR
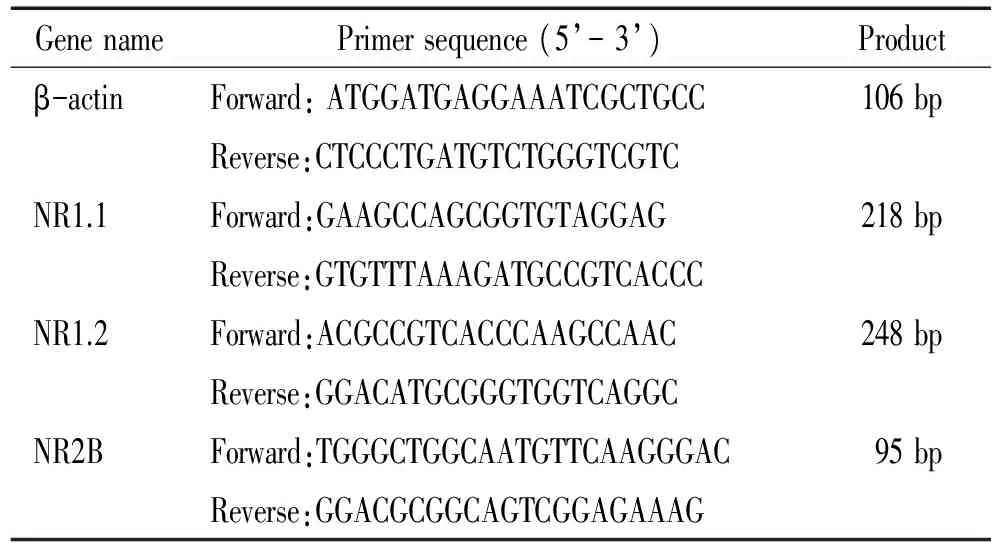
GenenamePrimersequence(5’-3’)Productβ-actinForward:ATGGATGAGGAAATCGCTGCC106bpReverse:CTCCCTGATGTCTGGGTCGTCNR1.1Forward:GAAGCCAGCGGTGTAGGAG218bpReverse:GTGTTTAAAGATGCCGTCACCCNR1.2Forward:ACGCCGTCACCCAAGCCAAC248bpReverse:GGACATGCGGGTGGTCAGGCNR2BForward:TGGGCTGGCAATGTTCAAGGGAC95bpReverse:GGACGCGGCAGTCGGAGAAAG
结 果
1NR1.1、NR1.2、NR2B及β-actincDNA扩增片段凝胶电泳
以斑马鱼胚胎cDNA为模板,用设计引物扩增NR1.1、NR1.2、NR2B及β-actin cDNA片段,扩增产物凝胶电泳结果均显示单一明亮条带,片段大小与设计预期相符,见图1。

Figure 1. Gel electrophoresis of β-actin, NR1.1, NR1.2 and NR2B cDNA in zebrafish.
图1斑马鱼β-actin、NR1.1、NR1.2和NR2BcDNA凝胶电泳图
2胚胎及幼鱼阶段NR1.1mRNA的表达
对照组 NR1.1 mRNA表达量在胚胎发育过程中逐渐升高,在孵化期(72 hpf)表达量增加明显,在幼鱼早期(96 hpf)时达到高峰,在120 hpf时仍处于较高水平,相对24 hpf时NR1.1表达量有显著增高(96 hpf,P<0.01;120 hpf,P<0.05)。各铅暴露组NR1.1动态表达也呈类似规律,但随着铅暴露浓度增高,NR1.1表达量增加并有高峰前移的趋势。2.5 μmol/L和12.5 μmol/L铅暴露组其NR1.1表达峰值出现在72 hpf 时点,较对照组提前,而且显著高于同时点对照组NR1.1表达量(P<0.05);在48 hpf 时,0.5 μmol/L和12.5 μmol/L铅暴露组NR1.1表达量也较对照组显著增高(P<0.05),见图2。
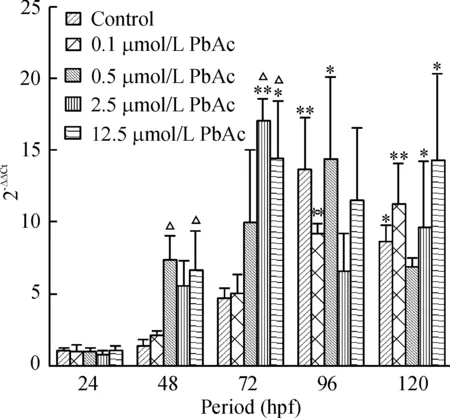

图2不同铅暴露组斑马鱼胚胎及幼鱼NR1.1mRNA的表达
3胚胎及幼鱼阶段NR1.2mRNA的表达
24 hpf至72 hpf时点,对照组NR1.2表达量逐渐升高,在72 hpf后,NR1.2表达量快速增加,在96 hpf 时达到高峰,显著高于其它各时段NR1.2表达量(P<0.01),随后NR1.2表达量有明显下降,但在120 hpf时仍处于较高水平。各铅暴露组NR1.2动态表达也呈类似规律,但NR1.2表达高峰期呈平台化趋势,横跨72 hpf至120 hpf阶段,尤以高铅(2.5 μmol/L和12.5 μmol/L)暴露组为明显。此外,48 hpf时0.5 μmol/L和72 hpf时2.5 μmol/L铅暴露组NR1.2表达量较同时段对照组有显著增加(P<0.05),见图3。
4胚胎及幼鱼阶段NR2BmRNA的表达
对照组 NR2B表达量自24 hpf后逐渐升高,72 hpf后表达量升高速度加快,在96 hpf 时达到高峰(P<0.01),之后表达量明显下降。各铅暴露组NR2B动态表达高峰期出现在72 hpf和120 hpf阶段,72 hpf时2.5 μmol/L组和120 hpf时0.5 μmol/L组NR2B表达量较相同铅暴露浓度下24 hpf时NR2B表达量有明显增高(P<0.05)。在48 hpf 时,2.5 μmol/L铅暴露组NR2B表达量也较对照组显著增高(P<0.05),见图4。


图3不同铅暴露组斑马鱼胚胎及幼鱼NR1.2mRNA的表达


图4不同铅暴露组斑马鱼胚胎及幼鱼NR2BmRNA的表达
5NR1.1、NR1.2及NR2BmRNA表达量之间相关分析结果
NR1.1与NR1.2、NR1.1与NR2B、NR1.2与NR2B mRNA表达量之间Pearson相关系数值分别为0.681、0.637和0.514,均有统计学意义(P<0.01),提示NR1.1、NR1.2及NR2B mRNA表达量之间存在相关关系。
讨 论
NMDA受体为谷氨酸离子型受体,通常由2个NR1亚基和2个NR2亚基形成的异四聚体,其构成的离子通道对Ca2+有高通透性,具有化学电压双重门控特点,NMDA受体介导的细胞信号转导与神经发育、突触可塑性及学习记忆功能等密切相关[3-4, 9]。本实验中,对照组斑马鱼NR1.1、NR1.2和NR2B的mRNA表达量自24 hpf后逐渐升高,72 hpf后表达量明显增加,在96 hpf时达到高峰。斑马鱼胚胎发育迅速,72 hpf时处于胚胎孵出前后阶段,96 hpf 为幼鱼早期阶段。本实验结果显示NR1.1、NR1.2和NR2B主要在胚胎发育后期及幼鱼阶段表达。Cox等[10]报道,NR1在24 hpf斑马鱼胚胎就已有明显表达,表达部位在脑区及脊索等部位,至48 hpf时表达愈加明显;PCR检测NR2B基因表达在96 hpf时最显著。Monyer等[6]研究大鼠神经发育阶段NMDA受体亚基分布表达情况,发现各NR2亚基表达水平在生后7~20 d达到高峰。本实验结果与上述报道结果相符,证实了在出生早期存在NMDA受体表达高峰期。NMDA受体各亚基主要分布于神经元,其表达水平与神经发育有关,生后早期是神经元发育及细胞间连接形成旺盛阶段,可能因此诱发NR1.1、NR1.2和NR2B的高表达。
表2NR1.1、NR1.2和NR2BmRNA表达量之间相关分析
Table 2. Correlation analysis of the mRNA expression among NR1.1,NR1.2 and NR2B

GroupnPearson’sCorrelationCoefficientNR1.1-NR1.2NR1.1-NR2BNR1.2-NR2BControl150.942∗∗0.735∗∗0.792∗∗0.1μmol/LPbAc150.5010.810∗∗0.0750.5μmol/LPbAc150.646∗∗0.1460.4742.5μmol/LPbAc150.722∗∗0.806∗∗0.719∗∗12.5μmol/LPbAc150.678∗∗0.896∗∗0.563∗Total750.681∗∗0.637∗∗0.514∗∗
*P<0.05,**P<0.01.
铅属于神经性毒物,在神经系统发育早期其毒作用尤为明显,但目前毒作用机制尚未明了。据报道,NMDA受体的亚基组成与神经发育及突触形成等密切相关,除必需亚基NR1外,构成NMDA受体的亚基主要为NR2A和NR2B,不同亚基构成的NMDA受体在不同发育阶段和部位,通过不同的信号转导通路发挥着不同作用[11]。在胚胎发育阶段及出生早期,主要以NR2B高表达为主,在生后成熟期则以NR2A高表达为主,这种在神经发育过程中从以含NR2B的NMDA受体为主向以含NR2A的NMDA受体过渡的转变,对于神经细胞正常发育可能是十分重要的[6]。Toscano等[12]报道铅暴露可能延缓或阻碍以含NR2B为主的NMDA受体向以含NR2A为主的NMDA受体过渡,进而影响有关的信号转导通路。Neal等[13]研究发现,体外原代海马神经元铅暴露可减少突触NR2A-NMDA受体水平,增加NR2B-NMDA受体水平, 增加NR1在突触后膜致密区(postsynaptic density,PSD)集聚,并认为此与持久性抑制NMDA受体有关,因其结果与使用NMDA受体拮抗剂2-氨基-5-磷戊酸(2-amino-5-phosphonovaleric acid,APV)得到的结果相似。目前认为铅可能是一种非竞争性NMDA受体拮抗物[14]。在本实验中,随着铅暴露浓度增高,NR1.1表达量增加并有高峰前移的趋势,NR1.2和NR2B动态表达也呈类似规律,表达高峰期呈平台化趋势。本实验结果证实了铅暴露能导致胚胎期及孵化后早期NR1和NR2B表达水平增加,改变了NMDA受体亚基原有的表达规律,这种改变可能是由于铅抑制了NMDA受体而导致NR1和NR2B表达代偿性上调所致。
NR1.1与NR1.2、NR1.1与NR2B、NR1.2与NR2B mRNA表达量之间Pearson相关系数值均有统计学意义,提示NR1.1、NR1.2及NR2B mRNA表达量之间存在相关关系。NR1.1和NR1.2是斑马鱼NR1两个旁系同源基因,转录物具有相同功能,因此其表达调控相似。NR2B作为胚胎期和孵化后早期参与NMDA受体构成的NR2亚基主要的类型,其表达量与NR1之间存在密切关系。
综上所述,得出如下初步结论:(1)在斑马鱼胚胎发育过程NR1.1、NR1.2及NR2B mRNA表达水平逐渐升高,在幼鱼早期达到高峰;(2)胚胎和幼鱼阶段NR1.1、NR1.2及NR2B之间mRNA表达水平存在关联;(3)铅有上调NR1.1、NR1.2和NR2B mRNA表达作用并使表达峰期前移,改变了正常的NMDA受体表达规律。
[1] Lidsky TI, Schneider JS. Lead neurotoxicity in children: basic mechanisms and clinical correlates[J]. Brain, 2003,126(Pt 1):5-19.
[2] Bellinger DC. Very low lead exposures and children’s neurodevelopment[J]. Curr Opin Pediatr, 2008,20(2):172-177.
[3] Gladding CM, Raymond LA. Mechanisms underlying NMDA receptor synaptic/extrasynaptic distribution and function[J]. Mol Cell Neurosci, 2011,48(4):308-320.
[4] Paoletti P. Molecular basis of NMDA receptor functional diversity[J]. Eur J Neurosci, 2011,33(8):1351-1365.
[5] Sipes NS, Padilla S, Knudsen TB. Zebrafish: as an integrative model for twenty-first century toxicity testing[J]. Birth Defects Res C Embryo Today, 2011,93(3):256-267.
[6] Monyer H, Burnashev N, Laurie DJ, et al. Developmental and regional expression in the rat brain and functional properties of four NMDA receptors[J]. Neuron, 1994,12(3):529-540.
[7] Westerfield M. The zebrafish book: A guide for the laboratory use of zebrafish (Daniorerio)[M]. 4th ed. Eugene: University of Oregon Press, 2000.
[8] Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative CTmethod[J]. Nat Protoc, 2008,3(6):1101-1108.
[9] 王玉梅, 刘永平, 曹 凯, 等. 黄芩茎叶黄酮对慢性脑缺血大鼠脑内NMDA受体和VEGF表达的影响[J]. 中国病理生理杂志, 2012, 28(2):353-357.
[10]Cox JA, Kucenas S, Voigt MM. Molecular characterization and embryonic expression of the family ofN-methyl-D-aspartate receptor subunit genes in the zebrafish[J]. Dev Dyn, 2005,234(3):756-766.
[11]Kim MJ, Dunah AW, Wang YT, et al. Differential roles of NR2A- and NR2B-containing NMDA receptors in Ras-ERK signaling and AMPA receptor trafficking[J]. Neuron, 2005,46(5):745-760.
[12]Toscano CD, Hashemzadeh-Gargari H, McGlothan JL, et al. Developmental Pb2+exposure alters NMDAR subtypes and reduces CREB phosphorylation in the rat brain[J]. Brain Res Dev Brain Res, 2002,139(2):217-226.
[13]Neal AP, Worley PF, Guilarte TR. Lead exposure during synaptogenesis alters NMDA receptor targeting via NMDA receptor inhibition[J]. Neurotoxicology, 2011,32(2):281-289.
[14]Gavazzo P, Zanardi I, Baranowska-Bosiacka I, et al. Molecular determinants of Pb2+interaction with NMDA receptor channels[J]. Neurochem Int, 2008,52(1-2):329-337.
EffectofleadexposureonmRNAexpressionofNMDAreceptorsinzebrafishembryosandlarvae
ZHANG Xiao-jing1, LIN Lin1, ZHANG Jia-jia2, JIA Cong-cong1, HE Jin-cai2, HUANG Chen-ping1
(1SchoolofEnvironmentalScienceandPublicHealth,WenzhouMedicalCollege,Wenzhou325035,China;2TheFirstAffi-liatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China.E-mail:wzhcp@263.net)
AIM: To investigate the effect of lead exposure on mRNA expression ofN-methyl-D-aspartate (NMDA) receptors in zebrafish embryos and larvae.METHODSZebrafish embryos (wild type; AB line) were exposed to lead acetate (PbAc) at concentrations of 0, 0.1, 0.5, 2.5 and 12.5 μmol/L, respectively. Total RNA was extracted from zebrafish embryos or larvae at the time points of 24, 48, 72, 96 and 120 hours post fertilization (hpf). The mRNA levels of NR1.1, NR1.2 and NR2B were determined by real-time quantitative PCR.RESULTSThe mRNA expression of NR1.1, NR1.2 and NR2B gradually increased during embryonic development, raised rapidly at 72 hpf, peaked at 96 hpf (vsthat at 24 hpf,P<0.01), and still kept in high level at 120 hpf in control group. The impact of lead exposure on the mRNA expression of NR1.1, NR1.2 and NR2B varied with lead concentrations. With the increasing concentrations of PbAc, the mRNA expression of NR1.1 generally increased and reached the highest level ahead of 96 hpf. The peak mRNA level of NR1.1 was observed at 72 hpf under the condition of PbAc exposure at the concentrations of 2.5 and 12.5 μmol/L, and were higher than that in control group (P<0.05). Similarly, the mRNA levels of NR1.2 and NR2B showed an increasing trend with PbAc exposure. However, the peaking time of NR1.2 and NR2B in mRNA expression spanned from 72 to 120 hpf. The significant correlations between the expression levels of NR1.1, NR1.2 and NR2B were observed (P<0.01) and the Pearson’s correlation coefficient values ofrNR1.1-1.2,rNR1.1-2Band rNR1.2-2Bwere 0.681, 0.637 and 0.514, respectively.CONCLUSIONThe mRNA expression of NR1.1, NR1.2 and NR2B gradually increases throughout the embryonic development of zebrafish and reaches the highest levels at early stage of larva. Close correlations between the mRNA expression of NR1.1, NR1.2 and NR2B are present during the period of embryo and larva. Lead exposure induces up-regulation and forward shift of NR1.1, NR1.2 and NR2B at mRNA level, indicating that lead induces abnormal expression of NMDA receptors.
Lead; Zebrafish; Receptors, NMDA; Gene expression; Embryo
R363
A
10.3969/j.issn.1000-4718.2012.09.008
