用化学发光法研究红枣乙醇提取物的抗氧化活性
2012-10-26刘晓宇邓碧云李驰骋陈子亮
王 悦,刘晓宇,邓碧云,李驰骋,梁 静,陈子亮
(华中农业大学食品科技学院,湖北武汉 430070)
用化学发光法研究红枣乙醇提取物的抗氧化活性
王 悦,刘晓宇*,邓碧云,李驰骋,梁 静,陈子亮
(华中农业大学食品科技学院,湖北武汉 430070)
研究了红枣中提取的黄酮类化合物的抗氧化活性。采用乙醇提取红枣中黄酮类化合物,并通过三种化学发光体系探讨了红枣中黄酮类化合物的抗氧化能力。结果表明,红枣中黄酮类化合物能有效地清除O2-·、·OH和H2O2,半数抑制浓度(IC50)分别为64.96、6.52、0.98mg/L,具有较强的抗氧化活性。
红枣,黄酮,化学发光,抗氧化性
红枣(Zizyphus Jujuba Dates)为鼠李科(Rhamnacede)木本植物枣的果实,是我国特有的果品之一。红枣既可食用又可入药,具有滋阴补肾、安中养脾、和解药性、润肺、健脾益胃等多种药用功效,有“百果之王”的美称[1]。红枣中含有蛋白质、糖类、有机酸、脂肪、氨基酸、丰富的维生素及铁、锌、磷、钙、硒等,同时还含有很高的特殊生物活性成分,如多糖、黄酮类、鞣质、甾醇和生物碱等[2-3]。黄酮类化合物是植物中重要的次生代谢产物,具有抗氧化、抗衰老、抑菌、清除体内自由基及增加机体免疫力等功能,应用前景广泛[4-5]。本实验以新疆红枣为原料提取总黄酮,采用化学发光法研究了红枣总黄酮的抗氧化活性,旨在为红枣的深入开发及综合利用提供依据。
1 材料与方法
1.1 材料与仪器
红枣 新疆塔里木大漠枣业公司,60℃恒温干燥,去核、粉碎后过40目筛;芦丁标准品 中国医药集团上海化学试剂公司;鲁米诺 Sigma公司;工业乙醇 华中农业大学设备科;邻菲罗啉 美国国际实验室;石油醚、亚硝酸钠、硝酸铝、氢氧化钠、邻苯三酚、EDTA、抗坏血酸、过氧化氢 国药集团化学试剂有限公司,均为分析纯。
ZX-9240MBE型数显鼓风干燥箱 上海博讯实业有限公司医疗设备厂;BT-224S电子天平 赛多利斯科学仪器(北京)有限公司;HH-4数显恒温水浴锅 国华电器有限公司;GRE52CS-1型旋转蒸发仪 上海亚荣生化仪器厂;722型可见分光光度计 上海欣茂仪器有限公司;pHS-3C型数字pH计 上海雷磁仪器厂;BPCL-I型微弱发光测量仪 中科院生物物理研究所。
1.2 实验方法
1.2.1 红枣黄酮的制备 采用石油醚对已过40目筛的红枣粉进行脱脂处理,脱脂时间3h,挥去石油醚。乙醇浓度63%,浸提温度73℃,料液比1∶25,浸提时间2h,提取三次,过滤提取液,浓缩,真空冷冻干燥得红枣黄酮备用。
1.2.2 标准曲线的绘制[6]采用亚硝酸钠-硝酸铝显色法测定红枣中总黄酮含量。精密称取在120℃干燥至恒重的芦丁标准品10mg,用30%乙醇水浴微热溶解,定容于100m L容量瓶,摇匀,即配制成浓度为100μg/m L的芦丁标准溶液。分别精密移取芦丁标准溶液0.0、1.0、2.0、3.0、4.0、5.0m L于10m L比色管中,各加入30%乙醇溶液至5m L,5%亚硝酸钠溶液0.3m L,摇匀,放置5m in,加10%硝酸铝溶液0.3m L,摇匀,放置6min,加1mol/L氢氧化钠溶液2m L,摇匀,用30%的乙醇定容至刻度,摇匀,静置15m in,以试剂空白为参比溶液,在510nm处测定吸光度,以芦丁标准溶液的吸光度A为横坐标,浓度C为纵坐标,绘制标准曲线。用最小二乘法作线性回归,得芦丁浓度C与吸光度A的标准曲线线性回归方程式。
1.2.3 对超氧阴离子自由基的清除作用[7]采用邻苯三酚-鲁米诺发光体系。鲁米诺用0.05mol/L NaOH溶液配制成1mmol/L的溶液。邻苯三酚用1mmol/L HCl配制成6.25×10-4mol/L的溶液。0.05mol/L pH 10.2的Na2CO3-NaHCO3缓冲溶液(含0.1mmol/L EDTA)用前现配,实验前与1mmol/L鲁米诺以体积比2∶1混合成鲁米诺-碳酸盐缓冲液。测定方法:向样品池中加入10μL不同浓度待测样品(样品缓冲液做对照),然后加入6.25×10-4mol/L邻苯三酚50μL,鲁米诺-碳酸盐缓冲液940μL,启动发光系统,间隔2s计数,测定300s的总发光积分强度。本底不加邻苯三酚。
1.2.4 对羟基自由基的清除作用[8]采用CuSO4-Phen-VC-H2O2化学发光体系。测定方法:取不同浓度样品溶液(样品缓冲液做对照)50μL于样品池中,依次加入1mmol/L CuSO4溶液50μL,1mmol/L邻菲罗啉溶液50μL,0.05mol/L硼砂溶液700μL(pH 9.0),充分混匀,然后再加入1mmol/L抗坏血酸溶液100μL和0.15% H2O2溶液50μL,立即启动发光系统,反应总体积为1.0m L,间隔3s计数,记录400s内发光强度。本底不加双氧水。
1.2.5 对双氧水的清除作用[9]采用双氧水-鲁米诺化学发光体系。取不同浓度样品溶液50μL于样品池中,依次加入0.15mol/L H2O2溶液50μL和0.1mmol/L鲁米诺-0.05mol/L pH 9.4碳酸盐缓冲液混合液(体积比为1∶17)900μL,启动反应,间隔2s计数,记录180s内发光强度。本底不加双氧水。
1.2.6 数据处理[10]实验重复3次取平均值,曲线面积积分表示相对发光强度,以Origin8软件统计数据,按照下式计算抑制率,并用SPSS软件计算半数抑制浓度(IC50)。

式中,CL空白为空白对照组的相对发光强度;CL本底为本底组的相对发光强度;CL样品为样品组的相对发光强度。计算抑制率为50%时的浓度(IC50),用来衡量样品对自由基的清除能力。IC50值越小,表明样品清除自由基能力越强。
2 结果与分析
2.1 芦丁标准曲线的制作
按照1.2.2方法,绘制标准曲线如图1所示。
由图1得到回归方程:A=0.0974C+0.0017(C为芦丁浓度mg/m L,A为吸光度),R2=0.9994。
2.2 对超氧阴离子自由基的清除作用
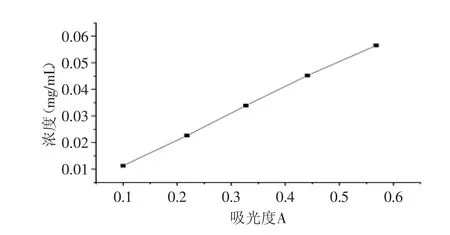
图1 芦丁标准曲线Fig.1 Rutin standard curve
红枣黄酮提取液对超氧阴离子的清除作用见图2。由图2中可以看出,化学发光体系启动后,发光强度迅速上升,10s内达到最大值,随后开始下降。样品加入后,发光动力学曲线峰值开始降低,曲线积分面积减少。表1结果表明,随着样品浓度的升高,抑制率呈上升趋势,量效关系明显,红枣黄酮能很好地清除体系中的超氧阴离子,其半数抑制浓度为64.96mg/L。
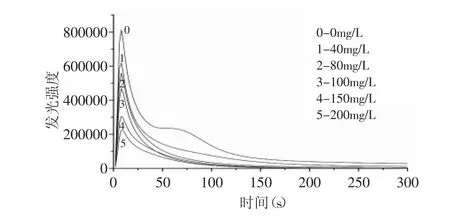
图2 不同浓度的红枣黄酮抑制O2-·引发的化学发光动力学曲线Fig.2 Kinetic curves of O2-·inhibited by flavone part from Zizyphus Jujube

表1 不同浓度样品对O2-·的抑制率Table 1 Inhibition ratio of O2-·with different concentration of samples
2.3 对羟基自由基的清除作用

图3 不同浓度的红枣黄酮抑制·OH引发的化学发光动力学曲线Fig.3 Kinetic curves of·OH inhibited by flavone part from Zizyphus Jujube
红枣黄酮提取液对羟基自由基的清除作用见图3。由图中可以看出,启动反应后,低浓度的样品发光强度迅速上升,达到最大值,随后发光强度缓慢下降;高浓度的样品发光强度在40s内迅速上升,随后发光强度缓慢上升。样品加入后,发光曲线峰值开始降低,曲线面积减少,随着浓度的增大,发光更弱。由表2可知,对羟基自由基的清除率随着浓度的增加而增大,量效关系非常明显。结果表明,红枣黄酮能有效地清除体系中的羟基自由基,其半数抑制浓度为6.52mg/L。

表2 不同浓度样品对·OH的抑制率Table 2 Inhibition ratio of·OH with different concentration of samples
2.4 对双氧水的清除作用
红枣黄酮提取液对双氧水的清除作用见图4。由图可以看出,化学发光体系启动后,发光强度迅速达到最大值,随后逐渐下降。加入样品后,动力学曲线发生变化,发光值开始降低,曲线面积减小。从表3可知,对双氧水的清除率随着浓度的增加而增大,两者之间呈现一定的剂量-效应关系。结果表明,红枣黄酮能较好地清除体系中的双氧水,半数抑制浓度为0.98mg/L。

图4 不同浓度的红枣黄酮抑制H2O2引发的化学发光动力学曲线Fig.4 Kinetic curves of H2O2 inhibited by flavone part from Zizyphus Jujube
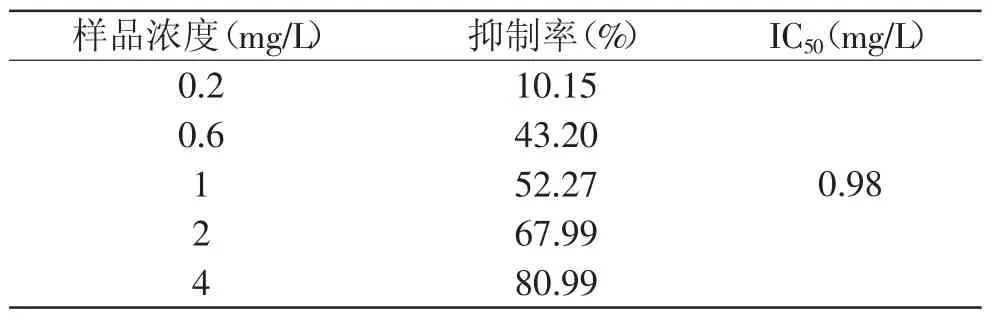
表3 不同浓度样品对H2O2的抑制率Table 3 Inhibition ratio of H2O2 with different concentration of samples
3 结论
通过采用三种化学发光体系研究红枣中黄酮类化合物的抗氧化活性,均证明提取的红枣黄酮类化合物具有较强的体外抗氧化活性,且红枣中黄酮类化合物对3种自由基的清除能力依次为过氧化氢>羟基自由基(·OH)>超氧阴离子自由基(O2-·),IC50分别为0.98、6.52、64.96mg/L。
红枣资源丰富,总黄酮含量较高且易分离,并具有一定的抗氧化活性,本研究为红枣的进一步开发利用提供了科学依据。
[1]韩志萍.陕北红枣中总黄酮的提取及含量比较[J].食品科学,2006,27(12):560-562.
[2]张春兰,张锐利,熊素英,等.超声波辅助提取红枣核中总黄酮的研究[J].安徽农业科学,2010,38(12):6503-6505.
[3]王军,张宝善,陈锦屏.红枣营养成分及其功能的研究[J].食品研究与开发,2003,24(2):68-72.
[4]Havsteen B H.The biochemistry and medical significance of the flavonoids[J].Pharmacology&Therapeutics,2002,96(2-3):67-202.
[5]Babenko N A,Shakhova E G.Effects of Chamomilla recutita flavonoids on age-related liver sphingolipid turnover in rats[J]. Experimental Gerontology,2006,41(1):32-39.
[6]张志国,陈锦屏,邵秀芝,等.红枣核类黄酮清除DPPH自由基活性研究[J].食品科学,2007,28(2):67-70.
[7]邓乾春,陈春艳,田斌强,等.化学发光法测定白果白蛋白的体外抗氧化活性[J].中草药,2007,38(5):685-690.
[8]田云,卢向阳,何小解.天然植物抗氧化剂清除氧自由基特性研究[J].食品科学,2005,26(6):123-125.
[9]张瑞巧,刘石磊,孙智达,等.山楂果肉原花青素的体外抗氧化活性和对DNA损伤的保护作用[J].天然产物研究与开发,2008,20(1):131-133,128.
[10]吴娜,孙智达.艾蒿黄酮体外抗氧化活性及对DNA氧化损伤的保护研究[J].食品科学,2008,29(10):47-50.
Study on antioxidant capacity of Zizyphus Jujube ethanolextracts by chem ilum inescence
WANG Yue,LIU Xiao-yu*,DENG Bi-yun,LIChi-cheng,LIANG Jing,CHEN Zi-liang
(College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China)
The antioxidant activity of flavonoids from Zizyphus Jujube was stud ied.The flavonoids from Zizyphus Jujube was extracted by ethanol and the antioxidant activity of the extrac tion liquid was also investigated by using three chem ilum inescence systems.The results indicated that the flavonoids of Zizyphus Jujube had powerful ability to scavenge O2-·,·OH and H2O2.The 50%inhibition concentrations(IC50)were 64.96,6.52,0.98mg/L,and the extrac tion had strong antioxidantactivity.
Zizyphus Jujube;flavonoids;chem ilum inescence;antioxidantac tivity
TS255.1
A
1002-0306(2012)09-0120-03
2011-08-22 *通讯联系人
王悦(1986-),女,硕士研究生,研究方向:食品科学。
新疆兵团博士基金项目(2010JC12)。
