火龙果茎段组织培养快繁技术研究
2012-10-22王云山周美虹康黎芳曹冬梅段九菊
王云山,周美虹,康黎芳,曹冬梅,张 超,段九菊
(1.山西省农业科学院园艺研究所,山西太原030031;2.太原市迎泽李园农业科技培育场,山西太原030045)
火龙果(Hylocereus undatus)又称红龙果、仙蜜果,属仙人掌科三角柱属,原产于墨西哥等中美洲地区,是一种具有较高经济价值和保健美容作用的新兴水果[1]。火龙果植株为多年生肉质植物,花蕾似漏斗,一般于傍晚开花,凌晨逐渐凋萎。自花授粉,但坐果率低,因此,一般采用人工授粉。不同品种的火龙果果肉颜色不同,有白色、红色、黄色、紫红色等,而且营养价值极高,含有丰富的维生素、纤维素、葡萄糖及人体所需K,Ca,Mg等多种矿物质、蛋白质,但脂肪含量较少[2-3]。另外,火龙果耐旱、耐瘠薄,抗性强,能够在旱坡地种植,具有保持水土、减少沙化、改善生态环境的作用[4-5]。因此,其在生产上具有较大的发展前途及经济价值。
目前,火龙果的繁殖主要通过种子、扦插、嫁接等方式,这些方法的繁殖速度较慢,又受繁殖材料供应的限制,很难满足市场的需求。近年来,科研工作者一直尝试用组织培养的方式繁殖火龙果[6-14],且已取得了一定的成效。本研究在前人研究的基础上,探索用火龙果幼嫩茎段作为外植体进行组织培养,以达到快速繁殖的目的,从而实现火龙果的工厂化生产。
1 材料和方法
1.1 试验材料
试验以火龙果幼嫩茎段作为外植体,供试材料于2010年7月取自太原市迎泽李园农业科技培育场。
1.2 试验方法
1.2.1 外植体的取材 从温室中生长健壮的火龙果母株上,剪取 2~3,5~7,15~17 cm共 3种长度的带刺座幼嫩茎段作为外植体,观察不同外植体对愈伤组织诱导以及刺座不定芽萌发的影响。
1.2.2 外植体的灭菌 剪取生长健壮的母茎上的新生茎段,在洗衣粉液中用软毛刷刷洗并用流水冲洗干净,然后置于超净工作台内用镊子小心剥去刺座上的小刺和毛,之后用75%的酒精快速消毒30 s,然后将茎段置于0.1%的升汞溶液中浸泡消毒。其中,流水冲洗时间设0.5,1 h 2个处理,0.1%的升汞溶液消毒时间设7,10,15 min共3个处理,组成6个组合。表面消毒完成后用无菌水冲洗4次,每次5 min左右。消毒过程中要搅拌外植体,使其充分接触消毒液,提高消毒效果。将消毒后的茎段横切成1.5 cm左右长的茎段,基部向下接种到诱导培养基上。培养1周后,统计其污染率和褐死率。
1.2.3 外植体诱导培养基筛选 沿波浪形棱缘纵向切成长×宽为1.5 cm×1.5 cm、带有刺座的小块(去除髓部及药剂接触过的伤口),每块上均留有1个刺座,垂直接种在培养基上。培养基以MS为基本培养基,附加不同浓度的6-BA和NAA,蔗糖30 g/L,琼脂5 g/L,pH值为5.8。6-BA质量浓度分别为 2,4,5,8,10 mg/L,共 5 个水平;NAA分别为 0.05,0.1,0.2 mg/L共 3个水平,共计15个处理。
每个处理10瓶,每瓶2块,培养45 d,统计其刺座不定芽的诱导率。培养室温度为(25±3)℃,每天光照 12 h,光照强度 1 500~2 000 lx。
1.2.4 分化增殖培养基筛选 将诱导出的不定芽切成3~5个芽作为一丛(大小、长势要一致),接种于分化增殖培养基上,进行不定芽分化增殖。基本培养基为MS,琼脂为5 g/L,蔗糖30 g/L,激素 6-BA 质量浓度为 1.0,3.0,5.0,8.0 mg/L,共4个水平;激素NAA质量浓度为0.05,0.1,0.2 mg/L,共3个水平。合计12个处理。
每个处理5瓶,每瓶3块,培养30 d,统计其刺座不定芽的增殖率。
1.2.5 生根培养基筛选 取同一增殖培养基中生长健壮、高达2 cm以上的小苗接种到生根培养基中,生长30 d后统计其生根情况。基本培养基为:大量元素减半的1/2 MS,琼脂5 g/L,蔗糖30 g/L。IBA质量浓度分别为 0.3,0.5,1.0,1.5,2.0,3.0,4.0 mg/L,共7个水平;NAA质量浓度分别为0.5,2.0 mg/L,共2个水平。为了研究活性炭对生根褐化的影响,另加1个IBA 1.0 mg/L+活性炭2 g/L的处理,共10个处理。
每个处理5瓶,每瓶3~6块。生长30 d观察其生根情况。
2 结果与分析
2.1 不同灭菌方法对火龙果外植体的影响
从表1可以看出,以火龙果母茎上的新生茎段为材料,用0.1%的升汞消毒15 min的污染率最低,但消毒15 min的材料大部分刺座及茎棱组织有褐化并逐渐坏死的现象,说明15 min的消毒时间过长,茎段的组织细胞被杀死。这与周传明等[15]报道的火龙果外植体在不同消毒时间过程中的现象是一致的。综合考虑,材料灭菌以流水冲洗0.5 h+75%酒精消毒30 s+0.1%的升汞消毒10 min处理最佳。
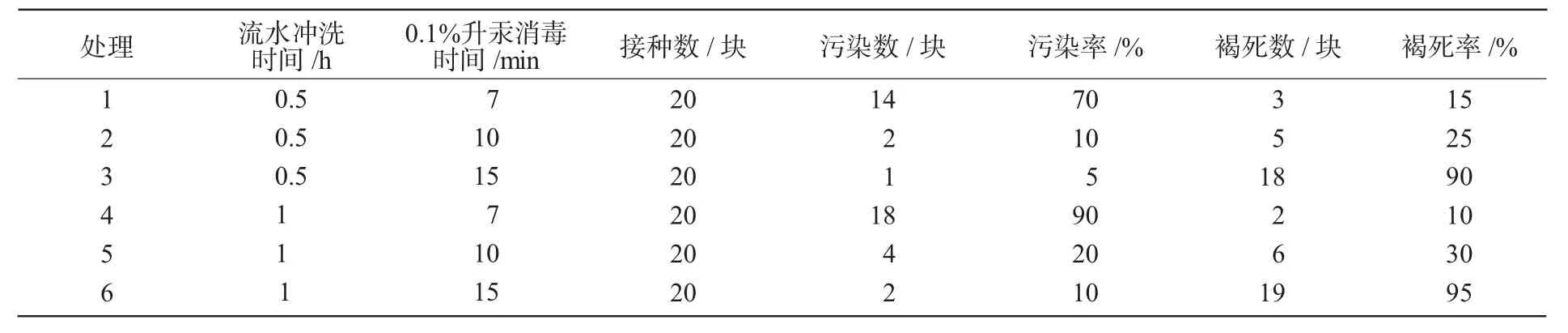
表1 不同灭菌方法对火龙果外植体的影响
2.2 不同外植体对愈伤组织诱导及刺座不定芽萌发的影响
从表2可以看出,不同长度的带刺座棱片均能产生愈伤组织,刺座上的不定芽大部分可以启动生长,但有差异,其中,以2~3 cm长的幼嫩茎段诱导效果最佳。外植体接种1周后,切口变厚,切口处产生疏松的淡绿色愈伤组织,20 d后切口表面突起呈半球状,形成绿色愈伤组织。刺座则在10~14 d后长出带有白色茸毛的小突起,20~30 d后不定芽萌出,形成一个类似鹿角状的组织。

表2 不同外植体对愈伤组织诱导及刺座不定芽萌发的影响
2.3 不同培养基对火龙果外植体刺座不定芽诱导分化的影响
本研究采用的诱导火龙果刺座不定芽分化的激素组合为6-BA和NAA,其不同质量浓度组合对不定芽诱导分化的影响如表3所示。
从表3可以看出,火龙果在MS附加不同质量浓度的 6-BA(2~10 mg/L)和 NAA(0.05~0.2 mg/L)的培养基上均能诱导刺座产生不定芽。在本试验条件下,当较高质量浓度的6-BA(4~8 mg/L)与适宜质量浓度NAA组合(处理4~8,10,11)时,外植体刺座不定芽诱导率较高,达50%~75%;当较低质量浓度的6-BA(2 mg/L)与 NAA(0.05~0.2 mg/L)组合(处理 1,2,3)时,刺座不定芽分化率较低,仅为5%~25%。当NAA质量浓度相同、6-BA质量浓度降低,或6-BA质量浓度相同、NAA质量浓度提高时,大部分表现为不定芽分化率下降。综上所述,不同的激素质量浓度组合对火龙果刺座不定芽的诱导效果不同,以4 mg/L 6-BA和0.1 mg/L NAA组合时效果最好,其刺座不定芽分化率最高,可达到75%。
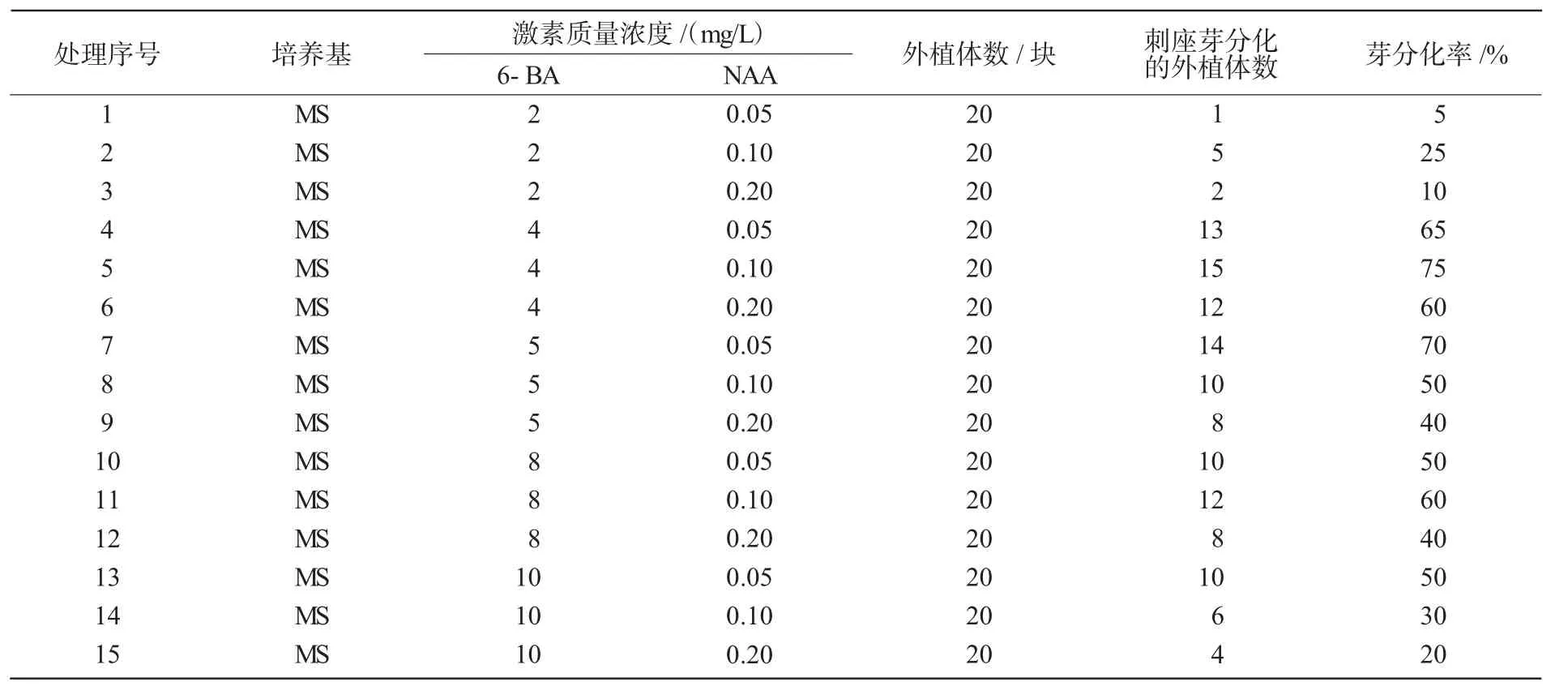
表3 不同培养基对火龙果刺座芽诱导分化的影响
2.4 不同培养基对芽增殖与生长的影响
由表4可知,当6-BA质量浓度为8 mg/L,NAA质量浓度为0.05 mg/L(处理10)时,不定芽的繁殖系数最高,达6.0,但其不定芽生长缓慢,呈细弱状,且褐化现象严重。当6-BA质量浓度为1 mg/L,NAA质量浓度为0.2 mg/L时,虽然不定芽的繁殖系数低,但其不定芽生长较快、苗壮。在NAA质量浓度相同时,随6-BA质量浓度的增加,芽的繁殖系数随之增加,同时不定芽生长减缓,长势减弱且褐化严重。当6-BA质量浓度相同,NAA质量浓度提高时,不定芽繁殖系数则下降,气生根增多。
在继代过程中,可以根据生产的需要先在6-BA 8 mg/L+NAA 0.05 mg/L培养基中培养7~10 d,待刺座上长出许多小突起,再转接于6-BA 1 mg/L+NAA 0.2 mg/L培养基中进行生长培养。这样交替培养,可以调节不定芽的增殖与生长,从而达到既有较快的繁殖速度,又能保证有较好的小苗且减少褐化苗的目的。
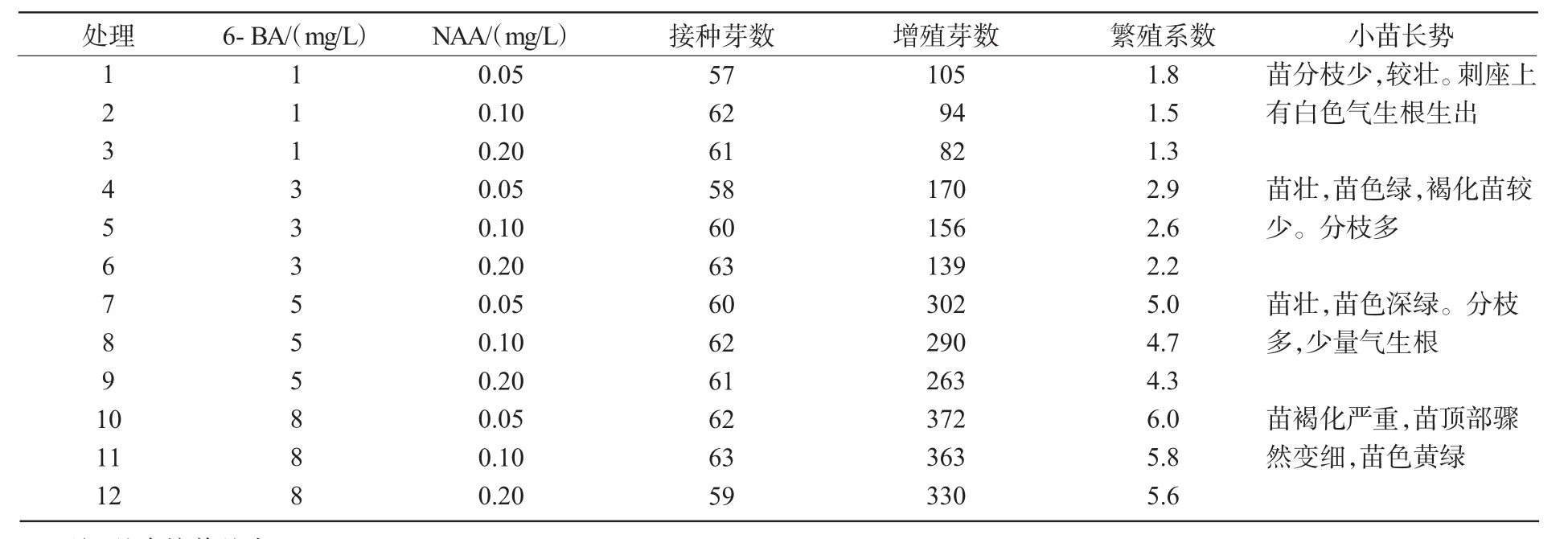
表4 不同培养基对芽增殖与生长的影响
2.5 不同培养基对火龙果生根的影响
从表5不同培养基对火龙果生根的影响可以看出,IBA在0~3 mg/L范围内,生根率和生根数随着浓度的升高而提高,尤其以1/2 MS+IBA 2.0 mg/L处理的生根效果最好,生根率为86.96%,平均每株生根数5条。培养7~10 d开始有气生根生出。当IBA质量浓度达4.0 mg/L时,对根的形成起抑制作用。结果还表明,IBA的生根效果比NAA好。添加活性炭(处理4)虽可减轻根的褐化,但与处理3相比,抑制了生根,因此,活性炭对生根没有益处。
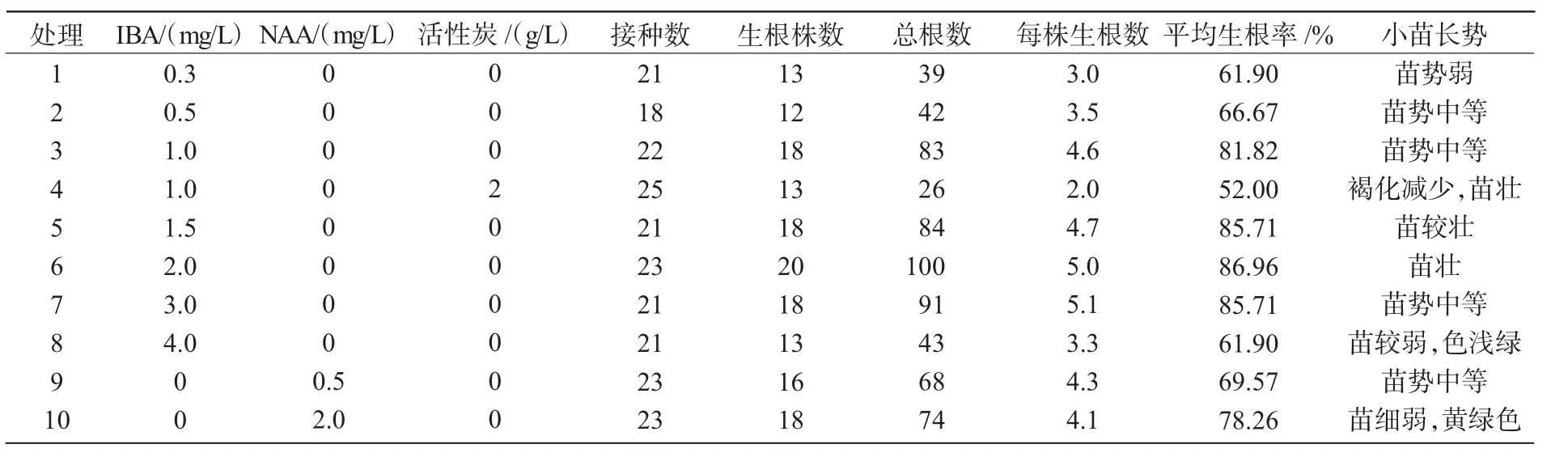
表5 不同培养基对火龙果生根的影响
3 结论与讨论
外植体表面灭菌的关键是选择合适的消毒剂和消毒时间,而消毒剂中,以升汞的杀菌能力最强、最常用,但它对外植体的伤害也最大,不易去除。消毒时间太长,外植体吸入升汞量较多,轻者会对外植体产生毒害,抑制细胞分裂和新陈代谢,使芽苗生长减弱,重者会使外植体中毒死亡。本试验结果表明,火龙果幼嫩茎段的灭菌以流水冲洗0.5 h+75%酒精30 s+0.1%升汞10 min处理最佳。污染多数在芽眼的丛刺处出现,这是由火龙果茎段芽眼处有成丛的叶刺,外植体不易清洗干净,消毒剂也较难透入,灭菌不彻底造成的。
在组织培养过程中,芽苗的发育受到细胞分裂素与生长素比例高低的调控,细胞分裂素能诱导不定芽形成,削弱顶端优势,促进侧芽的萌发;而生长素能促进细胞伸长,加强顶端优势。当细胞分裂素与生长素浓度比例适当时,二者能互相协同作用,有利于不定芽的形成。
本试验结果表明,不定芽诱导培养基以MS+6-BA 4.0 mg/L+NAA 0.1 mg/L最佳。当6-BA质量浓度为8 mg/L和NAA质量浓度为0.05 mg/L时,不定芽的繁殖系数最高;当6-BA质量浓度为1 mg/L和NAA质量浓度为0.2 mg/L时,不定芽生长较快、苗壮,因此,可以根据生产的需要交替使用这2种培养基。适宜的生根培养基为1/2 MS+IBA2.0 mg/L。
[1]张义勇,刘全国,魏奎.火龙果北方日光温室栽培技术[J].河北林果研究,2004,19(3):249-251.
[2]来宽忍,赵凯,史双院.火龙果生物学特性及北方栽培技术[J].西北园艺,2006(8):17-18.
[3]黄爱萍,姜帆,高惠颖,等.我国大陆火龙果引种栽培与利用现状[J].台湾农业探索,2005(4):44-45.
[4]吕春茂,范海延,姜河,等.火龙果日光温室引种观察及栽培技术[J].北方园艺,2003(1):19-20.
[5]赵志平,杨春霞.火龙果的开发与发展前景 [J].中国种业,2006(2):13-14.
[6]李梅,林德钦,张文珠.火龙果离体培养与快速繁殖[M].北京:中国科学技术出版社,2001.
[7]黄青峰.火龙果的棱片离体培养[J].福建农业学报,2002,17(3):9.
[8]黄青峰,余成章.火龙果的组织培养与快速繁殖[J].植物生理学通讯,2002,38(5):452.
[9]崔波,武思,蒋素华,等.火龙果茎段再生体系的建立[J].北方园艺,2011(8):146-147.
[10]陈广超,谢晓明.林燕绒.火龙果组培快繁技术[J].中国南方果树,2003,32(3):31.
[11]肖三元,梁国平.红掌组织培养及快速繁殖[J].云南热作科技,2000,23(2):12-13.
[12]余慧琳,张伟,朱一仪.红仙蜜火龙果茎段离体快繁技术研究[J].安徽农业科学,2009,37(9):3951-3952.
[13]王以红,陈平.红龙果离体器官芽分化的研究[J].广西热作科技,2000(4):14-15.
[14]杨巧云,邹琼,吕淑玉,等.日光温室火龙果栽培技术[J].河南农业科学,2004(1):58.
[15]周传明,黄寿先,熊英,等.火龙果茎段离体培养快速繁殖试验[J].广西科学,2002,9(1):78-80.
