昆虫CYP4基因家族多样性和进化
2012-10-22王小青
王小青,刘 婷
(长治市郊区农业委员会,山西长治046011)
CYP4基因家族属于P450基因超家族中的一个基因家族,P450超家族蛋白是一组膜上同工酶,主要功能是代谢一些外源的有毒物质及代谢和合成一些与生理功能有关的分子,如脂肪酸、前列腺素(prostaglandin,PG)、胆汁酸、胆固醇类的激素等[1],由于进化的压力,P450表现出很明显的多样性[2]。目前,昆虫中已鉴定出CYP4,CYP6,CYP9,CYP12,CYP18,CYP28 等 27 个家族,其中,除了CYP4家族外,全是昆虫特异性家族[4],这些基因家族都属于P450基因超家族。在已测出全序列基因组的黑腹果蝇(Drosophila melanogaster)中,P450 基因有 90 个,其中,超过1/2属于CYP4和CYP6家族[5]。脊椎动物和无脊椎动物都含有CYP4基因,CYP4基因家族是P450超家族中最古老的基因家族之一,起源于1 000多万a以前,早于脊椎动物和无脊椎动物分化[6],其主要代谢昆虫的内源物质(保幼激素、蜕皮激素、嗅觉有关的物质[7]等),部分成员也可能在代谢外源物质过程中起作用[8],如黑腹果蝇的 CYP4E2[9]、棉铃虫(Helicoverpa armigera)的CYP4G8等。
目前,研究昆虫P450的进化,CYP4是最好的材料。CYP4不是昆虫所特有的基因家族,它具有较高的多样性,可以通过其他动物的CYP4来确定进化的时间轴,有利于对分子进化机制的研究。植食性昆虫对寄主的专一性是同它降解植物毒素的能力密切联系的[10]。CYP4基因家族在昆虫与植物的相互作用中起着非常重要的作用,果蝇中的CYP4D10基因决定着其对一种仙人掌的寄主专一性[11]。所以,研究CYP4家族的进化不仅仅能够解释一定的进化机制,还能进一步明确昆虫与植物之间的关系,尤其是互利共生体系。
1 昆虫CYP4家族的多样性
长期的进化使得多样性在生物界广泛存在,如:物种的多样性、生物大分子的多样性、基因的多样性等。作为细胞色素P450超家族中的一员,CYP4家族随着进化也表现出了各种多样性。
1.1 昆虫CYP4家族拥有众多的亚家族及其成员和基因变异体
由表1可知,CYP4家族成员是非常庞大的,其中包含许多假基因。假基因是和功能基因在序列上极为相似,但是又不能产生具有功能的产物的基因。在果蝇的90个P450基因中,有7个假基因[5],在德国小蠊(Blattella germanica)中发现3个 CYP4C21假基因(CYP4C21P1,CYP4C21P2和CYP4C21P3)。还发现了P450的一些镶嵌基因,即所谓的这段序列既有P450的特征序列,又含有与P450毫不相干的序列。这些镶嵌序列的发现证明了内部DNA的交换确实存在[6]。

表1 CYP4家族成员
1.2 同一种昆虫不同生活史期各种CYP4基因表达不同
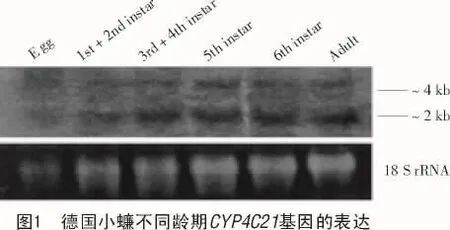
如火蚁中的CYP4AB1,CYP4AB2在成虫中的表达量明显多于蛹和幼虫[12],德国小蠊(Blattella germanica)中CYP4C21的nothern杂交结果表明,其在卵中的表达是十分微弱的,而在其他龄期虫体中具有相似的表达[13](图1)。
在摇蚊中,CYP4G33基因在蛹和成虫期的表达量较少,但是在各个虫期均有表达[14](图2)。

1.3 不同种属的昆虫CYP4亚家族成员不同
目前,对昆虫CYP4的研究主要集中在果蝇(Drosophila melanodaster)、按蚊(Anopheles gamibiae)、意大利蜜蜂(Apismellifera)等方面。已知从果蝇中鉴定的细胞色素P450CYP4家族的基因有:CYP4AC3,CYP4AA1,CYP4AC1,CYP4AC2,CYP4AD1,CYP4AE1,CYP4C3,CYP4D1,CYP4D2,CYP4D8,CYP4D14,CYP4D20,CYP4D21,CYP4E1,CYP4E2,CYP4E3,CYP4G1,CYP4G15,CYP4P1,CYP4P2,CYP4P3,CYP4S3;意大利蜜蜂中分离鉴定出 CYP4AA1,CYP4AV1,CYP4AZ1,CYP4G11[4]。在果蝇和蜜蜂中均有CYP4AA1基因,说明不同昆虫可以含有相同的CYP4家族成员,这与CYP6家族基因不同[15]。但有些CYP4家族仅存在于一种昆虫中,CYP4E仅存在于果蝇中,CYP4H仅在蚊子中发现[16]。
2 昆虫CYP4家族的进化
2.1 CYP4家族的自然进化史
20世纪80年代以来,古生物学和地质学的证据表明,地球上有细胞结构的生命至少在地质时代的太古宙早期即距今约35亿a前就已存在[17],而细胞色素P450作为呼吸链的主要成分,应该与此时间相一致。Feyereisen[16]提出,细胞色素P450早于大气中氧的积累。
昆虫中CYP4家族比其他昆虫细胞色素P450家族更接近于哺乳动物的CYP家族,因此,有可能CYP4家族是在哺乳动物与昆虫分化前通过基因复制产生的。
2.2 昆虫CYP4的进化机制
2.2.1 分子驱动假说 分子驱动用来解释新的CYP4形成。分子驱动是通过内部DNA的变动来改变种群的基因型的过程,这个过程是不受自然选择影响的。这种内部DNA的转换机制多种多样,包括基因复制、不等交换、基因的转换和颠换、滑动复制和RNA介导的转移等[13]。在昆虫中有许多基因簇,通常我们认为这些基因簇是同一个祖先基因经过基因复制和基因转化而来的[9]。
2.2.2 自然选择 CYP4基因超家族是植食性昆虫降解植物次生代谢物质主要的酶,所以,有一种假设认为,来自于植物次生代谢物质的选择压力是导致CYP4多样性的一个重要因子。但是现在有能证明这一假设的直接证据极少。研究寡食性及专食性昆虫可以为这一假设提供一定的数据[18]。Michael等[18]以2种凤蝶中CYP6B1的进化支持了以上假设。
2.2.3 动植物的协同进化 在昆虫与植物的共生关系中,一方面,植物利用次生代谢物质抵御其他植食性昆虫的侵入;另一方面,昆虫利用P450降解寄主植物产生的有毒次生代谢物质[19-20],正是在这种相互竞争的协同进化过程中,P450不断地向前进化。
3 研究昆虫CYP4家族进化的方法
对不同的P450分子间相互作用的早期研究是根据酶的催化活性、诱导性、免疫交叉反应、亚细胞定位等进行的,虽然这为阐明不同P450间的关系提供了重要的信息,但是在这方面的研究中,蛋白质和DNA的一级结构将包含更多的信息。随着CYP4家族研究的不断深入,一些重要的进化研究方法逐渐被应用于CYP4家族基因的研究。
3.1 基因不同部分的研究
3.1.1 外显子 外显子直接翻译成蛋白质,而最初研究P450基本上都是研究蛋白序列的,只是外显子反映的信息应该叫蛋白序列更准确,因为1个氨基酸对应3个密码子,而且多个三联体对应1个氨基酸[21]。
3.1.2 内含子 内含子曾经一度被视为“垃圾”,但是现在越来越受到进化学家的青睐,因为内含子不像外显子那样具有功能,受外界的选择压力和功能的限制要小得多,所以,内含子的进化基本上反映了DNA本身的进化,在进化的研究上更有意义[22]。P450的进化历史实际上就是内含子的获得和失去的历史[9]。
但是CYP4家族基因的内含子的进化研究的较浅,仅仅局限在长度和位置上的差异[23]。
3.1.3 启动子等其他功能片断 外显子和内含子的研究往往要求扩增出足够长的基因片段,但是由于试验技术或者试验材料的限制,经常只能拿到很小的一部分序列,这就要求将得到的序列进行充分有效地分析。Hung等[24]对CYP6B亚家族基因的启动子序列进行了研究,发现对1个物种中的CYP6B亚家族成员之间的比较可以为研究凤蝶中各个基因的进化的机制提供信息。所以,当只是拿到了目的基因的一部分时,可以考虑研究它的启动子、两端侧翼区等特殊的区域。
3.2 蛋白序列的研究
蛋白序列的研究与外显子的研究有一定的相似性,但是蛋白是最直接反映功能的生物大分子,可以运用生物信息学的方法来预测蛋白的高级结构[25],从而将蛋白和功能联系起来[26]。而功能又往往与环境有关,我们就可以间接地把蛋白与环境联系起来。地中海贻贝(Mytilus galloprovincialis)中的CYP4Y1的表达量就与外界的污染程度有关[27]。Li等[28]通过研究多食性和寡食性昆虫反抵御(counterdefense enzymes),结果发现,CYP6B8要比CYP6B1具有更灵活的空间折叠,更具有弹性的催化口袋和更多的底物识别渠道。
4 结语
目前,对CYP4家族基因的研究主要集中在进化上[23],且大多比较简单,如内含子的进化主要局限在位置和长度差异的研究上。Nelson[29]认为,研究进化时,仅仅比较序列来形成分支是不够的,有必要去研究其他的特征:内含子-外显子的界限,空间结构内部或者之间的插入和缺失、一些基因簇特定的结构。整个P450超家族基因都编码着功能蛋白,所以,通过一些蛋白结构预测软件对结构进行预测,建立结构进化树,也是将来CYP4家族基因研究的方向。再就是加强研究假基因、镶嵌基因、基因簇等,这些在整个细胞色素P450中是较多的。
[1]Negishi M,Iwasaki M.Structural flexibilityand functional versatility of cytochrome P450 and rapid evolution[J].Mutation Research,1995,350:43-50.
[2]Feyereisen R.Insect P450 enzymes[J].Annual Reviewof Entomology,1999,44(1):507-533.
[3]Wang H,Donley K M.Organization and evolution of the Cyp2 gene cluster on mouse chromosome 7,and comparison with the syntenic human cluster[J].Environmental Health Perspectives,2003,111(15):1835-1842.
[4]D R,Fonseca N da,Antunes R R A,et al.Structural divergence and adaptive evolution in mammalian cytochromes P450 2C[J].Gene,2007,387(1/2):58-66.
[5]Tijet N,Helvig C,Feyereisen R.The cytochrome P450 gene superfamily in Drosophila melanogaster:annotation,intron-exon organization and phylogeny[J].Gene,2001,262(1/2):189-198.
[6]Bradfield,James Y,Lee.Cytochrome P450 family 4 in a cockroach:Molecular cloning and regulation by hypertrehalosemic hormone[J].Proc Natl Acad Sci USA,1991,88:4558-4562.
[7]Maibeche-Coisne M,Jacquin-JolyE.cDNAcloningof biotransformation enzymes belonging to the cytochrome P450 family in the antennae of the noctuid moth Mamestra brassicae[J].Insect Mol Biol,2002,11(3):273-281.
[8]Anne J∅rgensen L J R,Ole Andersen.Characterisation of two novel CYP4 genes from the marine polychaete Nereis virens and their involvement in pyrene hydroxylase activity[J].Biochemical and Biophysical Research Communications,2005,336:890-897.
[9]Boris C Dunkov,RosarioRodriguez-Arnaiz.R.Cytochrome P450 gene clusters in Drosophila melanogaster[J].Mol Gen Genet,1996,251(3):290-297.
[10]Bassett M H,McCarthy J L.Sequence and developmental expression of CYP18,a member of a newcytochrome P450 family from Drosophila[J].Molecular and Cellular Endocrinology,1997,131:39-49.
[11]Frank MR,Fogleman J C.Involvement of cytochrome P450 in host-plant utilization by Sonoran Desert Drosophila[J].Proc Natl Acad Sci USA,1992,89:11998-12002.
[12]Liu N,Zhang L.CYP4AB1,CYP4AB2,and Gp-9 gene overexpression associated with workers of the red imported fire ant,Solenopsis invicta Buren[J].Gene,2004,327(1):81-87.
[13]Zhimou Wen,C E H,Jeffrey G Scott.CYP9E2,CYP4C21 and related pseudogenes from German cockroaches,Blattella germanica:implications for molecular evolution,expression studies and nomenclature of P450s [J].Gene,2001,272(1/2):257-266.
[14]Londono D K,Siqueira H A A.Cloning and Expression of an Atrazine Inducible Cytochrome P450,CYP4G33,from Chironomus tentans (Diptera:Chironomidae)[J].Pesticide Biochemistryand Physiology,2007,89(2):104-110.
[15]Claudianos C,Ranson H.A deficit of detoxification enzymes:pesticide sensitivity and environmental response in the honeybee[J].Insect Molecular Biology,2006,15(5):615-636.
[16]Feyereisen D W-R a R.Cytochromes P450:a success story[J].Genome Biology,2000,1(6):1-9.
[17]张昀.生物进化[M].北京:北京大学出版社,1998.
[18]Michale B Cohen,MA S,May R Berenbaum.A host-inducible cytochrome P450 from a host-specific caterpillar:Molecular cloning and evolution[J].Proc Nati Acad Sci USA,1992,89:10920-10924.
[19]Xianchun Li,Berenbaum M R.Molecular cloning and expression of CYP6B8:a xanthotoxininducible cytochrome P450 cDNAfromHelicoverpa zea[J].Insect Biochemistryand Molecular Biology,2000,30:75-84.
[20]Rewitz K F,Styrishave B.Marine invertebrate cytochrome P450:Emerging insights from vertebrate and insect analogies[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2006,143(4):363-381.
[21]Eric T Williams,A S R,Henry W Strobel.Defining relationships between the known members of the cytochrome P450 3A subfamily,includingfive putative chimpanzee members[J].Mol Phylogenet Evol,2004,33(2):300-308.
[22]Albert DGde Roos.Origins ofintrons based on the definition of exon modules and their conserved interfaces[J].Bioinformatics,2005,21(1):2-9.
[23]Tare`s S,J-B B.Amichot M.Cloning and expression of cytochrome P450 genes belonging to the CYP4 family and to a novelfamily,CYP48,in two hymenopteran insects,Trichogramma cacoeciae and Apis mellifera[J].Biochemical and Biophysical Research Communications,2000,268 (3):677-682.
[24]Hung,Chien-Fu,Holzmacher.Conserved promoter elements in the CYP6B gene family suggest common ancestry for cytochrome P450 monooxygenases mediating furanocoumarin detoxification [J].ProcNatlAcad SciUSA,1996,93:12200-12205.
[25]Baudry J,Li W.Molecular docking of substrates and inhibitors in the catalytic site of CYP6B1,an insect cytochrome P450 monooxygenase [J].Protein Engineering,2003,16 (8):577-587.
[26]Zhao Y,Halpert J R.Structure-function analysis of cytochromes P450 2B [J].Biochimica et Biophysica Acta,2007,1770(3):402-412.
[27]Jonsson H,Schiedek D,et al.Protein responses in blue mussels(Mytilus edulis) exposed to organic pollutants:A combined CYP-antibody/proteomic approach [J].Aquatic Toxicology,2006,78(suppl 1):49-56.
[28]Li X,Baudry J.Structural and functional divergence of insect CYP6B proteins:Fromspecialist togeneralist cytochrome P450[J].PNAS,2004,101(9):2939-2944.
[29]Nelson D R.Cytochrome P450 and the individuality of species[J].Archives of Biochemistry and Biophysics,1999,369(1):1-10.
