RNA干扰抑制人结肠癌SW480细胞EGFR的表达及其对体外生长情况影响的研究
2012-10-17林建安叶建新杨树钢
林建安,叶建新,杨树钢
(福建医科大学附属第一医院胃肠外科,福建福州350005)
表皮生长因子受体(epidermal growth factor receptor,EGFR)是cerb-B1基因编码的Src族跨膜受体,酪氨酸激酶是细胞外信号传递到细胞内的重要枢纽[1-2],在肿瘤发展过程中起重要作用,是治疗肿瘤的理想靶点,其靶向药物西妥昔单抗已经应用于临床且取得了良好的效果,但目前处于平台期;RNA干扰技术是将与信使RNA(mRNA)对应的外源性小片段RNA导入细胞,与该片段siRNA同源的mRNA发生特异性降解,导致其相应的基因受到抑制的技术,在剔除目标基因上具有特异性、稳定性及高效性等优势,正成为包括结肠癌在内各种肿瘤基因治疗研究中的热点[3]。本研究利用siRNA方法抑制人结肠癌SW480细胞EGFR基因的表达,并观察受抑制后人结肠癌SW480细胞体外生长情况的改变。
1 材料与方法
1.1 材料 人结肠癌细胞株SW480购于中国典型培养物保藏中心,RPMI-1640培养基和小牛血清购自GIBCO公司,EGFR抗体购自Santa公司,转染试剂LipofectamineTM2000和青霉素-链霉素液体购自Invitrogen公司,MTT购自Sigama公司,荧光定量RT-PCR试剂盒购自TaKaRa公司,细胞凋亡试剂盒购自南京凯基生物科技发展有限公司。EGFR-siRNA由上海吉玛制药有限公司合成。EGFR-siRNA干扰序列见表1。
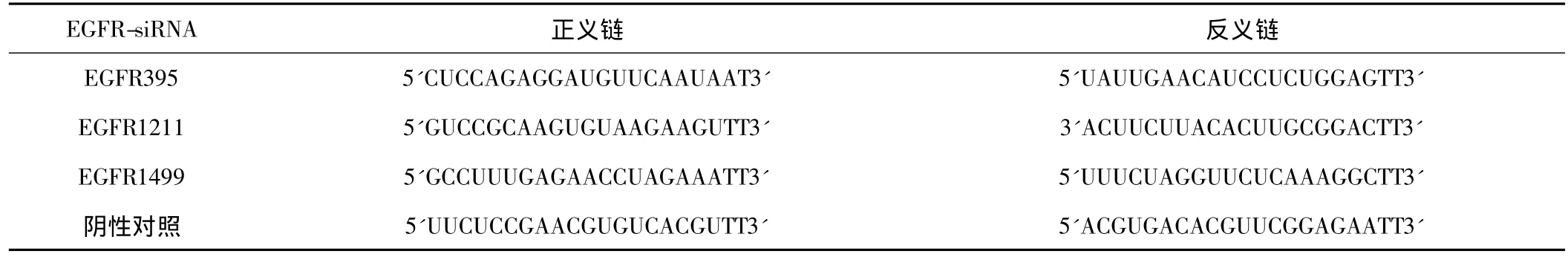
表1 EGFR-siRNA干扰序列
1.2 方法
1.2.1 细胞培养 采用含体积分数10%小牛血清的RPMI-1640培养基培养,细胞为贴壁生长细胞。细胞传代时用质量分数0.25%胰蛋白酶消化细胞,按1∶2或1∶3传代,加入培养液后在37℃,体积分数5%的CO2孵箱中培养。
1.2.2 转染 转染前一天收集3~5×105细胞接种在6孔板上,2 mL含 小牛血清的RPMI-1640细胞培养基,将稀释好的siRNA和RNAi-Mate试剂混合;轻柔混匀,室温放置 20 min,以便形成 siRNA/lipofectamin复合物。将6孔板中的细胞用无血清培养基冲洗细胞2遍后,加入2 mL无血清培养基,将500 μL siRNA/lipofectamin复合物加到含有细胞和培养基的培养板的孔中,来回轻摇细胞培养板,孵育4~6 h后,除去复合物,更换培养基,细胞继续在CO2培养箱中37℃温育24~48 h后,进行转染后的其他检测步骤。
1.2.3 荧光定量 RT-PCR TRIZOL法提取细胞总RNA,反转录为cDNA,应用Primer5.0设计引物扩增EGFR基因,上游引物 5'-GAGTTAAGATTTTTTTAAGGGTCCC-3',下游引物 5'-TAACTGACATGGGTCGGCC-3',内参基因 β actin,上游引物5'-TGACGTGGACATCCGCAAAG-3',下游引物 5'-CTGGAAGGTGGACAGCGAGG-3',反应体系为 SYBRⓇPremix Ex TaqTM(2 ×)10.0 μL,PCR Forward Primer(10 μmol·L-1)0.4 μL,PCR Reverse Primer(10 μmol·L-1)0.4 μL,ROX Reference Dye(50 ×)0.4 μL,DNA 模板2.0 μL,ddH2O(灭菌蒸馏水)6.8 μL,Total 20 μL;反应条件为95℃、30 s然后 95 ℃、5 s,57 ℃、30 s。本实验采用ABI step one PCR仪(美国生物应用公司产品)。每组实验重复3次,RT-PCR结果根据靶基因的相对定量按公式得出,靶基因相对表达量 =2-△△Ct。其中△△Ct=(△Ct,Q - △Ct,C)。△Ct,Q 为实验组靶基因的Ct值与管家基因Ct值之差;△Ct,C为对照组靶基因的Ct值与管家基因Ct值之差[4]。
1.2.4 Western blot法 提取待测细胞蛋白进行定量,将样品调成相同浓度,加入5×SDS凝胶加样缓冲液,进行SDS-聚丙烯酰胺凝胶电泳,转至PVDF膜上,将膜置于封闭液中于4℃封闭过夜以除去非特异的结合位点,然后一抗孵育,用含1×TBS,洗膜3次,再与二抗孵育,同上洗膜3次。将膜与CDP-Star作为碱性磷酸酶的化学发光底物,与膜室温下孵育反应5 min后,暗室中X光片曝光、显影。运用图像分析软件Qone对Western blot结果进行分析,以蛋白条带的灰度扫描比值来表示蛋白的相对表达水平及统计分析。
1.2.5 细胞生长增殖抑制率 采用四甲基偶氮唑蓝(MTT)比色法,待测细胞经胰酶消化后,调节细胞浓度约为5.0~10×104·mL-1;以每 5.0 ~1.0 ×103个细胞接种于4个96孔培养板中,每孔体积100 μL。设6个复孔,分别培养12、24、48、72 h后,每孔加入20 μL MTT(5 g·L-1),继续培养 4 h,加 200 mL DMSO,放置水平摇床15 min后,在490 nm处测定吸光度(A)。细胞生长抑制率=(对照组-处理组)/(对照组-本底)×100%
1.2.6 细胞凋亡检测 贴壁细胞用不含EDTA的胰酶消化收集;用PBS洗涤细胞2次(2 000 r·min-1离心5 min)收集1~5×105细胞;加入500 μL的Binding Buffer悬浮细胞;加入5 μL Annexin V-FITC混匀后,加入 5 μL Propidium Iodide,混匀;室温、避光、反应5~15 min;在1 h内,进行下述荧光显微镜或流式细胞仪的观察和检测。用流式细胞仪检测,激发波长=488 nm;发射波长=530 nm。Annexin V-FITC的绿色荧光通过FITC通道检测;PI红色荧光通过PI通道检测。
1.3 统计学处理 运用SPSS 13.0进行统计分析,计量资料以±s表示,比较采用单因素方差分析和LSD-t检验,检验水准 α =0.05。
2 结果
2.1 EGFR基因的表达 通过引物溶解曲线分析,EGFR基因扩增成功,实验所获得数据采用比较CT值法(2-△△t法)进行相对定量分析,实验结果示:EGFR395-siRNA和EGFR1499-siRNA对SW480细胞的mRNA表达与对照组比较差异有统计学意义(P<0.05)。见表 2、图1。
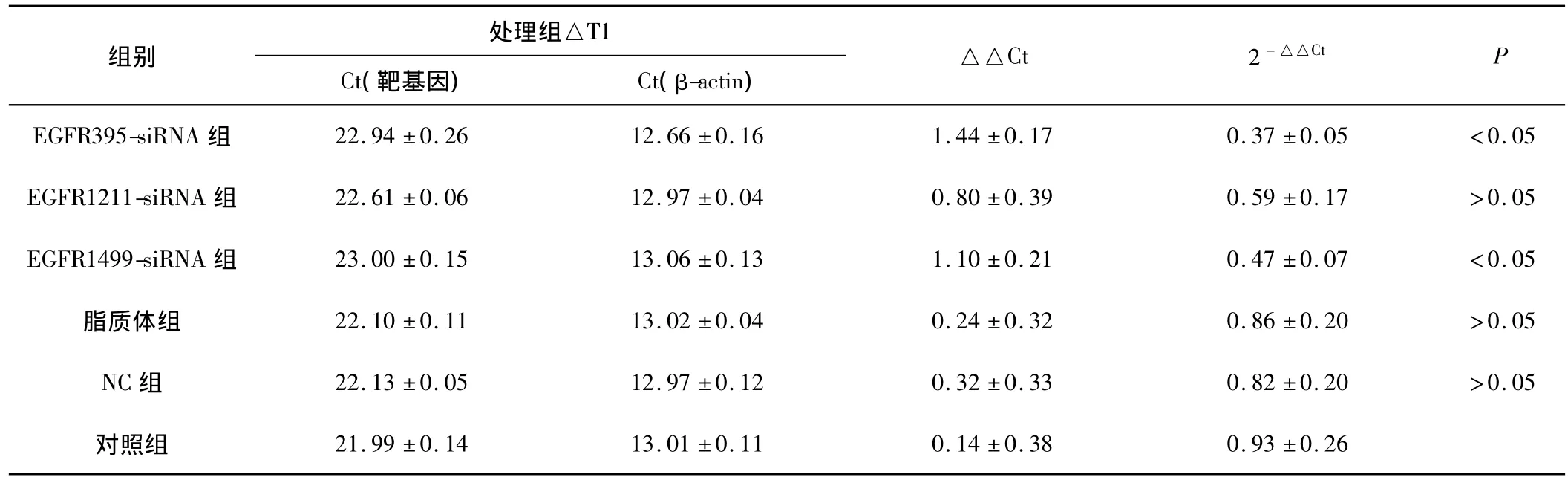
表2 RT-PCR检测各处理组靶基因抑制情况

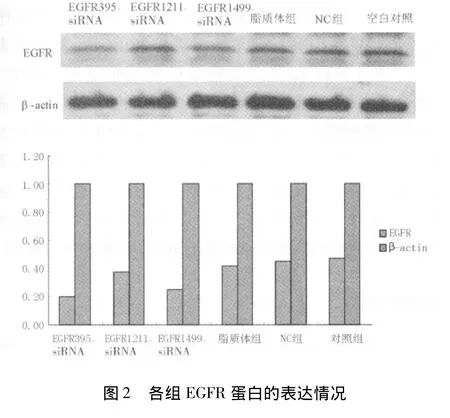
2.2 EGFR蛋白的表达 EGFR395-siRNA对EGFR蛋白表达较对照组有显著性抑制作用(P<0.05),EGFR395-siRNA对EGFR的表达较对照组抑制比较差别有统计学意义(P<0.05)。见图2。
结果显示,SW480细胞中的EGFR蛋白在EGFR-395和 EGFR1499-siRNA组的表达下调,EGFR-1211 siRNA和脂质体组、NC组、对照组的表达比较差异无统计学意义(P >0.05)。
2.3 细胞增殖抑制率 不同处理之后,EGFR395-siRNA和EGFR1499-siRNA作用于SW480细胞48 h后与对照组比较差异有统计学意义(P<0.05),但由于时间延长,本实验为瞬转,siRNA脱靶效应,抑制率逐渐下降。见图3。

2.4 EGFR-siRNA作用后细胞凋亡率 转染后各组细胞凋亡率分别为对照组(3.2±0.7)%,EGFR395-siRNA 组(15.8 ±1.2)%,EGFR1211 组(9.5 ±2.1)%,EGFR1499-siRNA 组(14.1 ± 1.7)%;EGFR395-siRNA和EGFR1499-siRNA组较对照组凋亡率均高,比较差异均有统计学意义(P均 <0.05)。见图4。

3 讨论
EGFR在很多肿瘤组织中过表达。有研究[5]表明70%以上的结肠癌组织中有EGFR高水平表达,EGFR高表达或活性增强与肿瘤增殖、侵袭、转移、抗凋亡及放化疗敏感度下降等许多特性有关,因此研究 EGFR及针对EGFR的治疗,成为近年来抗肿瘤治疗的热点。
RNA干扰是近年发展起来的沉默基因的新技术,其是指由双链RNA引发的转录后基因沉默机制,通过具有序列特异性的双链RNA或shRNA与靶基因mRNA结合而导致目的基因表达下调,RNA干扰具有高稳定性,高效性,高特异性等特点,目前RNA干扰在癌基因组功能研究和肿瘤基因治疗中已显示出效果。
结肠癌是常见的恶性肿瘤之一,近年来,随着人民生活水平的不断提高,饮食习惯和饮食结构的改变以及人口老龄化,我国结肠癌的发病率和死亡率均保持上升的趋势[6]。EGFR的研究已经取得重大突破,其靶向药物西妥昔单抗已经应用于临床且取得良好的效果,但目前处于平台期。由于肿瘤基因治疗较少涉及伦理问题,加之临床治疗的迫切需要,肿瘤发生的分子机制及其基因治疗也已走在基因治疗的前列。
本实验是EGFR与RNA干扰技术相结合,探索RNA干扰EGFR的mRNA后对SW480细胞的体外干扰情况的研究,通过RT-PCR、Western blot法检测到EGFR基因的mRNA和蛋白的表达明显抑制,证实序列特异性的EGFR-siRNA能显著抑制EGFR基因的表达,并通过MTT和流式细胞学检测细胞增殖与凋亡,表明siRNA可以抑制 SW480细胞的增殖,并促进SW480细胞凋亡。本文结果显示,以EGFR为靶点的RNA干扰能明显抑制 SW480细胞中EGFR基因的表达,调控细胞周期,促进细胞凋亡,为结肠癌的基因沉默疗法提供了新的思路,更为以 EGFR基因为靶基因的RNA干扰技术由基础到临床的应用提供理论依据。
[1]Su LK,Johnson KA,Smith KJ,et al.Association between wild type and mutant APC gene products[J].Cancer Res,1993,53(12):2728-2731.
[2]Nicholson RI,Gee JM,Harper ME.EGFR and cancer prognosis[J].Eur J Cancer,2001,37 Suppl 4:S9 - S15.
[3]冯作化,药立波,周春燕,等.医学分子生物学[M].北京:人民卫生出版社,2007:172,314
[4]Higuchi R,Fockler C,Dollinger G,et al.Kinetic PCR analysis:real-time monitoring of DNA amplification reactions[J].Biotechnology(NY),1993,11(9):1026 -1030.
[5]Wu X,Deng Y,Wang G,et al.Combining siRNAs at two different sites in the EGFR to suppress its expression,induce apoptosis,and enhance 5-fluorouracil sensitivity of colon cancer cells[J].J Surg Res,2007,138(1):56 -63.
[6]曾益新.肿瘤学[M].2版.北京:人民卫生出版社,2003:536-559.
