猪细小病毒体外培养适应毒株的培育及动物感染试验
2012-09-26李胜斌危艳武唐青海吴洪丽刘建波郭龙军王一平刘长明
李胜斌,危艳武,唐青海,吴洪丽,刘建波,郭龙军,王一平,刘 丹,刘长明
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室 猪传染病研究室,黑龙江哈尔滨150001)
猪细小病毒(Porcine parvovirus,PPV)可引发严重的繁殖障碍性疾病,初产母猪被感染后临床主要表现为不孕、流产、少产、死胎、木乃伊胎、畸形胎及弱仔等症状;仔猪和母猪被感染通常没有明显症状,但其体内很多组织器官均有病毒存在[1]。该病毒于1966年首次发现,1967年Cartwright F等[2]证明了其致病性。此后,许多养猪国家均有流行,猪群中病毒阳性检出率很高[1]。我国自20世纪80年代分离到PPV,流行病学调查证实猪群中该病毒的血清抗体阳性率达85%以上[3]。猪圆环病毒2型(PCV-2)是引起断奶仔猪多系统衰竭综合征(PMWS)的主要病原,该病于1991年在加拿大西部首次发现[4],对全球养猪业造成了巨大的经济损失[5-7]。有研究表明,PPV与PCV-2的混合感染是导致PMWS的主要原因。Choi C等[8]在有PMWS病例中检测到了 PPV;Allan G M 等[9]通过 PCV-2与PPV共感染试验猪成功地复制出PMWS病症。由此可见,PPV与其他病原体协同感染的致病性应引起重视。
PPV属于细小病毒科(Parvoviridae),细小病毒属(Parvovirus),是一种自主复制型病毒,无囊膜,外观呈圆形或六角形,病毒粒子直径约21 nm,20面体等轴对称。实心的病毒粒子在CsCl中的浮密度为1.39 g/mL,空心的为1.30 g/mL[1]。该病毒的基因组为单股线性DNA,大小约5 kb[10],分别编码3种结构蛋白(VP1、VP2、VP3)和3种非结构蛋白(NS1、NS2、NS3)。鉴于我国临床上PPV与PCV-2混感情况十分普遍,两种病毒间的协同致病性尚不清楚,二联疫苗也未见报道。本研究在PCV-2疫苗研制成功的基础上,从临床流产病料中分离到一株病毒,经聚合酶链反应(PCR)、免疫过氧化物酶单层细胞染色试验(IPMA)、免疫电镜、核酸序列分析等方法,证实该分离毒株为PPV。此后经细胞连续传代,获得一株细胞培育适应毒株。本研究为开展PPV与PCV-2协同致病性研究及联苗的开发开辟新途径。
1 材料与方法
1.1 材料
1.1.1 病料 初产母猪流产胎儿的淋巴组织。
1.1.2 细胞 猪睾丸传代细胞系(ST)由国外引进,经PCR检测无PCV、PPV和支原体污染。
1.1.3 主要试剂 细胞培养液 MEM为清大天一公司产品;犊牛血清(FBS)为PAA公司产品;D-氨基葡萄糖为Sigma公司产品;提取总DNA所用酚-氯仿为上海生工生物工程技术服务有限公司产品;辣根过氧化物酶-葡萄球菌A蛋白标记物(HRPSPA)为Zymed公司产品;KOD-Plus高保真PCR扩增试剂盒为Toyobo公司产品;PPV阳性参考血清购自中国兽医药品监察所,猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪传染性胃肠炎病毒(TGEV)和PCV-2阳性参考血清均由中国农科院哈尔滨兽医研究所相关课题组提供。
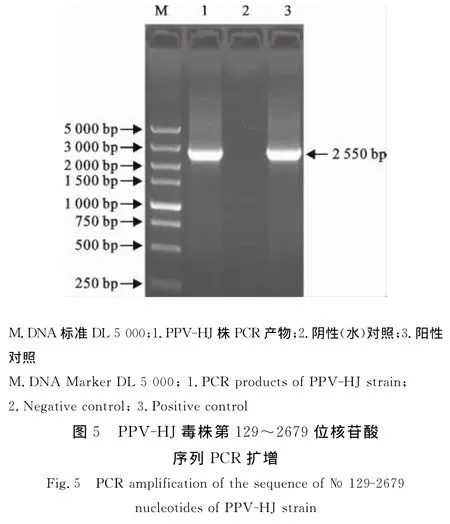
1.1.4 引物设计与合成 按GenBank登录的PPV参考序列 (NC001718,HM031134,GU978967,GU978965,EU790642,EU790641),采用 Oligo6.0软件设计PPV NS1基因的特异性引物序列。上游引 物 F129:5′-CATTGGCGTAAAAGAGGCGGGAA-3′,下游引物 R2679:5′-TGGTTGTTGAGATGTAGTTGGTGAG-3′,扩 增 的 目 的 片 段长度2 550 bp,引物合成由北京六合华大基因科技公司进行。
1.2 方法
1.2.1 病料处理 取母猪流产胎儿的淋巴组织病料研磨成100 g/L乳剂,加入MEM细胞培养液稀释,加入等体积氯仿振荡处理10 min,经4 000 r/min离心30 min取上清,0.22μm微孔滤膜除菌,置-20℃保存备用。
1.2.2 细胞培养 采用无外源病毒和支原体污染的猪睾丸传代细胞系(ST)进行病毒分离,细胞培养液为MEM,添加50 mL/L灭活犊牛血清,青霉素、链霉素各100单位/mL,按常规方法进行细胞培养传代。
1.2.3 病毒传代 将处理的病料乳剂,按100 mL/L同步接种到新消化的ST细胞悬液中,置体积分数为5%的CO2培养箱中,37℃静置培养24 h,吸出上清液,更换无血清的MEM培养液继续培养96 h~120 h,收取病毒培养物反复冻融3次,以此为毒种同步接种ST细胞盲传3代。采用IPMA法测定病毒含量。
1.2.4 血清学鉴定 采用IPMA法检测感染细胞中的病毒抗原,包括PPV、CSFV、PRRSV、PCV-2、PRV和TGEV,具体程序按文献[11]进行。
1.2.5 病毒含量测定 取不同代次的病毒培养物,作10倍系列稀释,同步接种96孔细胞培养板培养的细胞,每个稀释度设4孔,同设不加病毒的健康细胞作对照,置体积分数为5%的CO2培养箱中,37℃静置培养,接种病毒72 h后固定细胞,采用IPMA法检测各孔细胞的病毒感染情况,按Reed-Muench法计算半数细胞感染量(TCID50/mL)。
1.2.6 D-氨基葡萄糖对病毒增殖的影响 取病毒感染细胞培养物,分别按100、50、20、10、5、1 mL/L比例同步接种新消化的ST细胞悬液,同时添加D-氨基葡萄糖组(10 g/L)与未添加组,置体积分数为5% 的CO2培养箱中,37℃静置培养24 h,吸出上清液,更换无血清的MEM培养液继续培养96 h,收取病毒培养物反复冻融3次。采用IPMA法测定病毒含量。
1.2.7 免疫电镜观察 取病毒感染细胞培养物,PBS洗涤细胞3次,预留0.5 mL PBS冻融3次,12 000 r/min离心20 min,取上清,加入终浓度为10 mL/L的PPV阳性血清,混合,4℃感作过夜,12 000 r/min离心20 min,其沉淀物用0.1 mL的PBS液溶解,20 g/L磷钨酸液(p H6.8)负染制样,电镜观察病毒免疫复合物。
1.2.8 病毒增殖动力学测定 取病毒培养物按10 mL/L的接毒剂量,接种于单层ST细胞,置体积分数为5%CO2培养箱内,37℃静置培养,于接毒后4、8、12、16、24、36、48、60、72、84、96、120 h 固 定 细胞,采用IPMA法检测各孔细胞的病毒感染情况。
1.2.9 病毒DNA提取和PCR扩增 按常规方法[11]提取病毒DNA作为PCR模板,采用KODPlus高保真PCR扩增试剂盒(Toyobo产品,杭州)进行DNA扩增。PCR扩增条件为:94℃2 min;94℃30 s,58℃ 30 s,72℃ 5 min,35个循环;72℃10 min。PCR产物经10 g/L琼脂糖凝胶电泳鉴定。
1.2.10 核苷酸序列测定 将扩增的PCR产物克隆至p GM-T载体(天根生化科技有限公司),取纯化的重组质粒送北京六合华大基因科技股份有限公司测序,采用DNAMAN和MEGA 4软件进行序列分析与比对。
1.2.11 病毒回归动物试验 选用35日龄非免疫健康仔猪10头,经PPV抗体和抗原检测为阴性,取第50代病毒培养物(107.2TCID50/mL)经肌肉注射和滴鼻途径接种5头猪,每头肌肉注射1 mL,同时滴鼻1 mL,其余5头猪设为未接种对照组。试验猪隔离饲养,逐日观察临床反应,测定直肠温度,每周称量体重并采血。试验猪于攻毒后28 d处死,取心、肝、脾、肺、肾、扁桃体、腹股沟淋巴结、肠系膜淋巴结、下颌淋巴结和小肠的组织病料做病理学观察,利用PCR法检测病毒核酸。
2 结果
2.1 毒株培育
分离的PPV-HJ毒株经ST细胞传至第10代,病毒感染细胞出现明显细胞病变(CPE),病变细胞呈现圆缩、变形和脱落,细胞内出现包涵体(图1B),未接种病毒对照细胞无明显变化(图1A)。病毒经细胞传25代后,其在细胞上的适应性显著增强,第40~50代增殖能力达到稳定状态。
2.2 血清学鉴定结果
取PPV-HJ株第50代培养物感染ST细胞,经固定后进行IPMA法检测,结果如图2。病毒感染细胞呈棕红色,且核区较深,病毒抗原主要集中在细胞核区,细胞质中也有分布。感染病毒细胞与其他几种病毒阳性参考血清(CSFV、PRRSV、PCV-2、PRV和TGEV)无交叉反应,表明不存在这些病毒污染。

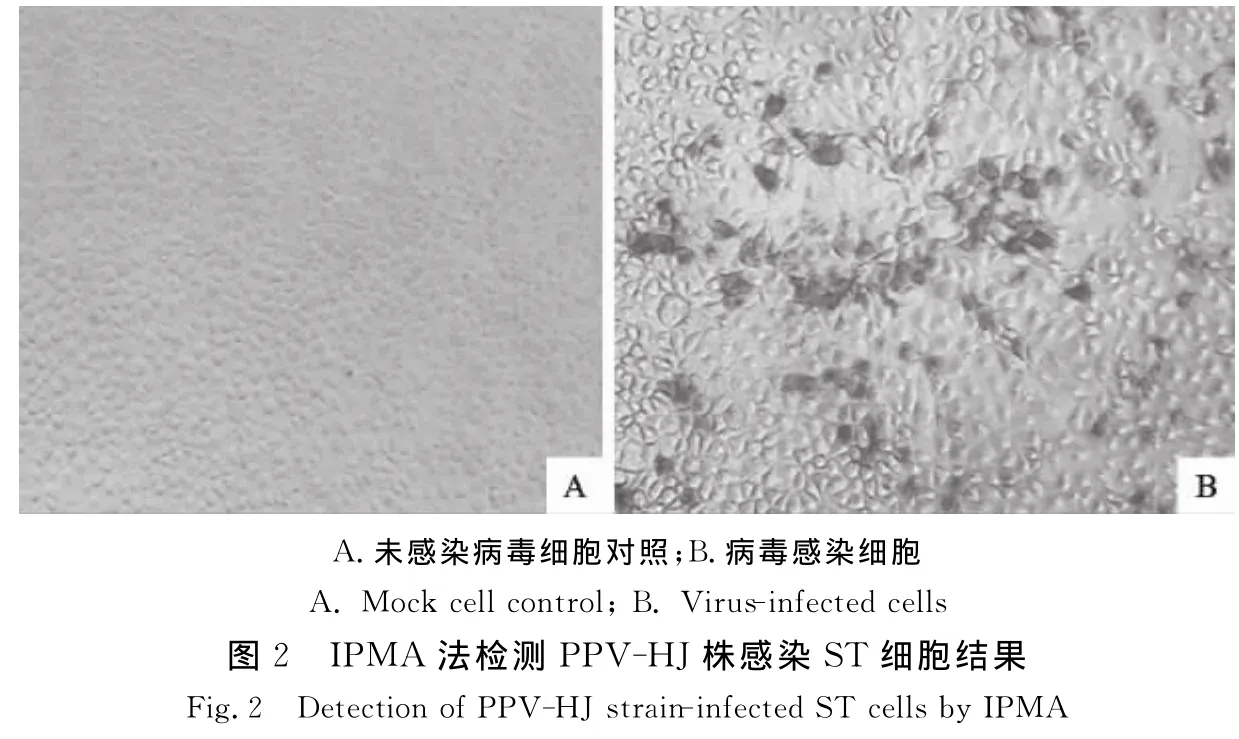
2.3 免疫电镜观察结果
取第50代病毒培养物,进行免疫电镜观察,可见形态均一的病毒粒子与抗体结合形成的免疫复合物,单个病毒粒子直径约21 nm,未见有其他外源病毒粒子混入(图3)。
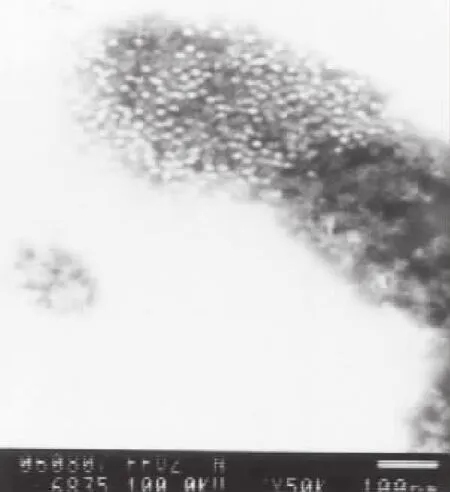
图3 PPV-HJ毒株免疫电镜观察Fig.3 Observation of PPV-HJ strain by immuno-electron microscope
2.4 传代毒病毒含量测定
PPV-HJ毒株经ST细胞传代,每5代取样测定病毒含量。该分离株在培养初期毒价较低,经细胞传代后毒价明显升高,尤以第40~50代,毒价稳定在107.2TCID50/mL,表明分离毒株已经适应体外细胞培养,能够保持良好的增殖性能。此外,我们验证了添加D-氨基葡萄糖对PPV-HJ株增殖的影响,添加组与未添加组毒价测定结果表明,该物质添加对病毒增殖具有明显的促进作用(图4)。

图4 添加D-氨基葡萄糖对PPV-HJ毒株毒价的影响Fig.4 Effect of D-glucosamine on the titers of PPV-HJ strain
2.5 病毒基因序列分析
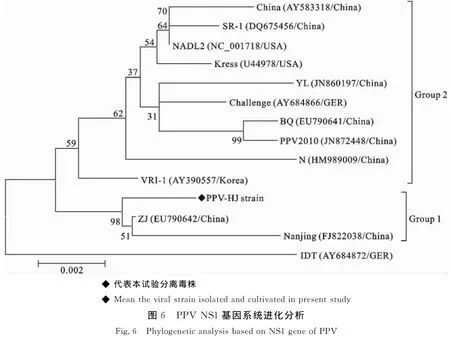
从PPV-HJ毒株第50代培养物提取病毒核酸,以PPV NS1基因特异性引物扩增第129位~2 679位核苷酸序列,扩增结果见图5,片段大小与预期一致。核苷酸序列分析表明,该毒株的NS1基因序列与GenBank登录的PPV-ZJ毒株(EU790642)序列相似性最高,其相似性达98.41%。此外,PPV-HJ毒株NS1基因序列与GenBank下载的其他13株PPV 序 列:China 株 (AY583318)、SR-1 株(DQ675456)、NADL2 株 (NC_001718)、Kress株(U44978)、YL 株 (JN860197)、Challenge 株(AY684866)、BQ 株 (EU790641)、PPV2010(JN 8 7 2 4 4 8)、N株 (HM 9 8 9 0 0 9)、VRI-1株(AY390557)、ZJ 株 (EU790642)、Nanjing 200801(FJ822038)和IDT 株(AY684872),绘制了 PPVNS1基因序列遗传进化树(图6)。在该遗传进化树中,IDT株(AY684872)单独形成一个进化分支。PPV-HJ株与中国的ZJ株(EU790642)和Nanjing 200801(FJ822038)处于同一个进化分支内(Group 1),其他毒株共同形成一个大的进化分支(Group 2)。
2.6 病毒增殖动力学测定
取PPV-HJ毒株第50代病毒接种细胞,对病毒感染细胞不同时间增殖动力学测定结果表明(图7),病毒接种后16 h能够检测到病毒感染阳性细胞,表明成熟的病毒粒子装配成功;24 h~36 h病毒感染阳性细胞逐渐扩散增多,表明子代病毒从细胞出芽释放;48 h~72 h病毒繁殖达到高峰,几乎所有细胞均被病毒感染;84 h~120 h,病毒感染细胞呈现圆缩、破碎、脱落,后期感染的阳性细胞仍可贴壁。
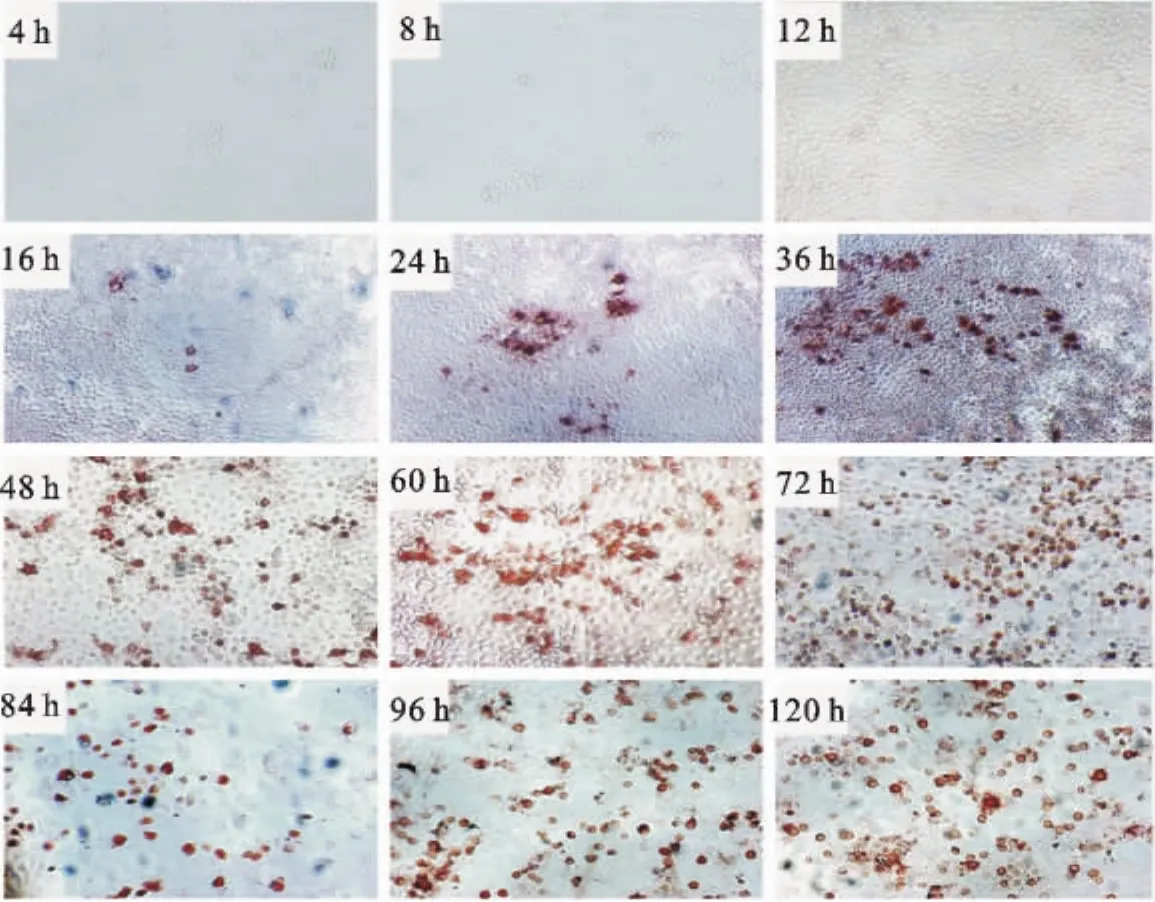
图7 PPV-HJ毒株感染ST细胞增殖规律的测定Fig.7 Determination of propagation rule of PPV-HJ strain in the ST cells
2.7 病毒回归动物试验
PPV-HJ毒株接种试验猪未见有明显的临床反应,也未出现发热症状;病毒接种后第7天可检测到病毒血症,持续到试验猪被处死。病毒接种后第14天可检测到血清抗体,持续到迫杀,但抗体效价较低(1∶50)。在试验过程中,未攻毒对照组试验猪无临床反应,PPV抗原与抗体检测均呈阴性结果。病毒接种28 d后处死试验猪,攻毒组猪各脏器未出现眼观可见病变,也未观察到明显的组织病理学变化。采用PCR方法对攻毒组猪的心、肝、脾、肺、肾、扁桃体、腹股沟淋巴结、肠系膜淋巴结、下颌淋巴结和小肠进行了病毒核酸检测。结果显示,攻毒组猪的肺脏、扁桃体、腹股沟淋巴结、下颌淋巴结、小肠中病毒的检出率显著高于心、肝、脾、肾、肠系膜淋巴结的检出率,结果如表1所示。未攻毒对照组试验猪全部脏器均为PPV核酸阴性。
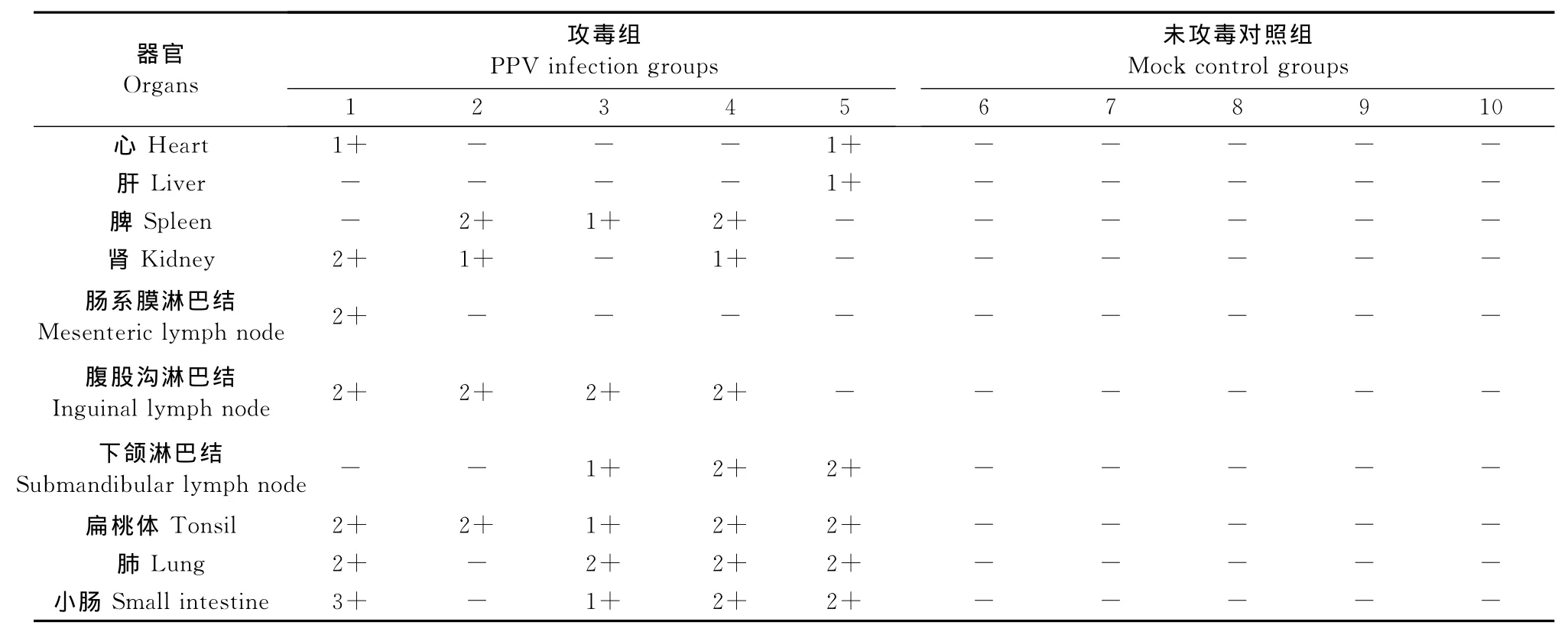
表1 PCR检测PPV-HJ病毒株人工感染试验猪组织中PPV核酸分布Table1 PCR test for the PPV nucleic acid distribution in organic samples from the experimentally infected pigs
3 讨论
本研究从临床病例中成功地分离到一株PPV,经过细胞传代培育成细胞适应毒株,命名为PPVHJ毒株。在病毒分离过程中,由于病料中存在多种病原,给PPV的分离带来了一定困难,本研究采用氯仿处理,将有囊膜的病毒去除,使之丧失对细胞的感染性,这样就可排除如CSFV、PRV等的干扰,有效地减少初代次病毒接种细胞时不良影响,提高病毒分离的成功率。有研究表明,PPV在ST细胞上的适应性和感染性最佳,且复制能力最强[12]。因此,本试验选择了ST细胞系对PPV-HJ毒株进行体外培养和传代。由于PPV的初代培养物感染ST细胞不出现细胞病变,所以检测病毒感染细胞中的抗原十分重要。本研究采用IPMA法检测病毒在感染细胞中抗原,可反映病毒在细胞培养中的增殖情况。研究表明,该方法具有操作简便,抗原定位准确,特异性强等优点,适用于病毒的定性和定量检测。随着PPV传代次数的递增,感染ST细胞开始出现CPE,同时病毒滴度也逐渐增加并趋于稳定。病毒增殖动力学表明,接种病毒后16 h能够检测到PPV感染阳性细胞,表明成熟的病毒粒子装配成功;24 h~36 h病毒感染阳性细胞逐渐扩散增多,表明子代病毒从细胞出芽释放;48 h~72 h病毒增殖达到高峰,几乎所有细胞均被病毒感染;84 h~120 h,病毒感染细胞呈现圆缩、破碎、脱落,后期感染的阳性细胞仍可贴壁。由于PPV粒子较小,常规电镜负染法观察不易确认,采用免疫电镜方法观察病毒免疫复合物,获得了满意的病毒形态学鉴定效果,观察到的PPV粒子大小及形态与文献报道基本一致[1]。
从病毒基因组序列分析结果看,PPV-HJ株的NS1基因与GenBank登录的PPV-ZJ毒株(EU790642)的NS1基因相似性最高,基于PPVNS1基因构建的系统发育树上,PPV-HJ株与中国的ZJ株(EU790642)和 Nanjing 200801(FJ822038)共同处于同一个较大的进化分支内,这一结果表明,PPV-HJ株很可能是由中国本地的PPV毒株经过自然选择演化而来的。有报道证实,PPV在多数细胞处于旺盛的有丝分裂期接种病毒最佳,这个时期许多细胞处于S期,即DNA合成期,细胞中的DNA聚合酶能够促进病毒复制[1]。因此,本试验采用病毒同步接种细胞进行传代,目的在于使病毒复制能够有效利用宿主细胞的酶类。Tischer I等[13]通过对PCV培养特征发现,D-氨基葡萄糖处理可显著增强病毒的增殖能力,这可能是由于该物质能够提高宿主细胞S期合成的DNA聚合酶量,或延长该聚合酶合成时间,其机制尚未阐明。本研究对PPV-HJ毒株感染的细胞中添加10 g/L的D-氨基葡萄糖,从结果看,处理后能够显著提升子代病毒滴度,表明该物质可促进PPV的增殖。
动物感染试验表明,该毒株接种试验猪,其体温保持正常,未表现明显的临床症状,这与先前报道基本一致[9,14]。该毒株接种后第7天能检测到病毒血症,第14天检测到血清抗体,病理学观察表明,感染猪脏器未观察到明显的病理变化,然而,采用PCR法在多种脏器中均检出有本病毒核酸存在,证明本试验培育的PPV-HJ毒株对易感动物仍具有感染性。国外相关报道证明,PCV-2与PPV混合感染可引起猪产生典型的 PMWS症状[9,14-15],PPV 单独感染能够引起严重的繁殖障碍性疾病,给养猪业造成了巨大的损失。为此,本研究获得的PPV毒株,为今后开展PPV与PCV-2共感染的致病机理的研究,以及联合疫苗的研制奠定了基础。
[1]韦 平,秦爱建.重要动物病毒分子生物学 [M].北京:科学出版社,2008:417-435.
[2]Cartwright F.Virus isolation is associated with herd infertility,abortion and stillbirth in pigs[J].Vet Rec,1967,81:169-197.
[3]吴清民.兽医传染病学[M].北京:中国农业大学出版社,2002:329-330.
[4]Chae C.Postweaning multisystemic wasting syndrome:a review of aetiology,diagnosis and pathology[J].Vet J,2004,168(1):41-49.
[5]Ellis,J A,Hassard L,Clark E,et al.Isolation of circovirus fromLesions of pigs with post-weaning multisystemic wasting syndrome[J].Can Vet J,1998,39:44-51.
[6]Allan,G M,Ellis J A.Porcine circovirus:a review[J].J Vet Diagn Invest,2000,12:3-14.
[7]Choi C,Chae C,Clark E G.Porcine postweaning multisystemic wasting syndrome in Korean pigs:detection of porcine circovirus 2 infection by immunohistochemistry and polymerase chain reaction[J].J Vet Diagn Invest,2000,12:151-153.
[8]Choi C,Chae C.Distribution of porcine parvovirus in porcine circovirus 2 infected pigs with postweaning multisystemic wasting syndrome as shown by in-situ hybridization [J].J Comp Pathol,2000,123(4):302-305.
[9]Allan G M,Kennedy S.Experimental reproduction of severe wasting disease by co-infection of pigs with porcine circovirus and porcine parvovirus[J].J Comp Pathol,1999,121:1-11.
[10]Molitor T W,Joo H S,Collett M S.Porcine parvovirus DNA:characterization of the genomic and replicative form DNA of two viruses isolates[J].Virology,1984,137(2):241-254.
[11]Liu C M,Ihara T,Nunoya T,et al.Development of an ELISA based on the baculovirus-expressed capsid protein of porcine circovirus type 2 as antigen [J].J Vet Med Sci,2004,66(3):237-242.
[12]Oraveerakul K,Choi C S,Molitor T W.Restriction of porcine parvovirus replication in nonpermissive cells[J].J Virol,1992,66(2):715-722.
[13]Tischer I,Peters D,Rasch R,et al.Replication of porcine circovirus:induction by glucosamine and cell cycle dependence[J].Arch Virol,1987,96:39-57.
[14]Kennedy S,Moffett D,Mc Neilly F,et al.Reproduction of lesions of postweaning multisystemic wasting syndrome by infection of conventional pigs with porcine circovirus type 2 alone or in combination with porcine parvovirus[J].J Comp Pathol,2000,122:9-24.
[15]Allan G M,Mc Neilly F,Ellis J,et al.PMWS:experimental model and co-infections[J].Vet Microbiol,2004,98(2):165-168.
