3个毛白杨病程相关蛋白基因的克隆及表达1)
2012-09-18张志毅刘文凤安新民林善枝
雷 杨 张志毅 刘文凤 王 兴 安新民 林善枝
(林木育种国家工程实验室(北京林业大学),北京,100083)
郑会全
(广东省林业科学研究院)
植物在自然界往往受到各种生物与非生物胁迫的不利影响,因此经过漫长演化过程,产生了一系列复杂的防御机制。病程相关蛋白(pathogenesis related proteins,PRs/PRP)是植物在各种病原物的侵染及所引起的相关胁迫(病原菌、线虫、昆虫、食草动物等生物胁迫),以及模拟病原物侵害效应或类似胁迫的化学试剂(水杨酸(SA)、乙烯(ET)、脱落酸(ABA)、茉莉酸(JA)等激素)的施用下诱导产生并积累的一类蛋白质的总称,可作为下游防卫基因,是植物防卫反应体系的重要组成部分[1-2]。PRP最初由Van Loon等[2]从被烟草花叶病毒侵染的烟草叶片中分离获得,随着研究的深入,人们发现PRs广泛存在于不同植物中,并逐渐形成了以蛋白序列的同源性、等电点、电泳迁移率(相对分子质量)、植物来源、生理活性以及血清学关系为标准的分类体系,进而将其分为17个家族[3-4]。其中PR-1虽具有抗真菌活性,但功能和作用机制至今未知[5];PR-2具有 β-1,3-葡聚糖酶活性,PR-3、PR-4、PR-8 和PR-11具有几丁质酶活性,可抵御真菌;PR-5为类奇甜蛋白;PR-6为蛋白酶抑制剂,能够防御昆虫和线虫;PR-7、PR-9、PR-10 分别为蛋白酶、过氧化物酶和核酶;PR-12~PR-16分别由防御素、硫素、转脂蛋白、草酸氧化酶和类草酸氧化酶组成;PR-17含有类似锌蛋白酶活性位点的序列,但具体功能未知。
尽管目前已从众多物种中分离获得 PRs,但PRs受诱导表达在物种间差异很大,并非所有的PR家族均存在于每一物种中;而且以往研究多集中于拟南芥、烟草、水稻、大麦、玉米、苜蓿等草本植物。杨树作为木本模式植物[6]和重要的人工栽培林树种,其抗病研究一直是林木抗逆育种的热点。毛白杨(Populus tomentosa Carr.)是我国特有的白杨派乡土树种,具有分布广、速生、抗逆性强、材质优良等特性[7]。因此,本文以毛白杨为试材,经过SA和Me-JA诱导处理,分离获得多个编码病程相关蛋白的基因序列,并运用生物信息学和实时荧光定量PCR技术,对基因结构和诱导表达水平进行比较分析,从中探讨木本植物病程相关蛋白的功能及抗病信号传导网络对防卫反应基因表达的调控机理。
1 材料与方法
用于诱导处理的毛白杨组培苗保存于北京林业大学林木花卉遗传育种教育部重点实验室和林木育种国家工程实验室。将组培苗移栽至土壤中2个月后,选取生长状态一致的植株作为试验材料。
材料处理:以移栽2个月后的毛白杨植株为试材,向每株叶片完全展开的区域(2~4叶片间)分别喷洒10 mL外源SA溶液(5 mmol/L)和MeJA溶液(200 μmol/L),以喷洒相同体积的双蒸水(ddH2O)为对照。各种处理后的材料用透明袋密封,在处理6、12、24和48 h后,分别采集处理过的叶片。
总DNA与总RNA的提取及第一链cDNA的合成:对采集的经处理叶片分别提取总 DNA和总RNA。总 DNA的提取采用 Tiangen植物基因组DNA 提取试剂盒(Tiangen Biotech Co.,Ltd.,Beijing);总 RNA的提取依照 SV Total RNA Isolaton System 试剂盒(Promega Biotech Co.,Ltd.,USA)的方法进行。以总RNA为模板,采用Reverse Transcription System(Promega Biotech Co.,Ltd.,USA)合成第一链cDNA。
RT-PCR引物设计和扩增:通过分析杨树基因组数据库,获得病程相关蛋白基因PR-1、PR-5、PR-10的电子克隆序列,据此设计引物,如表1所示。PCR 扩增体系为 25 μL(其中 cDNA 2 μL,MgCl21.5 mmol/L,dNTPs 0.8 mmol/L,上下游引物各 0.4 μmol/L,Taq酶1.25 U)。反应程序为:94℃预变性4 min;94℃变性30 s、58℃退火30 s、72℃延伸40 s,循环35次;72℃延伸10 min。反应产物通过1.1%琼脂糖凝胶电泳检测并进行分离回收和纯化。
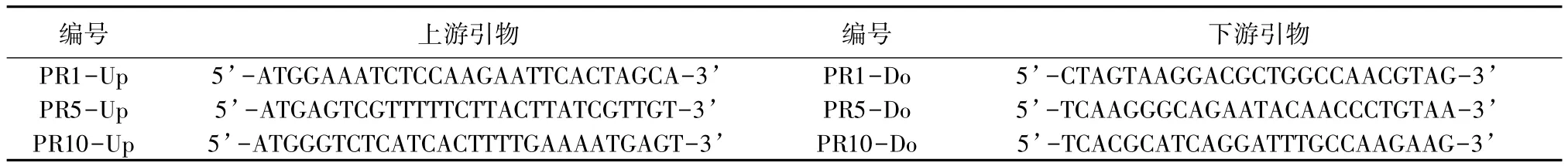
表1 用于RT-PCR反应的引物序列
克隆与测序:将PCR回收产物与pGEM-T载体连接,转化Top10大肠杆菌后,利用菌落PCR扩增辅以蓝白斑筛选鉴定阳性克隆。将阳性克隆单菌落摇菌,送GENEWIZ公司测序。
生物信息学分析:测序结果先通过DNASTAR Lasergene v7.1推测出蛋白序列,再经NCBI(http://www.ncbi.nlm.nih.gov/)和 SMART(http://smart.embl-heidelberg.de/)分析同源性和蛋白序列保守结构域,SWISS-MODEL(http://swissmodel.expasy.org/)模拟蛋白三维结构[8-10]。使用 ClustalX2.0、BioEdit7.01 和 MEGA4.1,采用邻接法(Neighbor-Joining,N-J)构建系统发育树,并使用1000次重复的自展检验评估系统发育树拓扑结构的稳定性。此外,通过 CBS(http://www.cbs.dtu.dk/index.shtml)在线分析信号肽、磷酸化位点等信息。
实时荧光定量RT-PCR分析:将不同处理的毛白杨叶片总RNA分别合成第一链cDNA后,通过DNA Engine Opticon 2 Real-Time Cycler荧光定量分析仪使用SYBR Premix ExTaq试剂盒(TaKaRa Biotechnology(Dalian)Co.,Ltd.,Dalian),采用 SYBR Green I相对定量法对病程相关蛋白基因的表达进行分析。选用ACTIN作为内参基因,引物序列参照Regier等[11];对应不同的病程相关蛋白基因的qRTPCR引物的设计,参照Rinaldi等[12],并由 Invitrogen公司合成,序列如表2所示。

表2 用于qRT-PCR反应的引物序列
2 结果与分析
2.1 毛白杨病程相关蛋白基因的克隆与分析
2.1.1 PtPR-1 基因序列的分析
毛白杨PR-1基因(HM589199)无内含子(图1),读码框为486 bp,可编码一个161aa的前体蛋白,包含136aa的成熟肽和一段25aa的信号肽。去除信号肽的成熟PtPR-1蛋白,包含一个SCP结构域,分子量为14.6 KD,等电点为8.24,为碱性蛋白。经预测后分析,PtPR-1蛋白序列中无糖基化位点,而其磷酸化位点可能位于3处丝氨酸(Ser28、128、150),2处苏氨酸(Thr66、121)和 6处酪氨酸(Tyr32、57、78、105、107、120)(图 2)。

图1 毛白杨病程相关蛋白基因PR-1、PR-5、PR-10的PCR扩增

图2 PtPR-1、PtPR-5、PtPR-10 基因序列分析
多重序列比对结果显示,虽然信号肽序列差异显著,但毛白杨PR-1前体蛋白序列的相似度与其他物种相比仍保持在很高的水平,分别为拟南芥(Arabidopsis thaliana,P33154.1)63%、马铃薯(Solanum phureja,Q08697.1)53%、西洋接骨木(Sambucus nigra,Q41359.1)62%、烟草(Nicotiana tabacum,P07053.1)60%(图3)。系统发育树分析结果表明,多物种间PR-1家族同源性很高(图4)。另外,PtPR-1前体蛋白中的信号肽为α螺旋结构,而模拟的成熟蛋白结构含有3个α螺旋、4个β折叠结构、6个半胱氨酸形成3个二硫键(图4)。

图3 PtPR-1、PtPR-5、PtPR-10 氨基酸序列多重比对
2.1.2 PtPR-5 基因序列的分析
毛白杨PR-5基因(HM589200)无内含子(图1),读码框为678 bp,可编码一个225aa的前体蛋白,包含200aa的成熟肽和一段25aa的信号肽;而去除信号肽的成熟PtPR-5蛋白(分子量21.7KD、等电点6.21),为酸性蛋白,包含一个THN结构域,其核心结构为 G-x-[GF]-x-C-x-T-[GA]-D-C-x-(1,2)-G-x-(2,3)-C[13-14]。经预测分析,PtPR-5蛋白序列中可能的磷酸化位点位于3处丝氨酸(Ser5、123、161),2 处苏氨酸(Thr73、105)和 2 处酪氨酸(Tyr176、200)(图2)。与其他物种PR-5家族序列多重比对后发现,除信号肽序列显著差异外,毛白杨PR-5前体蛋白序列与拟南芥(Arabidopsis thaliana,NP_177641.1)、沙梨 (Pyrus pyrifolia,BAC78212.1)、地中海柏木(Cupressus sempervirens,AAR21075.1)、烟草渗透素(Nicotiana tabacum osmotin,P14170.2)以及烟草 PR-5d(Nicotiana tabacum PR-5d,P25871.1)的相似性分别为 45%、39%、48%、67%和62%(图3)。另外,PtPR-5前体蛋白中的信号肽为α螺旋结构,而模拟的成熟蛋白包含17处卷曲(几乎全部暴露在蛋白分子外侧)、6个β折叠结构近似排列成桶状(全部位于蛋白内部)、且有17个半胱氨酸形成二硫键(图4)。

图4 PtPR-1、PtPR-5、PtPR-10蛋白序列的系统发育树及其三维结构模拟图
2.1.3 PtPR-10 基因序列的分析
毛白杨PR-10基因组序列大小为574 bp包含了一个91-bp的内含子序列(图1),开放阅读框为483 bp(HM589201),可编码一个分子量17.9 KD、等电点4.82的160aa蛋白,为酸性蛋白,包含一个Bet_v_1结构域。经预测分析后发现,PtPR-10蛋白序列中可能的磷酸化位点位于3处丝氨酸(Ser38、41、85),4 处苏氨酸(Thr53、58、109、121)和 4 处酪氨酸(Tyr82、102、122、139)(图 2)。多重序列比对分析结果表明,毛白杨PR-10蛋白序列相似性一般,例如欧洲白桦(Betula pendula,CAB94733.1)46%、刚毛柽柳(Tamarix hispida,ACK38253.1)40%、加州山松(Pinus monticola,AAL49994.1)28%、苹果(Malus domestica,AAS00053.1)32%、刺茄(Solanum virginianum,AAU00066.1)41%(图 4)。另外,蛋白模拟结构如图4所示,PtPR-10主体结构为7个β折叠、2条长短不一的α螺旋和1个双硫键。
2.2 PtPR-1、PtPR-5 和 PtPR-10 的诱导表达分析
为了研究SA、MeJA诱导处理对毛白杨的转录水平表达变化的影响,本实验采用实时荧光定量PCR的方法分别对诱导处理不同时间后的PtPR-1、PtPR-5和PtPR-10的基因表达量进行检测。结果如图5所示,PtPR-1在SA诱导下初始表达水平较低,24 h后表达量显著增加,48 h后已迅速升高约为初始水平200倍。另外,在MeJA处理下,PtPR-1呈先高后低再剧增的特征,初期PtPR-1表达量开始升高(于6 h后达到小高峰、约为初始水平100倍),12 h后降至接近初始水平,但在随后诱导24至48 h期间其表达水平剧增至约为初始水平的400倍。
与PtPR-1相比,PtPR-5无论在SA还是MeJA诱导下表达量均相对较低(图5)。PtPR-5的表达受SA诱导影响,呈先高后低再恢复初始水平的波动特点;在MeJA影响下,PtPR-5表达先降低再恢复初始水平。
PtPR-10的诱导表达模式与 PtPR-1、PtPR-5均有所不同(图5)。在SA作用下,PtPR-10表达量有所提高,6 h即达到最高值,随后呈缓慢递减趋势;而在MeJA诱导下,PtPR-10表达水平不断升高,这与PtPR-1受SA诱导表达模式相似,但增长曲线更加平缓、且增长值也较小。
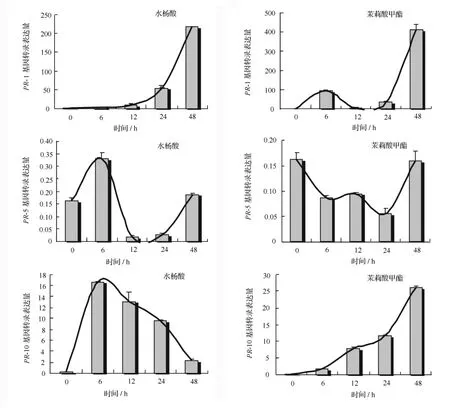
图5 水杨酶、抹莉酸P酯诱导处理对毛白杨PR-1、PR-5和PR-10的转录水平变化的影响
3 讨论
植物受病原菌侵染后,局部受感染部分细胞迅速凋亡,进而激发植物体对后续病原物产生广谱、持久和系统的抗性,即所谓的系统获得性抗性(Systemic acquired resistance,SAR)[15]。SA 是植物体内含量较低的一种内源酚类物质,目前已有大量实验证实,SA是诱导SAR的关键信号分子,可抑制过氧化氢酶(CAT)和过氧化物酶的活性而造成H2O2的累积[16-18]。H2O2一方面作可为强氧化剂而能直接抵御病原菌的侵害,但对植物体自身也造成较大的毒害作用;另一方面,H2O2与活性氧的积累对防卫反应基因的激活可起着第二信使的作用。另外,JA及其挥发性衍生物MeJA不仅影响植物体的生长发育,而且也是种创伤诱导的内源信号分子,可启动相关防卫基因的表达。目前已有报道,植物主要依靠SA、JA等多种信号通路间的“crosstalk”互作机制,调控包括病程相关蛋白基因在内的大量防卫反应相关基因的表达,在植物基础免疫系统中发挥这重要作用[19]。
烟草PR-1蛋白相关研究证实,PR-1家族分为碱性蛋白和酸性蛋白两种形态,其中酸性PR-1蛋白分布在细胞间隙,受SA信号通路诱导表达;而碱性PR-1蛋白则分布在液泡中,受JA/ET信号通路诱导[20-24]。在本研究中,对毛白杨 PtPR-1 的 N端信号肽、C端糖基化位点和分子量等进行分析,结果均显示为典型的酸性PR-1蛋白特征,但等电点分析显示为偏碱性蛋白。Ward等[25]研究后发现,同时施用SA和MeJA的混合物,酸性PR-1的诱导表达量明显高于单独施用SA时的水平。由此可推测,毛白杨PtPR-1可能兼具PR-1家族酸性蛋白和碱性蛋白的特点,在SA和MeJA处理下均受诱导表达。目前,众多研究证实,NPR1(nonexpressor of pathogenesis-related genes 1)是SAR信号转导途径中作用于SA下游的关键性调控因子,而SA可诱导细胞内氧化还原态发生变化,无活性的NPR1寡聚体可被还原激活为NPR1单体,并转运至细胞核内与结合在PR基因启动子区的转录因子TGA互作激活 PR-1 基因[26-30]。同时,Petersen 等[31]通过对拟南芥MAPKs通路的研究后发现,AtMPK4蛋白元件既可作为负调节因子下调植物体SA水平而抑制SAR,又可作为正调节因子激活JA响应基因的表达。本实验中施用高浓度外源SA后发现,毛白杨体内SA水平提高,推测可能是在NPR1介导下促进了毛白杨PtPR-1的表达,而毛白杨体内SA水平增高可造成H2O2积累及氧迸发,可能激发MAPKs通路中SA的负调控因子下调内源SA的水平,进而减弱了PtPR-1的表达,但同时也激活了JA响应基因的表达。Creelman等[32]实验发现,SA-JA 在低浓度时存在协同作用,并且SA对JA的诱导作用强于JA对SA的诱导作用;Repka等[33]研究也证实SA处理可促进JA生物合成的一个关键酶AOS(丙二烯氧化物合酶)基因的表达;Rao等[34]发现在臭氧诱导的细胞死亡过程中,JA能抑制SA的生物合成和氧的迸发,从而减弱由SA引起的细胞死亡。据此推测,正是在减弱和增强双重作用下,本实验中毛白杨PtPR-1基因表达量增长缓慢,但随着SA诱导时间的延长,初期毛白杨对内源SA的抑制作用趋于相对饱和,而持续高浓度的SA对PtPR-1诱导作用逐渐增大,同时内源JA积累量提高或许也有助于促进PtPR-1表达量的迅速放大。
另外,外源MeJA(50 μmol/L)能诱导大部分植株或悬浮培养细胞中合成SA的关键酶PAL的mRNA 的合成和酶活性的提高[33];但 Leon-Reyes等[35-36]对拟南芥 npr1突变体进行比较研究后发现,细胞质中的NPR1单体通过作用于JA合成途径的下游,在SA-JA“crosstalk”中发挥拮抗作用而抑制JA响应基因的表达。因此,MeJA胁迫处理后的毛白杨植株,在促进PtPR-1表达同时,也可通过诱导SA合成酶基因PAL的表达而提高体内SA水平,进而发挥拮抗作用;但由于MeJA对SA的诱导作用相对较弱,而SA积累缓慢致使在处理初期对MeJA信号通路的拮抗作用并不显著[32],这可能正是本研究中PtPR-1表达量保持增长趋势的原因所在。目前,Mao等[37]研究显示,拟南芥 WRKY62转录因子作用于细胞质中NPR1的下游并且负调控JA通路应答基因的表达,说明其很可能参与NPR1介导的SA对JA信号通路的拮抗过程。由此推测认为,初期随着毛白杨体内SA积累量的提高,可能使得WRKY转录因子及NPR1介导拮抗作用的增强而降低PtPR-1表达量;但由于外源高浓度MeJA所造成的持续诱导效应强于内源SA对MeJA的拮抗,最终可促进PtPR-1表达量迅速恢复提高。
PtPR-5含有一个thaumatin保守结构域(THN结构域),与奇甜蛋白具有较高同源性,属于PR-5蛋白家族中类甜蛋白(Thaumatin-Like Protein,TLP)。蛋白结构分析显示,PtPR-5至少具有8个二硫键,说明其稳定性相对较高,可对蛋白酶具有很强的耐受性。另外,有些研究证实,PR-5能够直接插入真菌细胞膜形成穿孔而造成水涌入细胞引发渗透性破裂,进而起到裂解孢子、抑制孢子萌发和菌丝生长的作用,表现出抗真菌活性[38,14]。但本研究发现,PtPR-5受SA和MeJA诱导作用并不显著,这说明并非所有PR-5蛋白均能发挥活性,因此,PtPR-5蛋白在响应多种胁迫诱导以及植物与微生物互作中的功能有待于进一步深入研究。
PtPR-10内部含有一个高度保守的“P-LOOP”基序(G-x-GG-x-G-xx-K),广泛存在于磷酸化激酶和核酸结合蛋白的结构域[39],该区域的磷酸化可能与其核酸酶活性相关[40-41]。目前,从桦树、棉花、辣椒、刺茄和花生中分离纯化的PR-10均证实具有体外核酸酶活性[42-46],而从西芹、苜蓿和马铃薯中分离得到的 PR-10 却无体外核酸酶活性[47-49]。Chadha和 Das[43]研究认为,AhPR-10 蛋白通过主动运输进入细胞后而发挥核酸酶活性降解核酸,进而杀死病原菌;此外,PR-10所包含的Bet_v_1结构域还能够与细胞分裂素、脂肪酸和黄酮类物质相结合,进而参与类固醇激素介导的植物防御反应或生长发育调控[50-51]。本研究结果发现,PtPR-10 表达量于SA处理6h后即达到最高值,而随后呈缓慢递减趋势;但PtPR-10表达水平却随着MeJA诱导时间的延长而不断升高,因此,结合本实验中PtPR-1诱导表达结果,推测PtPR-10可能只响应SA信号途径,而不受MeJA的诱导。另外,蛋白序列比对和系统发育树分析显示,PR10家族的保守性不高,除了核心区域和磷酸化位点外,其余的氨基酸残基变化差异很大,这可能是植物对多样化的生物非生物胁迫的一种适应。
综上所述,PtPR-1可能响应SA和JA双重诱导,而PtPR-10可能只受SA诱导表达,PtPR-5受诱导表达并不显著,说明病程相关蛋白基因具有不同的诱导表达模式,体现了植物体内多种信号通路调控基因表达的复杂性;而作为植物免疫系统效应因子的病程相关蛋白与抗病信号通路密不可分,是探讨植物抗病机理的重要环节。因此,开展毛白杨病程相关蛋白基因的克隆,并结合信号传导网络对基因的功能及调控机理进行深入研究,可为林木抗病基因工程研究奠定重要基础。
[1]Antoniw J F,White R F.The effects of aspirin and polyacrylic acid on soluble leaf proteins and resistance to virus infection in five cultivars of tobacco[J].Journal of Phytopathology,1980,98(3):331-341.
[2]Van Loon L C.The nomenclature of pathogenesis-related proteins[J].Physiological and Molecular Plant Pathology,1990,37(5):229-230.
[3]Van Loon L C,Pierpoint W S,Boller T,et al.Recommendations for naming plant pathogenesis-related proteins[J].Plant Molecular Biology Reporter,1994,12(3):245-264.
[4]Van Loon L C,Rep M,Pieterse C M J.Significance of inducible defense-related proteins in infected plant[J].Annual Review of Phytopathology,2006,44(1):135-162.
[5]Van Loon L C,Van Strien E A.The families of pathogenesis-related proteins,their activities,and comparative analysis of PR-1 type proteins[J].Physiological and Molecular Plant Pathology,1999,55(2):85-97.
[6]Jansson S,Douglas C J.Populus:a model system for plant biology[J].Annual Review of Plant Biology,2007,58(3):435-458.
[7]Zhu Z T,Zhang Z Y.The status and advances of genetic improvement of Populus tomentosa Carr[J].Journal of Beijing Forest University(English Edition),1997,6(1):1-7.
[8]Arnold K,Bordoli L,Kopp J,et al.The SWISS-MODEL Workspace:A web-based environment for protein structure homology modeling[J].Bioinformatics,2006,22(2):195-201.
[9]Guex N,Peitscn M C.SWISS-MODEL and the Swiss-PdbViewer:An environment for comparative protein modeling[J].Electrophoresis,1997,18(2):2714-2723.
[10]Schwede T,Kopp J,Guex N,et al.SWISS-MODEL:an automated protein homology-modeling server[J].Nucleic Acids Research,2003,31:3381-3385.
[11]Regier N,Streb S,Cocozza C,et al.Drought tolerance of two black poplar(Populus nigra L.)clones:contribution of carbohydrates and oxidative stress defence[J].Plant Cell Environ,2009,32(12):1724-1736.
[12]Rinaldi C,Kohler A,Frey P,et al.Transcript profiling of poplar leaves upon infection with compatible and incompatible strains of the foliar rust Melampsora larici-populina[J].Plant Physiology Preview,2007,144(1):347-366.
[13]Gattiker A,Gasteiger E,Bairoch A.ScanProsite:a reference implementation of a PROSITE scanning tool[J].Applied Bioinformatics,2002,1(2):107-108.
[14]Thompson C E,Fernandes C L,De Souza O N,et al.Molecular modeling of pathogenesis-related proteins of family 5[J].Cell Biochemistry and Biophysics,2006,44(3):385-394.
[15]Hammerschmidt R.Induced disease resistance:how do induced plants stop pathogens[J].Physiological and Molecular Plant Pathology,1999,55:77-84.
[16]Delaney T P,Friedrich L,Ryals J A.Arabidopsis signal transduction mutant defective in chemically and biologically induced disease resistance[J].Proc Natl Acad Sci U S A,1995,92(4):6602-6606.
[17]Gaffney T,Friedrich L.Requirement of salicylic acid for the induction of systemic acquired resistance[J].Science,1993,261(6):754-756.
[18]Shulaev V,Leon J.Is salicylic acid a translocated signal of systemic acquired resistance in tobacco? [J].Plant Cell,1995,7(3):1691-1701.
[19]Annemart Koornneef and Corné M J Pieterse.Cross Talk in Defense Signaling[J].Plant Physiology,2008,146(3):839-844.
[20]Dixon D C,Cutt J R,Klessig D F.Differential targeting of the tobacco PR-1 pathogenesis-related proteins to the extracellular space and vacuoles of crystal idioblasts[J].EMBO Journal,1991,10:1317-1324.
[21]Eyal Y,Meller Y,Lev-Yadun S,et al.A basic-type PR-1 promoter directs ethylene responsiveness,vascular and abscission zone-specific expression[J].The Plant Journal,1993,4:225-234.
[22]Niki T,Mitsuhara I,Seo S,et al.Antagonistic effect of salicylic acid and jasmonic acid on the expression of pathogenesis-related(PR)protein genes in wounded mature tobacco leaves[J].Plant and Cell Physiology,1998,39(2):500-507.
[23]Riviere M P,Marais A,Ponchet M,et al.Silencing of acidic pathogenesis-related PR-1 genes increases extracellular β-(1→3)-glucanase activity at the onset of tobacco defence reactions[J].Journal of Experimental Botany,2008,59(6):1225-1239.
[24]Sessa G,Yang X Q,Raz V,et al.Dark induction and subcellular localization of the pathogenesis-related PRB-1b protein[J].Plant Molecular Biology,1995,28(3):537-547.
[25]Ward E R,Uknes S J,Williams S C,et al.Goordinate gene activity in response to agents that induce systemic acquired resistance[J].Plant Cell,1991,3(3):1085-1094.
[26]Delaney T P,Uknes S,Vemooij B,et al.A central role of salicylic acid in plant disease resistance[J].Science,1994,266(2):1247-1250.
[27]Dong X N.NPR1,all things considered[J].Current Opinion in Plant Biology,2004,7(6):547-552.
[28]Mou Z L,Fan W H,Dong X N.Inducers of plant systemic acquired resistance regulate NPR1 function through redox changes[J].Cell,2003,113(1):935-944.
[29]Spoel S H,Koornneef A,Claessens S M C,et al.NPR1 modulates cross-talk between salicylate-and jasmonate-dependent defense pathways through a novel function in the cytosol[J].Plant Cell,2003,15(2):760-770.
[30]Zhang Y L,Fan W H,Kinkema M,et al.Interaction of NPR1 with basic leucine zipper protein transcription factors that bind sequences required for salicylic acid induction of the PR-1 gene[J].Proc Natl Acad Sci U S A,1999,96:6523-6528.
[31]Petersen M,Brodersen P,Naested H,et al.Arabidopsis MAP kinase 4 negatively regulates systemic acquired resistance[J].Cell,2000,103(7):1111-1120.
[32]Creelman R A,Mullet J E.Biosynthesis and action of jasmonates in plants[J].Annual Review of Plant Biology,1997,48:355-381.
[33]Repka V,Fischerova I,Silharova K.Methyl Jasmonate is a potent elicitor of multiple defense responses in grapevine leaves and Cell-Suspension cultures[J].Biologia Plantarum,2004,48(2):273-283.
[34]Rao M V,Lee H,Creelman R A,et al.Jasmonic acid signaling modulates ozone-induced hypersensitive cell death[J].Plant Cell,2000,12(9):1633-1646.
[35]Leon Reyes A,Spoel S H,De Lange E S,et al.Ethylene modulates the role of nonexpressor of pathogenesis-related genes1 in cross talk between salicylate and jasmonate signaling[J].Plant Physiology,2009,149:1797-1809.
[36]Leon-Reyes A,Van der Does D,De Lange E S,et al.Salicylate-mediated suppression of jasmonate-responsive gene expression in Arabidopsis is targeted downstream of the jasmonate biosynthesis pathway[J].Planta,2010,232(6):1423-1432.
[37]Mao P,Duan M R,Wei C H,et al.WRKY62 transcription factor acts downstream of cytosolic NPR1 and negatively regulates jasmonate-responsive gene expression[J].Plant and cell physiology,2007,48:833-842.
[38]Midoro-Horiuti T,Brooks E C,Goldblum R M.Pathogenesis-related proteins of plants as allergens[J].Annals of Allergy,Asthma & Immunology,2001,87(4):261-271.
[39]Saraste M,Sibbald P R,Wittinghofer A.The P-loop-a common motif in ATP-and GTP-binding proteins[J].Trends in Biochemical Science,1990,15(11):430-434.
[40]Hoffmann-Sommergruber K,Vanek-Krebitz M,Radauer C,et al.Genomic characterization of members of the Bet v 1 family:genes coding for allergens and pathogenesis-related proteins share intron positions[J].Gene,1997,197(1/2):91-100.
[41]Bantignies B,Séguin J,Muzac I,et al.Direct evidence for ribonucleolytic activity of a PR-10-like protein from white lupin roots[J].Plant molecular Biology,2000,42(6):871-881.
[42]Bufe A,Spangfort M D,Kahlert H,et al.The major birch pollen allergen,Bet v1,shows ribonuclease activity[J].Planta,1996,199(3):413-415.
[43]Chadha P,Das R H.A pathogenesis related protein,AhPR10 from peanut:an insight of its mode of antifungal activity[J].Planta,2006,225(1):213-222.
[44]Liu J J,Ekramoddoullah A K M.The family 10 of plant pathogenesis-related proteins:Their structure,regulation,and function in response to biotic and abiotic stresses[J].Physiological and Molecular Plant Pathology,2006,68:3-13.
[45]Park C J,Kim K J,Shin R,et al.Pathogenesis-related protein 10 isolated from hot pepper functions as a ribonuclease in an antiviral pathway[J].Plant Journal,2004,37(2):186-198.
[46]Zhou X J,Lu S,Xu Y H,et al.A cotton cDNA(GaPR-10)encoding a pathogenesis-related 10 protein with in vitro ribonucle-ase activity[J].Plant Science,2002,162(4):629-636.
[47]Breda C,Sallaud C,Turk J,et al.Defense reaction in Medicago sativa:a gene encoding a class 10 PR protein is expressed in vascular bundles[J].Molecular plant-microbe interactions,1996,9(8):713-719.
[48]Liu X J,Huang B B,Lin J,et al.A novel pathogenesis-related protein(SsPR10)from Solanum surattense with ribonucleolytic and antimicrobial activity is stress-and pathogen-inducible[J].Journal of Plant Physiology,2006,163(5):546-556.
[49]Matton D P,Brisson N.Cloning,expression,and sequence conservation of pathogenesis-related gene transcripts of potato[J].Molecular plant-microbe interactions,1989,6(2):325-331.
[50]Koistinen K M,Soininen P,Venalainen T,et al.Birch PR-10c interacts with several biologically important ligands[J].Phytochemistry,2005,66(21):2524-2533.
[51]Mogensen J E,Wimmer R,Larsen J N,et al.The major birch allergen,Bet v1,shows affinity for a broad spectrum of physiological ligands[J].Journal of Biological Chemistry,2002,277(26):23684-23692.
