不同浓度的PMA和PDTC对星形胶质细胞NF-κB表达的影响
2012-09-05莫伟陈兵邹新辉尹延庆梁远生黄梓雄谈山峰徐军发陈东
莫伟,陈兵*,邹新辉,尹延庆,梁远生,黄梓雄,谈山峰,徐军发,陈东
(1.广东医学院附属医院神经外科,广东湛江524001;2.广东医学院检验学院,广东湛江524023;3.广东医学院基础医学院,广东湛江524005)
不同浓度的PMA和PDTC对星形胶质细胞NF-κB表达的影响
莫伟1,陈兵1*,邹新辉1,尹延庆1,梁远生1,黄梓雄1,谈山峰1,徐军发2,陈东3
(1.广东医学院附属医院神经外科,广东湛江524001;2.广东医学院检验学院,广东湛江524023;3.广东医学院基础医学院,广东湛江524005)
目的探讨不同浓度的PMA和PDTC对星形胶质细胞NF-κB表达的影响。方法按照不同浓度的PMA及PDTC作用对纯化培养的大鼠星形胶质细胞进行分组,各组分别作用不同时间点后,运用免疫细胞化学方法进行NF-κB蛋白表达测定,进行干预因素和蛋白表达结果的相关分析。结果PMA和PDTC对星形胶质细胞NF-κB的活化和抑制作用呈现剂量与时间依赖性,24 h达高峰。结论可采用PMA及PDTC创建星形胶质细胞NF-κB蛋白不同水平表达模型。
PMA;PDTC;星形胶质细胞;NF-κB
核转录因子κB(Nuclear factor-kappa B,NF-κB)是一类蛋白质,可调控诱导多种炎症介质及细胞因子的表达,参与炎症反应、细胞增殖和程序性死亡,在创伤性脑损伤的继发性炎症反应发生发展中起着至关重要的枢纽作用[1]。星形胶质细胞(Astrocyte,AST)是脑组织中存在最多的细胞,在NF-κB方面的研究正越来越受到重视。本文在体外纯化培养星形胶质细胞的基础上,研究NF-κB激活剂佛波醇酯(PMA)及NF-κB抑制剂吡咯醛二硫氨基甲酸(PDTC)在不同剂量与作用时间下对星形胶质细胞NF-κB的活化和抑制作用,进而探讨星形胶质细胞在创伤性脑损伤的作用。
1 材料与方法
1.1 实验动物SPF级新生SD大鼠200只,鼠龄为24 h内,雌雄不限,由广东医学院动物实验中心饲养提供。
1.2 主要仪器和试剂胎牛血清(四季青),DMEM/F12培养基(美国GIBCO公司),胰蛋白酶,PMA,PDTC,一抗兔抗大鼠胶质原纤维酸性蛋白GFAP,一抗兔抗大鼠NF-κB多克隆抗体,二抗辣根过氧化物酶标记山羊抗兔IgG,二抗FITC荧光标记山羊抗兔IgG,DAB显色试剂盒(美国Sigma公司),多聚甲醛(上海化学试剂公司),盖玻片、湿盒(武汉博士德),其他化学试剂均为国产分析纯试剂。Boxun超净工作台(上海博迅),PH140A型培养箱/干燥器(上海一恒)ZD-85恒温振荡器,TP7014012荧光显微镜(美国Kodak公司),LEICADM RX体视学显微镜(德国Leica公司)。
1.3 实验方法新生大鼠星形胶质细胞的纯化培养:取出生24 h内的SD大鼠,参照McCarthy的方法[2]加以改良,建立大鼠脑星形胶质细胞的原代培养,冰冻无菌条件下取大脑皮质,仔细的剥除软脑膜和血管,剪碎后经0.125%胰蛋白酶37℃消化15 min,终止消化并吹打分散;100目滤网过滤后1 000 r/min× 10离心取沉淀,加完全培养基吹打制成单细胞悬液(台盼蓝计数细胞存活率为90%)。接种于玻璃培养瓶于37℃细胞培养箱内孵育30 min,翻转培养瓶,吸取瓶中的细胞悬液;以l×l05个/cm2密度散播在预先涂有多聚左旋赖氨酸的培养瓶中培养,24 h后换液,以后每隔3 d换液一次。继续培养12 d,待细胞铺满培养瓶时,以200 r/min摇床18 h以去除少突胶质细胞和小胶质细胞,用0.25%胰蛋白酶消化处理后,终止消化。孵育30 min,翻转培养瓶,吸取瓶中的细胞悬液,以除去成纤维细胞,进行纯化传代;两次传代后即可得纯化的星形胶质细胞[3]。采用免疫细胞化学GFAP染色进行星形胶质细胞的鉴定,纯度达到95%以上的可用于实验。
细胞分组和处理:将相同批次细胞通过传代分为5组,将各组神经细胞以3×105/孔接种于6孔板中,培养满意后添加药物用于实验,空白组予等量PBS液作用。各培养孔采用免疫细胞化学方法进行NF-κB蛋白表达测定。每批次细胞均重复3次实验。
(1)首先进行NF-κB激活组的检测:分别予PMA 0 μmol/L、0.25 μmol/L、0.5 μmol/L、1 μmol/L、2 μmol/L作用于各组细胞,分别培养1 h、6 h、12 h、24 h、48 h,观察PMA不同浓度的影响及确定NF-κB表达的高峰时间。
(2)然后进行NF-κB阻断组的检测:各组细胞分别预先用NF-κ B抑制剂吡咯醛二硫氨基甲酸(PDTC)0 μmol/L、1 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L处理1 h后,再加入激活组实验中确定的有效浓度PMA,作用到NF-κB表达的高峰时间,计算PDTC有效抑制率。
(3)NF-κB蛋白表达测定:每组细胞到相应时点后收集固定,细胞爬片以1%甲醇固定(冰上15 rain),PBS洗3次×5 min,0.1%TritonX-100的PBS室温作用30 min;吸弃上液后,PBS洗3次×5min,细胞爬片再以用10%山羊血清室温封闭30 min;PBS冲洗,加入一抗兔抗大鼠NF-κB多克隆抗体,4℃孵育过夜;PBS冲洗,加入用PBS稀释的二抗FITC荧光标记山羊抗兔IgG,湿盒内避光室温作用30 min,加入10 μl碘化丙啶染色液复染,用荧光封片剂封片。
1.4 蛋白表达的判断标准高倍镜下随机观察每组细胞5个以上有代表性视野(不少于1 000个细胞),于Leica激光共聚焦显微镜下照相,并用Leica Confocal图像分析软件检测核区荧光值,每组计数阳性细胞(细胞浆呈绿色荧光)与细胞总数(所有细胞的细胞核呈红色荧光)的比值计数。评分标准:0分,没有阳性细胞;1分,阳性细胞百分比小于10%;2分,阳性细胞百分比大于10%但小于30%;3分,阳性细胞百分比大于30%但小于60%;4分,阳性细胞百分比大于60%。
1.5 统计学处理采用SPSS13.0统计分析软件;所有参数用均数±标准差()表示;相同时间点的各组数据之间相互比较采用两两比较方差分析。检验水准:取α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 倒置显微镜观察星形胶质细胞形态以及纯度鉴定传代2~3次后在镜下见较纯化的星形胶质细胞:胞体较大,多呈多形性、扁平状,胞突较多较长,细胞核呈圆形或卵圆形,偏于胞体的一侧。免疫细胞化学染色后,镜下所有细胞的细胞核为蓝色,含星形胶质细胞特异抗原GFAP的细胞浆为棕黄色,标记为阳性细胞(图1)。以随机3个视野中阳性细胞的数日占细胞总数的比例为星形胶质细胞的纯度,本实验中培养的星形胶质细胞的纯度在95%以上。

图1 星形胶质细胞免疫细胞化学DAB染色(×100倍)
2.2 PMA对星形胶质细胞NF-κB蛋白表达的激活作用结果显示,随着PMA作用浓度的增加,NF-κB蛋白表达量逐渐增高,以1μmol/L组与0.5μmol/L组比较的变化最为显著。PMA在1 μmol/L作用1 h后即可诱导NF-κB的核内表达,与空白组比较差异有统计学意义(P<0.05)。各激活组随着作用时间增加,NF-κB蛋白表达量也逐渐增高,24 h达高峰,与空白组比较差异均有显著的统计学意义(P<0.01),见表1。
表1 不同浓度PMA作用不同时间后的NF-κB蛋白表达评分(,分)
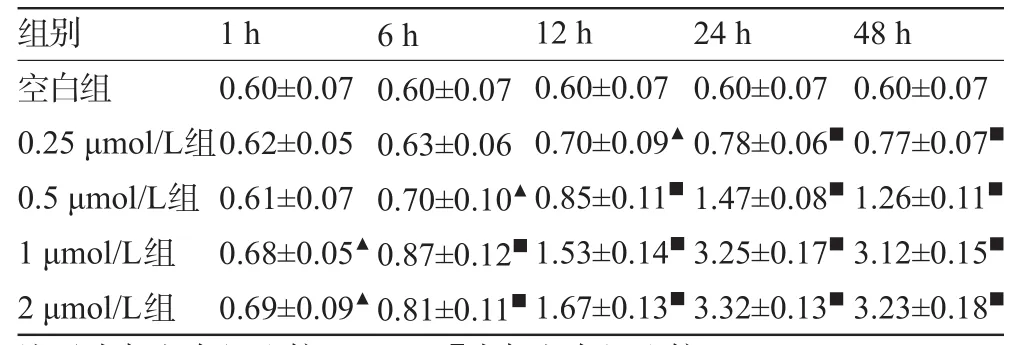
表1 不同浓度PMA作用不同时间后的NF-κB蛋白表达评分(,分)
注:▲为与空白组比较,P<0.05;■为与空白组比较,P<0.01。
空白组0.25 μmol/L组0.5 μmol/L组1 μmol/L组2 μmol/L组0.60±0.07 0.77±0.07■1.26±0.11■3.12±0.15■3.23±0.18■0.60±0.07 0.62±0.05 0.61±0.07 0.68±0.05▲0.69±0.09▲0.60±0.07 0.63±0.06 0.70±0.10▲0.87±0.12■0.81±0.11■0.60±0.07 0.70±0.09▲0.85±0.11■1.53±0.14■1.67±0.13■0.60±0.07 0.78±0.06■1.47±0.08■3.25±0.17■3.32±0.13■
2.3 PDTC对星形胶质细胞NF-κB蛋白表达的抑制作用依照激活组实验中确定的PMA有效浓度及作用的高峰时间,定制PMA1 μmol/L作用24 h做为对照组,抑制组加入PDTC。结果显示,抑制组在10 μmol/L浓度PDTC作用下NF-κB蛋白表达已开始低于对照组,差异有统计学意义(P<0.05),20 μmol/L浓度以上与对照组比较差异有显著统计学意义(P<0.01),见表2。
表2 不同浓度PDTC抑制作用后NF-κB蛋白表达评分(,分)

表2 不同浓度PDTC抑制作用后NF-κB蛋白表达评分(,分)
注:▲为与对照组比较,P<0.05;■为与对照组比较,P<0.01。
组别对照组抑制组50 μmol/L 3.25±0.17 1.98±0.12■1 μmol/L 3.25±0.17 3.27±0.23 10 μmol/L 3.25±0.17 2.97±0.17▲20 μmol/L 3.25±0.17 2.12±0.31■
3 讨论
星形胶质细胞不仅为神经元提供代谢和营养支持,而且在保护神经元存活、调节突触功能以及神经再生和神经修复中起至关重要的作用。新近研究发现星形胶质细胞参与突触的形成并调节突触传递,参与神经的发生并与神经元之间有信息传递。它们在思维和学习过程中扮演着几乎和神经元一样重要的角色[4],NF-κB在神经细胞损伤后的恢复过程中扮演着重要的角色[5]。NF-κB蛋白的表达主要在胞浆中,部分在细胞核中,它们具有和某些基因上启动子区的固定核苷酸序列结合,而启动基因转录的功能。NF-κB信号转导途径的活化与调节在干预细胞继发性死亡方面被认为有着重要的意义。在神经系统病变如脑损伤后星形胶质细胞中与凋亡相关的多条信号转导通路均被激活[6],而转录因子NF-κB参与的信号转导通路在其中的作用研究还有待进一步深入。因此,创建星形胶质细胞NF-κB蛋白不同水平表达模型,有助于开展星形胶质细胞在NF-κB信号通路上的机制研究,进而在改善神经系统病变导致的细胞损伤上寻找到新的治疗靶点。
佛波醇酯(PMA)是蛋白激酶C(PKC)的激动剂。细胞在静息状态下,NF-κB以无活性的潜在状态存在于细胞浆中,它与一种抑制因子IκB结合组成一个三聚体p50-p65-IκB。三聚体中IκB类抑制因子的存在可阻碍p50-p65复合物的二聚体化和使NF-κB的活性丧失。IκB是PKC的底物,细胞接受PKC激动剂刺激后,PKC活化的同时,可使IκB磷酸化并与NF-κB分离[7],从三聚体中解离出来,暴露出p50亚基上的易位信号和p65亚基上的DNA结合位点,从而使此异二聚物表现出NF-κB活性,并从细胞质中易位到细胞核中,与κB基序(κB motif)相结合,从而发挥转录调控作用。本实验中,在相同作用时间下,随着PMA作用浓度的增加,星形胶质细胞中NF-κB蛋白表达量逐渐增高,1 μmol/L浓度下已能显著提高NF-κB蛋白表达。而继续增加PMA浓度,NF-κB蛋白表达升高已不显著,同时光镜下显示细胞死亡及损伤情况明显增加。在PMA相同浓度作用下,NF-κB蛋白表达量逐渐增高,24 h时达到高峰,随后表达平稳后逐渐下降。
吡咯醛二硫氨基甲酸(PDTC)是一种常见的抗氧化剂,能特异性阻断NF-κB的传导通路。其作用机制来自两方面:一是金属螯合特性,二是二硫基基团清道夫作用。PDTC能抑制NF-κB的活性,从而抑制炎症因子及粘附分子的表达,能通过抑制内毒素引起的NF-κB的活化过程而阻断炎性细胞因子IL-6基因的表达,有可能成为炎症疾病治疗中一类很有应用前景的药物[8]。本实验中,PDTC在10 μmol/L浓度下已可以抑制NF-κB的活化,20 μmol/L浓度下效果较为显著。继续增加PDTC的浓度,有可能使星形胶质细胞损伤也相应增加。
实验表明,PMA和PDTC对星形胶质细胞NF-κB的活化和抑制作用呈现剂量与时间依赖性。药物作用24 h时,对NF-κB的活化和抑制作用可达到或近乎达到最高水平。因此,可采用PMA及PDTC创建星形胶质细胞NF-κB蛋白不同水平表达可控模型,有助于进行星形胶质细胞在脑功能改变及修复方面的研究。
[1]SalminenA,Huuskonen J,Ojala J,et al.Activation of innate immunity system during aging:NF-κB signaling is the molecular culprit of inflamm-aging[J].Ageing Research Reviews,2008,7(2):83-105.
[2]Mc Carthy KD,de Vellis J.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue[J].Cell Biol, 1980,85(2):890-902.
[3]Kliot M,Smith GM,Siegal JD,et a1.Astrocyte-po lymer implants promote regeneration of dorsal root fibers into the adult mammalian spinal cord[J].Exp Neurol,1990,109(1):57-69.
[4]常笑雪,张鑫.神经胶质细胞的研究进展[J].河南科技大学学报,2008,26(3):233-235.
[5]Leker RR,Shohami E.Cerebral ischemia and trauma-different etiologies yet similar mechanisms:neuron protective opportunities[J]. Brain Res Brain Res Rev,2002,39(1):55-73.
[6]柳华东,刘爽,李卉丽,等.脑缺氧缺血后激活的信号转导通路[J].中国生物化学与分子生物学报,2007,23(1):33-37.
[7]杨彧,于秉治.蛋白激酶C研究的最新进展[J].生物化学与生物物理进展,1994,21(4):308-312.
[8]Crack PJ,Taylor JM.Reactive oxygen species and the modulation of stroke[J].Free RadicBiol Med,2005,38(11):1433-1444.
Effect of different concentration of PMA and PDTC on the expression of NF-ΚB in astrocytes.
MO Wei1,CHEN Bing1,ZHOU Xin-hui1,YIN Yan-qing1,LIANG Yuan-sheng1,HUANG Zi-xiong1,TAN Shan-feng1,XU Jun-fa2, CHEN Dong3.1.Department of Neurosurgery,the Affiliated Hospital of Guangdong Medical College,Zhanjiang 524001, Guangdong,CHINA;2.Department of Clinical Laboratory,Guangdong Medical College,Zhanjiang 524023,Guangdong, CHINA;3.Department of Basic Medicine,Guangdong Medical College,Zhanjiang 524005,Guangdong,CHINA
ObjectiveTo investigate the effects of different concentration of PMA and PDTC on the expression of NF-ΚB in astrocytes.MethodsRat astrocytes were effected with different concentration of PMA and PDTC for different times.The expression of NF-κB protein was determined by immunocytochemistry.Correlation analysis was performed between the intervention factors and the expression of NF-κB protein.ResultsThe effect of PMA and PDTC on NF-ΚB protein of astrocytes shows dosage dependence and time dependence,which reaches the peak at 24 hour.ConclusionPMA and PDTC could be used to set up astrocytes cell models with different levels of NF-κB protein expression.
PMA;PDTC;Astrocytes;NF-κB;Cell model
R318
A
1003—6350(2012)07—015—03
10.3969/j.issn.1003-6350.2012.07.006
2011-12-16)
2011年广东医学院附属医院青年科研基金项目(编号:QK1112)、广东医学院附属医院优秀硕士学位论文培育计划(编号:YS1104)
莫伟(1981—),男,广东省阳江市人,主治医师,硕士。
*通讯作者:陈兵,男,博士,副教授,研究方向:微创神经外科,创伤性脑损伤的基础和临床。E-mail:drcb@163.com
