同时培养法与吸附法微生物固定化对比
2012-09-02山丹,马放,张斯,王晨,3
山 丹,马 放,张 斯,王 晨,3
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨;2.中日友好环境保护中心,100029北京;3.中国国际工程咨询公司,100044北京)
微生物固定化技术是指将微生物通过一定的技术手段(如利用载体材料、包埋物质或合理控制水力条件等)保持在反应器内.菌丝球是由霉菌的自絮凝现象产生的具有一定机械强度和大小的球体,它除了具有生物活性良好、沉降速度快、易于固液分离等优点外,吸附和降解效能近来也被广泛关注[1-4].目前,国外主要注重对菌丝球基础理论和结构方面的研究,国内的研究则大多是面向应用的[5-7].菌丝球在工业废水处理方面的研究起步比较晚,目前还没有实际应用的例子,实验室研究也只涉及到对重金属废水和印染废水的吸附[8-13].应用菌丝球作为载体是最新的研究方向,文献[14]以曲霉形成的菌丝球吸附并固定产氢细菌——产酸克雷伯氏菌进行连续流产氢,解决了产氢菌流失和产氢速率降低的问题,实现了霉菌和功能菌的生态位分离,将各自的功能有机地结合到了一起.但是,考虑到采用吸附法向菌丝球上固定化微生物的方法操作步骤繁琐、耗时、固定微生物量有限、形成的混合菌丝球内部微生物分布不均匀,势必影响固定化微生物的活性和整个球体的传质效果.本实验为菌丝球这种新型生物质载体提出了一种新的固定化方法——同时培养法,并以高效低温苯胺降解细菌JH-9作为研究对象,对同时培养和吸附两种固定化方法作了对比研究,为混合菌丝球的实际应用提供了有力的理论基础.
1 实验
1.1 实验材料
1.1.1 仪器和试剂
用于本试验的设备主要为8037—SGS超型全自动压力蒸汽灭菌器、ZHWY—2112B型双层全温度恒温振荡器、紫外分光光度仪(UNICAMHEλIOS)、CX31型显微镜、电子天平(ALC-210.4)、显微数码成像系统、垂直流超净工作台、鼓风干燥箱、石蜡切片机.
1.1.2 菌种来源
1.2 实验方法
1.2.1 单纯霉菌菌丝球的培养
配置液体培养基,121℃,灭菌20 min,接种孢子悬液,于160 r/min、37℃的摇床中培养24 h.
1)菌丝球生长培养基成分.蔗糖30 g,NH4Cl 0.5 g,K2HPO3·H2O 0.1 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.1 g,H2O 1 000 mL.
2)孢子悬液的配置.用无菌的生理盐水冲洗长有曲霉菌的斜面固体培养基的表面,用接种环轻刮斜面,直至菌体被完全冲洗下来.轻轻震荡试管,使悬液中的孢子呈均匀分散状态.用可见分光光度计在波长620 nm下测其吸光度(A).
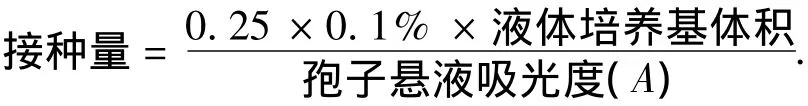
3)菌丝碎片的制备.用量筒取球龄4 d的菌丝球,静置30 min.使菌丝球充分沉降,量取量筒底部沉降下来的菌丝球150 mL,用无菌水稀释至300 mL倒入粉碎机中1 800 r/min,粉碎30 s,制成混合均匀的菌丝片段悬液.
1.2.2 混合菌丝球培养方案
取低温条件下的JH-9培养液在12 000 r/min下离心5 min,然后弃离心上清液,用磷酸盐缓冲溶液清洗离心管底部的菌体,在上述条件下再次离心,如此操作两次.洗菌后将离心管底部的菌体取出,用适量无菌水配成均匀菌悬液.按照菌丝球片段繁殖和孢子繁殖这两种不同的繁殖方法,分别采取同时和先后接种的方法培养混合菌丝球,并以不接种JH-9细菌的单纯菌丝球作为对照(具体实验设计方案见表1).
煤全部烧光了;煤桶空了;煤铲也没有用了;火炉里透出寒气,灌得满屋冰凉。窗外的树木呆立在严霜中;天空成了一面银灰色的盾牌,挡住向苍天求助的人。我得弄些煤来烧;我可不能活活冻死;我的背后是冷酷的火炉,我的面前是同样冷酷的天空,因此我必须快马加鞭,在它们之间奔驰,在它们之间向煤店老板要求帮助。

表1 混和菌丝球培养方案
1.2.3 菌丝球直径的测定
随机选取10个菌丝球,用滤纸吸去菌丝球外表面水分.吸取的水分应适量,保证菌丝球不因失去过多水分而变形.然后以游标卡尺量取直径数值.菌丝球直径表示为10个菌丝球直径的平均值.
1.2.4 成球堆积体积测定方法
将250 mL三角瓶中的菌丝球培养液倒入一个200 mL量筒中,静置10 min,读取菌丝球沉降体积作为成球堆积体积.
1.2.5 菌丝球形态观察
将接种后的液体培养基置于160 r/min,37℃摇床培养,当菌丝球培养到直径1~2 cm时,将菌丝球接入培养皿中用数码照相机拍照观察外观形态,而后将菌丝球切开用扫描电子显微镜观察其微观菌丝形态和混合菌丝球生态构成.
1.3 实验过程
1.3.1 不同固定化方法对混合球成球速度的影响
将霉菌Y3和菌株JH-9分别以同时接种培养(向培养液中同时接种Y3和JH-9)和吸附法培养(在培养液中先接种Y3待培养48 h菌丝球形成时向培养液中接种JH-9)的方式形成混合菌丝球,两种接种方式中霉菌Y3初始的接种量相等,而工程菌JH-9的初始接种量分别为5、10、20 mL(母液细菌量1.2×109/mL).每隔8 h测定培养液的吸光度A.
1.3.2 不同固定化方法对混合菌丝球成球堆积体积的影响
按照1.3.1中所述的两种方法进行固定化,培养混合菌丝球.当培养液的吸光度值A降为0时,将培养液中混合菌丝球移至量筒,静止沉降30 min后测量全部菌丝球堆积体积,本实验以单纯霉菌菌丝球作对照.
1.3.3 不同培养方法对混合菌丝球成球大小的影响
按照1.3.1所述的两种方法进行固定化,培养混合菌丝球.当培养液的吸光度值A降为0时,随机各取不同固定化方法形成的混合菌丝球10个,分别测量其直径d的大小,取其平均值作为菌丝球的大小(这里所指成球大小即菌丝球的直径d).
1.3.4 不同培养法对混合菌丝球总质量和相对密度的影响
按照1.3.1中所述的两种方法进行固定化,培养混合菌丝球.当培养液的吸光度值A降为0时,将不同固定化方法形成的全部混合菌丝球从三角瓶中取出,去除多余水分(吸取量控制在不使菌丝球变形为宜)后放至已恒重的蒸发皿中,置于烘箱,95℃烘干至恒质量,读取皿和球的总质量,去掉空皿质量得到混合菌丝球的总质量.成球总相对密度定义为成球总质量除以成球堆积体积.
1.3.5 混合菌丝球内部形态观察
采用同时培养法和吸附法培养混合菌丝球,随机取两种混合菌丝球各1个,切开后在扫描电子显微镜下观察其内部形态结构,同时以没有固定化细菌的单纯霉菌菌丝球内部形态结构作对比.
2 结果分析
2.1 不同固定化方法对混合菌丝球成球速度的影响
将霉菌Y3和功能菌JH-9分别以同时培养(向培养液中同时接种Y3和JH-9)和吸附法培养(在培养液中先接种Y3待培养48 h菌丝球形成时向培养液中接种JH-9)的方式形成菌丝球,两种接种方式中霉菌Y3初始的接种量相等,而功能菌JH-9的初始接种量分别为5、10、20 mL(母液细菌量1.2×109/mL).每隔8 h测定培养液的吸光度A.如图1、2所示,不论同时培养法还是吸附法,培养液的吸光度值自接种时起一直持续降低,最后降为0.不同接种量的同时培养法培养液吸光度值都在72 h降为0.而吸附法只有接种5 mL菌液的培养液在培养72 h时吸光度值降为0.同时培养法固定化细菌的时间比先后接种法要短.将培养液吸光度降为0视为混合菌丝球成球完全,以单位时间内培养液吸光度值A减少量V来表示混合菌丝球的成球速度,将以上数据重新整理,以混合菌丝球成球速度成图,结果如图3所示.
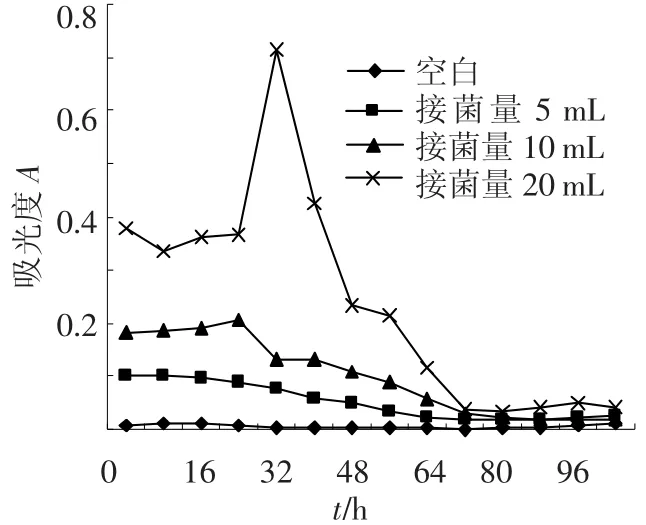
图1 同时培养法不同接种量对成球的影响

图2 吸附法不同接种量对成球的影响
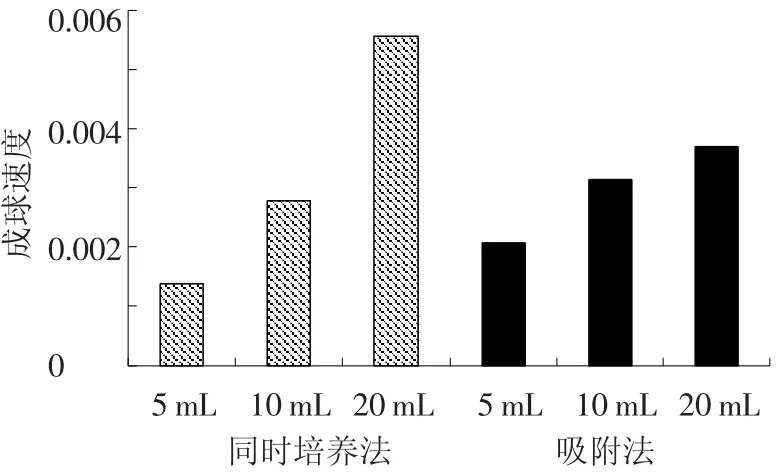
图3 不同固定化方法对混合菌丝球成球速度的影响
由图3可以看出,随着JH-9接种量的增加混合菌丝球的成球速度逐渐提高,即霉菌数量一定时,混合菌丝球的成球速度与功能菌的接种量成正比.JH-9接种5 mL时,同时培养法成球速度小于先后接种培养法;JH-9接种10 mL时,同时培养法与吸附法成球速度基本相等;JH-9接种20 mL时,同时培养法成球速度明显大于吸附法.这说明在相同的培养条件下同时培养法能够以更快的速度固定化更多的细菌,其单位时间内固定化细菌量更多.
2.2 不同固定化方法对混合菌丝球成球堆积体积的影响
当培养液吸光度降为0以后,将培养液中混合菌丝球取出以量筒测量全部菌丝球堆积体积,以单纯霉菌菌丝球作对照,结果如图4所示.可以看出,随着JH-9接菌量的增多,最终形成混合菌丝球的体积也增多,即混合菌丝球的堆积体积与功能菌的接种量成正比.同时培养法比吸附法所形成的混合菌丝球堆积体积略大一些.
2.3 不同固定化方法对混合菌丝球成球大小的影响
随机各取不同固定化方法形成的混合菌丝球10个,分别测量其直径大小,再取平均值作为菌丝球的平均大小.不同固定化方法形成的混合菌丝球成球大小如图5所示,可以看出,相同接种量的条件下,同时培养法形成的混合菌丝球直径比吸附法的小,且成球总数量多.接种方法相同时,混合菌丝球的大小随着接种细菌数量的增多而变大.

图4 不同固定化方法对混合菌丝球成球堆积体积的影响
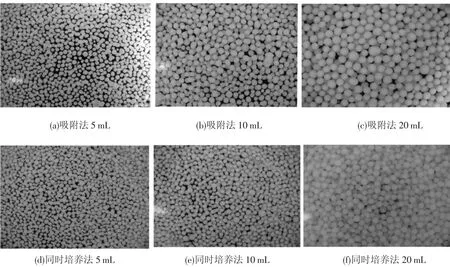
图5 不同固定化方法对混合菌丝球成球大小的影响
2.4 不同固定化方法对混合菌丝球总质量和总相对密度的影响
将不同固定化方法形成的全部混合菌丝球从三角瓶中取出,尽量去除多余水分后放到已经恒重的蒸发皿中,吸取量控制在不使菌丝球变形为宜,将处理好的菌球置于烘箱内,95℃烘干至恒质量,读取皿和球的总质量,去掉空皿质量得到混合菌丝球的总质量.以成球总质量除以成球堆积体积即定义为成球总相对密度.
由图6可以看出,当细菌接种量相同时,同时培养法形成的混合菌丝球的总质量和总相对密度都要小于吸附法形成的混合菌丝球;而相同固定化方法,随着细菌接种量的增加形成混合菌丝球的总质量和总相对密度却减少.
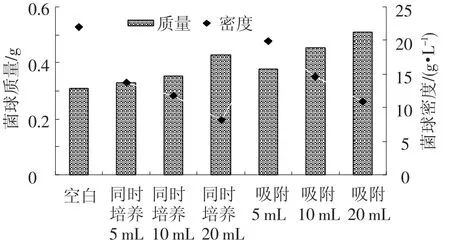
图6 不同固定化方法对混合菌丝球成球总质量和密度的影响
2.5 不同固定化方法对混合菌丝球内部形态的影响
分别采用同时培养法和吸附法培养混合菌丝球,随机取两种混合菌丝球各1个,切开后在扫描电子显微镜下观察其内部形态结构,同时以没有固定化细菌的单纯霉菌菌丝球内部形态结构作对比,结果如图7所示.可以看出:图7(a)中采用吸附固定化方法形成的混合菌丝球内部的细菌只固着在菌丝交叉形成平台的地方,而在没有交叉的菌丝上就没有细菌存在;而图7(c)中采用同时培养固定化方法形成的混合菌丝球内部,细菌是非常均匀地排列生长在每一根菌丝上,无论菌丝交联与否,而且单位面积上固定化生长的细菌数量也明显多于图7(a)的混合菌丝球.而且,图7(c)中细菌均匀排列,很少出现堆积和分层的现象,不影响菌丝球内部的能量和氧的供给,不会影响菌丝球对内部细菌的传质,这样被固定的细菌就能够保持较高的活性,更有利于在水处理工艺中的应用.

图7 不同固定化方法形成的混合菌丝球内部形态结构的扫描电子显微镜照片
3 结论
1)相同接种量的条件下,同时培养法固定化细菌所用的固定化时间缩短,而且在单位时间内可固定化细菌量更多.同时培养法与吸附法所形成的混合菌丝球相比,其堆积体积更大,成球总数量更多,球体直径较小,总质量和总相对密度也较小.
2)当采用同一种固定化方法时,混合菌丝球的堆积体积、成球大小与功能菌的接种量成正比;而形成混合菌丝球的总质量和总相对密度却与功能菌的接种量成反比.
3)同时培养法形成的混合菌丝球内部细菌非常均匀地排列生长在每一根菌丝上,无论菌丝交联与否;而吸附法形成的混合菌丝球内部,细菌只存在于多条菌丝交叉形成平台的地方.所以,新型微生物固定化方法可能会有效解决传统方法的传质效率低、固定生物量低、成本高等问题,具有较大的开发潜力和应用价值.
[1]张一竹,王清棋,刘剑书等.橘青霉菌丝球形成条件及其处理废水的应用[J].氨基酸和生物资源,2003,25(1):44-46.
[2]袁丽梅,张书军,杨敏,等.应用气升式反应器培养草酸青霉菌菌丝球的研究[J].微生物学报,2004,44(3):39-395.
[3]BIZUKOJC M,LEDAKOWICZ S.Physiological,morphological and kinetic aspects of lovastatin biosynthesis by aspergillus terreus[J].Journal of Biotechnology,2009,4:647-664.
[4]SARASWATHY A,HALLBERG R.Mycelial pellet formation by penicillium ochrochloron species due to exposure to pyrene[J].Microbiological Research,2005,160(4):375-383.
[5]WUCHERPFENNIG T,KIEP K A,DRIOUCH H,et al.Morphology and rheology in filamentous cultivations[J].Advances in Applied Microbiology,2010,72:89-136.
[6]HILLE A.Effective diffusivities and mass fluxes in fungal biopellets[J].Biotechnology and Bioengineering,2009,103:1202-1213.
[7]姜绍通,吴学凤,潘丽军,等.米根霉菌丝球半连续发酵产乳酸的工艺研究[J].农业机械学报,2009,40(11):150-155.
[8]曹晓婷,熊小京,郑天凌,等.黑曲霉菌丝球对直接耐晒翠蓝FBL的脱色特性[J].华侨大学学报:自然科学版,2008,29(1):34-37.
[9]范天黎,席宇姚,东升,等.土曲霉M11菌丝球对结晶紫的吸附脱色研究[J].化学与生物工程,2010,27(3):77-79.
[10]肖继波,胡用有.烟曲霉菌吸附染料的解析及其机理[J].环境科学与技术,2008,31(5):18-22.
[11]刘桂萍,陈晓霞.霉菌Dh-B1菌丝球吸附铅离子的研究[J].沈阳化工大学学报,2008,22(3):218-221.
[12]吴涓,钟升,李玉成.黄孢原毛平革菌对Pb2+的生物吸附特性及吸附机理[J].环境科学研究,2010,23(6):754-761.
[13]王慕华,徐宏英,苏槟楠.黑曲霉菌丝球还原水中六价铬的研究[J].科学技术与工程,2010,10(26):6472-6477.
[14]黄锦丽,龙敏南,傅雅婕,等.产酸克雷伯氏菌吸附固定及其产氢研究[J].厦门大学学报,2005,44(5):710-713.
