尖孢镰刀菌 Cu02对黄瓜的致病性及防治根结线虫的效果
2012-08-29王刚李二峰茆振川杨宇红谢丙炎
王刚李二峰茆振川杨宇红谢丙炎
(中国农业科学院蔬菜花卉研究所,农业部蔬菜遗传改良重点开放实验室,北京 100081)
南方根结线虫(Meloidogyne incognita)发生普遍,尤其在设施栽培中发病更为严重。每年对各种农作物造成的损失达到几十亿美元(Barker & Koenning,1998)。根结线虫侵染后,在黄瓜(Cucumis sativusL.)根部形成根结,根部吸收功能被破坏,造成地上部矮小、黄化甚至叶片脱落。镰刀菌(FusariuMspp.)普遍存在于土壤中,世界各地广泛分布,分为致病菌和非致病菌。在土壤中,大量的菌株是非致病的,在土壤中起着未知作用。镰刀菌和根结线虫都是植物的重要病原物,这两种病原物之间在寄主植物中存在着非常复杂的互作关系。植物寄生性线虫通常能够促进植物病原菌的侵染及扩展,从而引起严重的病害(Mai & Abawi,1987)。在田间已经报道根结线虫的侵染可以加重番茄、甘蓝、棉花、烟草枯萎病的发生(Mai & Abawi,1987)。然而,一些非致病性的菌株被认为是内寄生性的共生菌,它们能在许多植物的根组织中定殖,但是并不引起病害,而且能够增加植物对真菌病害及植物寄生线虫的抗性(Olivain &Alabouvette,1997;Diedhiou et al.,2003;Vu et al.,2006)。
由于栽培黄瓜中未发现抗南方根结线虫的种质资源,在生产中化学防治仍然是防治根结线虫的重要措施,如灭线磷、溴化钾和百亩威等(梁建根和郑经武,2010)。这些药剂虽然杀虫快,但是会严重降低蔬菜质量,污染环境,破坏生态平衡,因此生物防治措施日益受到人们的关注。国外已经利用节丛孢菌(Arthrobotrysspp.)开发成商品菌剂 Royale350,利用巴斯德杆菌(Pasteuria)防治南方根结线虫的研究也有报道(Siddiqui et al.,2001)。这些捕食性真菌和寄生性细菌在土壤中可以有效地防治线虫,但是捕食性真菌对于线虫的捕食是非选择性的,而巴斯德杆菌为专性寄生等特性都限制其高效发展(范圣长 等,2004)。所以人们开始寻求能够定殖于植物内的真菌来防治线虫。
尖孢镰刀菌Cu02能够定殖于植物体内,是一种非致病的尖孢镰刀菌,张小艳等(2007)报道了镰刀菌是根结线虫拮抗真菌的优势种群。目前还没出现抗线虫的黄瓜品种。尖孢镰刀菌能定殖于黄瓜体内,所以在其与其他土壤真菌竞争的过程中,就有了很大的优势,在防治线虫的作用上,就有了“守株待兔”的效果。总之,用这样一种对线虫有拮抗作用、对黄瓜非致病的、定殖于植株体内的的真菌来防治根结线虫,会稳定的发挥防效,而且对植物没有影响。所以本试验对尖孢镰刀菌Cu02对黄瓜的致病性以及防治南方根结线虫的效果进行了研究。
1 材料与方法
1.1 材料
供试黄瓜品种 9330由中国农业科学院蔬菜花卉研究所黄瓜课题组提供。尖孢镰刀菌 Cu02菌株为黄瓜内分离到的内生菌,由本所病害实验室提供;南方根结线虫采自市北京市海淀区四季青农场,并在温室中进行单卵块繁殖,收集卵块孵化的2龄幼虫,于2011年5月6日用于接种试验。
1.2 尖孢镰刀菌Cu02在黄瓜上的定殖
1.2.1 尖孢镰刀菌接种方法 将黄瓜(9330)种子用5%的NaClO消毒10 min,用无菌水清洗干净后29 ℃催芽1 d,播种于苗盘中,以灭菌土为介质在25~28 ℃温室中萌发、培养。当黄瓜两片子叶完全展开时将幼苗根部土壤轻轻洗掉,用于接种试验。镰刀菌接种采用浸根法,将幼苗根部在浓度为2.8×106个·mL-1的孢子悬浮液中浸泡15 min,然后定植于苗钵(规格:10 cm×10 cm×15 cm)中,以灭菌土为基质在25~28 ℃温室中培养,接种7 d时检测尖孢镰刀菌Cu02的侵染情况,在21 d时检测尖孢镰刀菌Cu02对黄瓜9330的致病性。每处理接种20株幼苗,3次重复,并以清水模拟接种为对照。
1.2.2 Cu02定殖检测 接种7 d时,将黄瓜幼苗根部土壤轻轻冲洗掉,除去须根和叶片只保留茎秆,用70%乙醇处理30 s,然后用0.5%的NaClO 处理3 min,用无菌水冲洗3次,将茎秆切成0.5 cm的小段,在含有链霉素(150 mg·L-1)的PDA培养基上分离接种的尖孢镰刀菌Cu02,于28 ℃避光培养,3 d后观察内生真菌的分离情况。调查尖孢镰刀菌Cu02在接种黄瓜幼苗上的侵染、定殖情况。并在接种尖孢镰刀菌Cu02菌株7、21 d时,分别观察植株的症状,调查黄瓜生长情况。
若有菌落长出,挑取菌丝,在显微镜下观察菌丝及孢子特征。挑取单胞,在新的PDA平板上28 ℃培养5 d,用刀片刮取菌丝,采用改良CTAB法提取基因组DNA(曹宜 等,2004),以引物 EF-F:5’-ATGGGTAAGGAGGACAAGAC-3’和 EF-R:5’-GGAAGTACCAGTGATCATGTT-3’对分离菌进行分子鉴定(Mbofung et al.,2007)。PCR扩增程序:95 ℃ 4 min,1个循环;95 ℃ 30 s;55 ℃ 30 s;72 ℃ 50 s,35个循环,72 ℃延伸10 min。PCR产物用1.5%琼脂糖凝胶电泳检测。将DNA片段进行切胶回收(Transgene),连接到pGEM-T载体,转化到Trans5α感受态细胞,在含有 IPTG(40 mg·L-1)、X-GAL(20 mg·L-1)及 AMP(100 mg·L-1)的 LB 培养基上进行蓝白斑筛选。37 ℃ 16 h后挑取白色菌落经PCR检测呈阳性的克隆进行测序(三博远志公司)。将获得的核苷酸序列在 NCBI(http://blast.ncbi.nlm.nih.gov)中进行对比,在分子水平上鉴定菌株的种类。
1.3 Cu02对黄瓜根结线虫的防治效果
1.3.1 接种南方根结线虫 挑取成熟的南方根结线虫卵块,用0.1%的NaClO消毒5 min,无菌水清洗3次,置于28 ℃下孵化,24 h后收集2龄幼虫(J2)用于接种试验。在接种尖孢镰刀菌Cu02 7 d后,接种南方根结线虫。接种时在距离黄瓜根2 cm处的基质中均匀打3个1 cm深的小孔,注入南方根结线虫悬浮液,每株接种南方根结线虫400条,每个处理接种20株,3次重复,并且以清水模拟接种为对照。接种后的幼苗在温室中进行正常管理。
1.3.2 防效检测 在黄瓜接种南方根结线虫21 d后,将黄瓜幼苗根部土壤轻轻洗净冲洗掉,观察根部症状,检测根结,统计大根结和小根结数量,并用 SAS软件(9.1)anova程序对结果进行方差分析。同时通过根结减退率计算Cu02对南方根结线虫的防治效果。

1.3.3 根结内镰刀菌分离检测 在接种和未接种尖孢镰刀菌 Cu02的黄瓜植株中,随机挑取 10株,每株分别随机切下20个根结,用1%的NaClO消毒10 min后,在含有链霉素(150 mg·L-1)的PDA培养基上分离尖孢镰刀菌Cu02,每个培养皿放置来自同一植株的20个根结,于28 ℃避光培养,3 d后观察根结内镰刀菌的分离情况。菌落的显微观察及分子鉴定方法同1.2。
2 结果与分析
2.1 菌体寄生定殖检测
2.1.1 Cu02在黄瓜植株内的定殖检测 经过表面消毒的茎段在PDA培养基上培养3 d后,被检测的30株植株每株根部和茎基部茎段都有白色的菌丝长出,形成菌落。培养7 d时植株的绝大部分茎段都有白色的菌丝长出,茎段中出现菌落的概率达到 91.0%,只有少数顶部茎段没有分离到菌丝(图 1-B),而对照中的所有茎段都没有分离到白色的菌丝(图 1-A)。说明尖孢镰刀菌Cu02可以成功的在黄瓜植株内定殖,而且在根部和茎基部的定殖率最高,达到100%。
2.1.2 Cu02在根结内的定殖检测 在PDA培养基上,每株接种Cu02的黄瓜植株上都有一些根结能分离到尖孢镰刀菌Cu20,并生长形成菌落(图2-B)。但并不是每个根结都能分离出菌落。对分离到镰刀菌的根结数量进行统计分析,发现Cu02在根结内的定殖率只有11.9%。而未接种Cu02的对照黄瓜植株上的根结中未分离到任何真菌(图2-A)。
2.1.3 菌体形态及分子检测 在茎段和根结上分离到的尖孢镰刀菌,培养3 d时菌丝均匀的覆盖茎段或根结表面,菌落菌呈现为白色的绒毛状;培养 7 d时菌丝进一步生长,密度加大,在根结上的菌落呈现为以根为中心圆形,菌丝成茸毡状,菌落的颜色也变为淡粉红色。在显微镜下观察发现有隔菌丝,孢子有小型分生孢子和大型分生孢子(图3)。小型分生孢子多数为单细胞,偶有一个隔膜,长椭圆形或短杆状,无色;大型分生孢子呈镰刀形,少许弯曲,以 3个隔膜为主,具有尖孢镰刀菌的典型形态特征。两种分离菌的形态特征与Cu02菌株完全一致。

图1 黄瓜接种Cu02 7 d时组织分离菌株生长情况
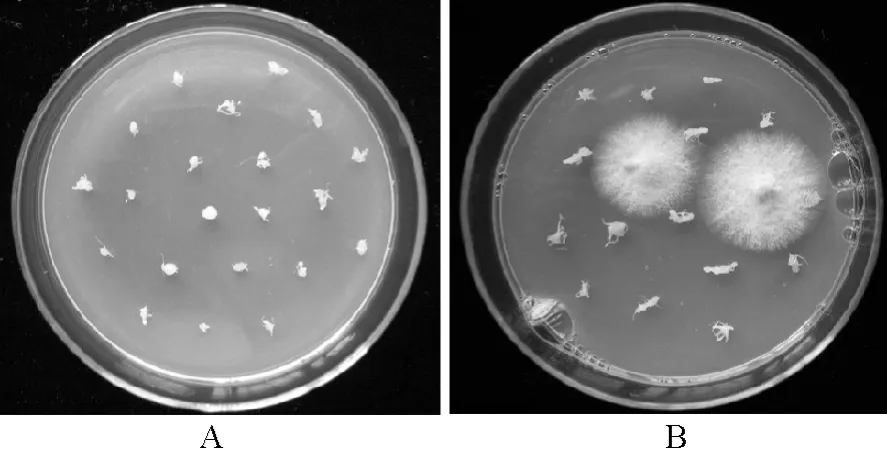
图2 尖孢镰刀菌Cu02在根结内的定殖检测结果
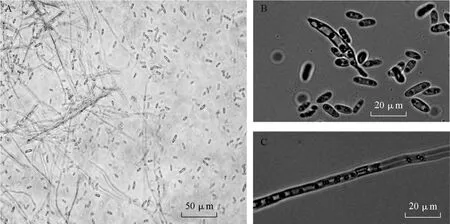
图3 菌体的显微检测结果
将在茎段及根结上分离到的菌株进行单胞培养,以提取的基因组DNA为模板,用EF引物扩增,在两种分离菌落中都得到了大小相等的片段(图4),采用DNAMAN(5.0)软件比较测序结果,显示两片段均为710 bp,且序列相同。在 NCBI数据库进行 BLAST,与FusariuMoxysporum的转录延长因子片段一致性达到 100%,排除期望值为 0,与 Cu02菌株的转录延长因子片段的核苷酸序列完全一致。
结合形态学与分子鉴定结果分析证实,从茎段及根结中分离到的菌株均为接种的尖孢镰刀菌Cu02,也进一步证明Cu02菌株可以在黄瓜9930植株内定殖。
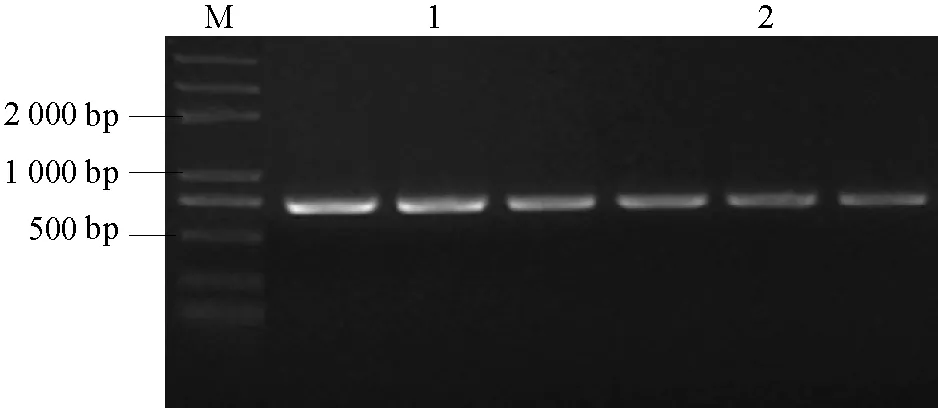
图4 EF引物扩增条带
2.2 防治南方根结线虫效果
接种Cu02菌株7、21 d时,对照与处理均未发现发病植株,植株生长健壮,长势良好无病症(图5)。在接种南方根结线虫28 d后,调查根结情况,发现Cu02处理与对照的黄瓜幼苗在根结大小(图6)、数量(图7)上存在差异。在Cu02处理的植株上,小根结数量平均为68.8个·株-1,大根结(Ф>2 mm)数量平均为3.5个·株-1;而在对照中,小根结平均为101.9个·株-1,大根结为14.8个·株-1(图8)。通过SAS软件anova程序对处理与对照中的小根结数进行分析,发现F=15.18,P=0.000 3,证实处理与对照中的小根结数量存在显著差异;而对其中的大根结的数量进行方差分析,得到F=56.92,P<0.000 1,说明处理与对照植株上的大根结数量存在着极显著差异。按根结减退率公式计算得到,Cu02对黄瓜的根结减退率达到38.0%。这些结果表明非致病尖孢镰刀菌Cu02在黄瓜上对于南方根结线虫具有一定的防治效果。

图5 黄瓜接种尖孢镰刀菌Cu02后的症状

图6 Cu02处理后根结大小情况

图7 Cu02处理后南方根结线虫侵染症状
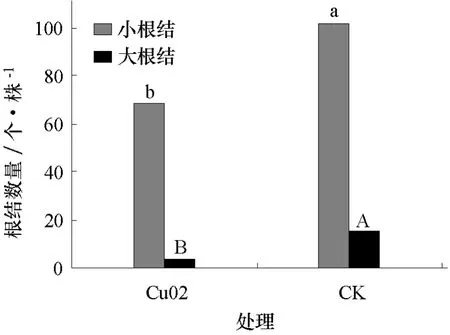
图8 Cu02处理与对照黄瓜的根结数量
3 讨论
通过本试验证明非致病尖孢镰刀菌Cu02可以成功的在黄瓜植株内定殖,在根部的定殖率可以达到100%,而且对黄瓜的生长没有任何影响,这就形成了Cu02防治根结线虫的独特优势。根结线虫侵染植物的根部,形成根结,为害作物。而非致病性尖孢镰刀菌可以较早的在植物的根部定殖,对根结线虫的侵染、寄生及根结发育产生一定影响,从而对植物形成保护作用。现在已经有很多关于非致病镰刀菌防治根结线虫的报道(Diedhiou et al.,2003)。在国内,已经证明了镰刀菌对根结线虫的毒杀特性,尖孢镰刀菌是根结线虫的拮抗菌,作为根结线虫生防菌具有巨大潜力(段玉玺 等,2010)。有关研究表明,镰刀菌可以产生某些代谢产物毒杀卵粒,再定殖于卵,影响其发育(刘国坤 等,2006)。相对于土壤中的尖孢镰刀菌,非致病性植物内寄生尖孢镰刀菌在防治根结线虫上具有独特的优势。首先,由于内定殖特性使得菌株受到外界其他微生物竞争作用较小,有利于稳定的发挥防效;其次,非致病性镰刀菌为丝状真菌,为采用生物技术改造提供了高效的技术平台试验载体,随着生物技术的发展将杀线虫的特异基因如蛋白酶基因等转入菌丝,在植物根部特异表达杀线虫基因,从而大大提高了防治植物寄生性线虫的效果。特别是在当前黄瓜还没有可利用的抗根结线虫品种条件下,更加具有重要的研究意义。
在黄瓜上,尖孢镰刀菌Cu02显示出对南方根结防治效果为38.0%,虽为显著,但还不理想。试验发现,Cu02在黄瓜植株根部的定殖率达到100.0%,然而在根结中的定殖率只有11.9%,这可能与Cu02对根结线虫的防治效果较低有直接的关系。所以提高Cu02的防治效果的关键就在于提高Cu02在黄瓜植株内的存在数量及存活能力。在接种条件、接种时间及接种的最佳孢子浓度上需要深入探索,从而进一步提高对根结线虫的防治效果。此外,可以尝试尖孢镰刀菌Cu02与化学药剂的联合使用,有利于制备出更高效的生防菌剂。
曹宜,刘波,林营志,朱育菁,周涵韬.2004.枯萎病尖孢镰刀菌的RAPD-PCR多态性分析.厦门大学学报:自然科学版,43(s):74-79.
段玉玺,曲泽岚,王媛媛.2010.南方根结线虫生防镰刀菌菌株筛选.农药,49(8):607-609.
范圣长,段玉玺,陈立杰.2004.大豆胞囊线虫胞囊内寄生真菌研究.大豆科学,23(1):71-73.
梁建根,郑经武.2010.设施栽培中蔬菜根结线虫生物防治研究进展.中国农学通报,26(19):290-293.
刘国坤,肖顾,洪彩凤,张绍升.2006.镰刀菌对南方根结线虫卵的寄生特性.福建农林大学学报,35(5):459-462.
张小艳,张荣,毛琦,李乖绵.2007.陕西省蔬菜根结线虫拮抗真菌的分离与初步鉴定.干旱地区农业研究,25(4):62-64.
Barker K R,Koenning S R.1998.Development of sustainable systems for nematode management.Annu Rev Phytopathol,36:165-205.
Diedhiou P M,Hallmann J,Oerke E C,Dehne H W.2003.Effects of arbuscular mycorrhizal fungi and a non-pathogenicFusariumoxysporumonMeloidogyne incognitai nfestation of tomato.Mycorrhiza,13(4):199-204.
Mai W F,Abawi G S.1987.Interactions among root-knot nematodes and FusariuMwilt fungi on host plants.Annual Review of Phytopathology,25:317-338.
Mbofung G Y,Hong S G,Pryor B M.2007.Phylogeny ofFusariuMoxysporuMf. sp. lactucae inferred froMMitochondrial small subunit,elongation factor 1-alpha,and nuclear ribosomal intergenic spacer sequence data.Phytopathology,97(1):87-98.
Olivain C,Alabouvette C.1997.Colonization of tomato root by a non-pathogenic strain ofFusariuMoxysporum.New Phytologist,137:481-494.
Siddiqui I A,Zareen A,Javed Z M,shahid S S.2001.Use of Trichoderma species in the control ofMeloidogyne javanica,root knot nematode in okra and mungbean.Pakistan Journal of Biological Sciences,4(7):846-848.
Vu T,Hauschild R,Sikora R A.2006.FusariuMoxysporumendophytes induced systemic resistance againstRadopholus similison banana.Nematology,8(6):847-852.
