花生及其制品中多种霉菌毒素残留同时测定方法*
2012-08-21朱臻怡宋欢冯民何健熊华萱
朱臻怡 ,宋欢 ,冯民 ,何健 ,熊华萱
(1中华人民共和国淮安出入境检验检疫局,江苏淮安 223001;2中华人民共和国山西出入境检验检疫局,太原 030024)
霉菌毒素(Mycotoxins)是一类存在于自然界中的各种霉菌产生的有毒次级代谢产物,广泛污染农作物、食品及饲料等植物源性产品[1],是花生及其制品的重要污染源之一,从而进入食物链中影响人体健康[2]。随着农产品受霉菌毒素污染问题的日趋严重和食品安全问题的国际化,发达国家和有关组织对花生及其制品中霉菌毒素残留纷纷制定了严格的限量标准[3]。花生作为我国在国际市场具有相对竞争优势的农产品,其出口遭受到了一系列SPS措施的阻碍[4],其中霉菌毒素残留限量标准日趋严厉,检测项目不断增加。因此花生及其制品中霉菌毒素残留检测对于保障人民饮食健康,保障我国花生及其制品的进出口贸易具有重要意义。
目前在我国,霉菌毒素是出口花生及其制品的残留监控的一个重要项目[5],对于霉菌毒素的残留分析,国内外报道较多的是仅针对每个毒素的包括薄层层析法、液相色谱法和免疫化学分析法(有免疫亲和柱-荧光分光光度法和免疫亲和术-HPLC法、酶联免疫吸附法、微柱筛选法和一步式检测金标试纸法)等检测手段[6],国家标准和行业标准中也有相关测定方法规定,但对多种霉菌毒素的同时测定尚没有相关的标准方法。国外报道Veronica Maria Teresa Lattanzio等[7]利用液相色谱-串联质谱法对玉米中多种霉菌毒素及其代谢产物同时检测,但提取净化手段繁琐或效果不佳,基质单一,不适合于开展日常的检测。笔者利用液相色谱-串联质谱技术对花生及其制品中多种霉菌毒素同时测定,以PBS溶液和甲醇-水溶液提取,经免疫亲和柱净化的手段,有效地降低了花生本底干扰,提高了检测灵敏度,可满足残留检测和目前国外检测限量(MRL)的需要,提高了目前花生及其制品中多种霉菌毒素残留的检测能力。
1 实验部分
1.1 主要仪器与试剂
甲醇、乙腈、甲苯、乙酸:色谱级,德国Merck公司;
PBS溶液:北京中检维康技术有限公司;
霉菌毒素标准品:美国Sulpco公司和美国Vicam公司;
免疫亲和柱:Myco6in1TMLC/MS/MS型,美国VICAM公司;
液相色谱-质谱/质谱仪:ACQUITY TQ Detector,配有电喷雾离子源(ESI),美国 Waters公司;
电子天平:PB-203E型,梅特勒-托利多仪器(上海)有限公司;
恒温氮吹装置:N-EVAP14165型,美 国Organomation联合公司。
1.2 液相色谱-质谱/质谱分析条件
色谱柱:ACQUITY UPLC反 相C18柱(100 mm×2.1 mm,1.7 μm);离子化模式:电喷雾电离正离子模式(ESI+)和电喷雾电离负离子模式(ESI-),一次进样;质谱扫描方式:多反应监测(MRM);其它质谱条件:见表1;流动相:乙腈和10 mmol/L乙酸铵溶液梯度洗脱,见表2,流速为0.4 mL/min ;柱温:35℃;进样量:5 μL。
1.3 样品预处理
样品经花生粉碎机粉碎成均匀的试样。

表1 多反应监测方法(MRM)测定的质谱条件参数

表2 梯度洗脱程序
1.3.1 提取
称取5 g试样(精确到0.01 g)置于50 mL具塞塑料离心管中,加入PBS溶液25 mL,超声振荡15 min后以4000 r/min离心10 min。取上层17.5 mL PBS溶液于干净的容器,通过微纤维滤纸过滤,将滤液收集于干净的容器(提取液A)。向下层固体样品中加入17.5 mL甲醇,超声振荡15 min后以4000 r/min离心10 min,取上层溶液10 mL,用90 mL PBS溶液稀释后通过微纤维滤纸过滤,将滤液收集于干净的容器(提取液B)。
1.3.2 免疫亲和柱净化和洗脱
将免疫亲和柱连接于10 mL玻璃针筒下,准确移取50 mL提取液B过免疫亲和柱,以每秒1~2滴的流速全部通过亲和柱,直至空气流经亲和柱;将20 mL PBS溶液以每秒1~2滴的流速通过亲和柱,直至空气流经亲和柱;准确移取5 mL提取液A以每秒1~2滴的流速全部通过亲和柱,直至空气流经亲和柱;将20 mL超纯水以每秒1~2滴的流速淋洗柱子,直至空气流经亲和柱,弃去全部流出液。将1.5 mL甲醇以每秒1滴的流速洗脱亲和柱,将洗脱液收集于玻璃试管中,当甲醇大部分过柱后,不要完全过柱,停止加压,静置5 min,再将1.5 mL甲醇以每秒1滴的流速洗脱亲和柱,将全部洗脱液收集于同一玻璃试管中。
1.3.3 定容
将上述收集于玻璃试管中的洗脱液在50℃下氮气吹干,加入0.5 mL体积比为1∶1的水-乙腈溶液(相当于1 g样品),充分涡旋混合后,过0.22 μm有机滤膜,用液相色谱-质谱/质谱仪测定。
2 结果与讨论
2.1 提取过程
在优化提取试验过程中,采用回收试验比较了单个提取[用PBS溶液或70%甲醇-水(体积比为7∶3)溶液]和双重提取[先用PBS溶液提取,再用70%甲醇-水(体积比为7∶3)溶液提取,合并两份提取液]的效果,表明双重提取更为充分彻底,能得到较高的回收率,尤其是伏马毒素B1和脱氧雪腐镰刀菌烯醇,需要双重提取来完善提取过程。
2.2 净化和洗脱过程
实验所用Myco6in1TMLC/MS/MS免疫亲和柱[8]的优点是具有高度的特异性,使用时不需要活化,但是上样时有机溶剂的含量应严格控制,甲醇和乙腈等有机溶剂的体积分数不能超过20%,否则会影响毒素的抗原抗体结合反应。
虽然免疫亲和柱具有选择性吸附的特性,但是样品基质中,某些具有生物活性的杂质也会有少量吸附,为了消除这些杂质,实验选择用真菌毒素缓冲液来淋洗,一可以去杂质,二可以痊愈脱氧雪腐镰刀菌烯醇(脱氧雪腐镰刀菌烯醇亲水性较强)[9],对复杂的样品基质能达到非常好的净化效果,而单纯用纯水淋洗,杂质的去除效果不好,易干扰测定。
将1.5 mL甲醇以1滴/秒的流速淋洗亲和柱,收集淋洗液时当大部分甲醇过柱(不要完全过柱)后,停止加压,静置5 min,以确保洗脱完全;再用1.5 mL甲醇以1滴/秒的流速淋洗亲和柱,收集全部淋洗液,此次确保洗脱彻底。
在对样品净化过程研究中发现,由于脱氧雪腐镰刀菌烯醇亲水性强,过柱的PBS溶液中含甲醇的质量分数和溶液的体积对它的回收有较大的影响,因此在70%甲醇-水(体积比为7∶3)提取液过柱后和PBS提取液过柱前要用PBS溶液20 mL淋洗柱子,以痊愈脱氧雪腐镰刀菌烯醇。
2.3 仪器条件
根据固定相的适用范围和拟分析霉菌毒素的结构特性,采用ACQUITY UPLC反相C18柱(100 mm×2.1 mm,1.7μm),进行样品分析,柱效高,分离效果好。
由于采用电喷雾(ESI)模式,为了利于去溶剂化,选择乙腈为流动相中的有机相;为改善色谱分离效果,提高质谱响应,向流动相的水相中添加乙酸和乙酸铵,最佳配比为0.1%乙酸(体积比)和10 mmol/L乙酸铵。
2.4 方法的线性范围与检出限
在本方法所确定的实验条件下,以信噪比(S/N)为10时的检测浓度作为检出限,用含0.5%甲酸(体积比)和10 mmol/L乙酸铵的水溶液将配制的混合标准溶液稀释成1,2,5,10,20倍检出限的系列标准溶液,进行测定,以峰面积y(纵坐标)对相应霉菌毒素的浓度x(横坐标)作图,结果表明,待测化合物浓度与对应的峰面积呈现良好的线性关系,线性方程、线性范围及检出限见表3。
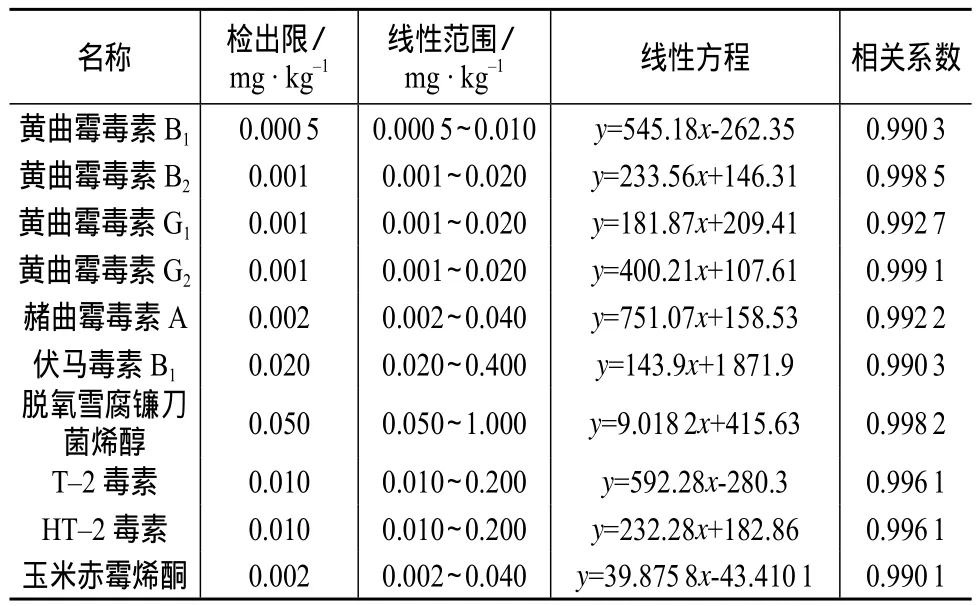
表3 方法的检出限和线性方程、线性范围
2.5 方法的回收率与精密度
本方法的室内回收率和精密度试验,以不含以上各霉菌毒素的花生为空白样品基质,进行1倍检出限浓度水平的添加回收试验,平行测定10次,结果见表4。实验结果表明,方法平均回收率为72.35%~97.82%,相对标准偏差为8.95%~18.41%。表4中回收率与精密度数据符合国家规定残留分析对准确度与精密度的要求,说明本方法具有较好的可靠性与可行性。

表4 样品中添加霉菌毒素的回收率及精密度试验结果

续表4
空白样品谱图及检出限添加水平的黄曲霉毒素B2谱图分别见图1、图2。

3 结语
采用多种霉菌毒素免疫亲和柱净化的以LC/ESI-MS/MS方式同时测定花生及其制品中黄曲霉毒素(B1,B2,G1,G2)、赭曲霉毒素 A、伏马毒素 B1、脱氧雪腐镰刀菌烯醇、T-2毒素、HT-2毒素和玉米赤霉烯酮。方法所涉及的相关霉菌毒素的测试水平的回收率和重现性等技术指标均符合国内外相关要求;该方法的检出限满足国内、国际对上述霉菌毒素已规定或正在制定的最大允许水平要求,能够满足实际应用的需要。

[1]鲍蕾,梁成珠,刘学惠,等.出入境农产品真菌毒素的污染、检测及控制[J].食品安全与检测,2005(1): 60-61.
[2]苏福荣,王松雪,孙辉,等.国内外粮食中真菌毒素限量标准制定的现状与分析[J].粮油食品科技,2007,6(15): 57-59.
[3]张艺兵,张鹏.真菌毒素的风险分析[J].食品工业科技,2002,23(7): 59-80.
[4]曾义,胡进,余兵,等.出口食品的SPS措施遭遇及其对策[J].中国标准化,2005(12): 118-121.
[5]张艺兵,鲍蕾,褚庆华.农产品真菌毒素的监测分析[M].北京:化学工业出版社,2006.
[6]王松雪,李爱科.饲料资源霉菌毒素检测技术[N].中国畜牧兽医报,2006-03-26(12).
[7]Veronica Maria Teresa Lattanzio,Michele Solfrizzo,Steve Powers,et al.Simultaneous determination of aflatoxins,ochratoxin A and Fusarium toxins in maize by liquid chromatography/tandem mass spectrometry after multitoxin immunoaffinity cleanup[J].Rapid Commun Mass Spectrom,2007,21: 3253-3261.
[8]吴艳萍,靳慧霞.植物产品中真菌毒素的危害及其检测方法[J].粮食与饲料工业,2001(7): 43-45.
[9]徐超,宋焕,刘向阳,等.饲料中霉菌毒素检测技术新进展[J].新进展,2009(10): 42-46.
