大鼠急性肾损伤导致肝细胞凋亡的实验研究*
2012-08-02包翠芬刘玉玲邵佑之
包翠芬, 刘玉玲, 邵佑之
(辽宁医学院科学实验中心,辽宁 锦州 121001)
引起急性肾损伤 (acute kidney injury,AKI)的原因可以是缺血,如休克、肾移植、肾血管手术等,因此又叫缺血性 AKI(ischemic AKI,IAKI)[1];也可以是非缺血原因,如双侧肾切除(bilateral nephrectomy,BNx)后而导致的AKI叫非缺血性AKI(non-ischemic AKI)。临床上AKI病人的死亡率很高。其中部分AKI病人的致死原因常常是肾外器官衰竭引起的,如AKI诱导的急性肝脏损伤(acute liver injury,ALI)[2]。然而 AKI诱导 ALI的机制至今尚不清楚[2-4]。原因之一是尚不十分清楚AKI引起的肝脏细胞受损在细胞学上有何特点。晚近一些报道提出AKI可引起非肾脏器官的细胞凋亡,并认为AKI引起细胞凋亡的器官是有选择性的[5]。经肿瘤坏死因子受体 α (tumor necrosis factor receptor α,TNFRα)启动、半胱氨酸天冬氨酸蛋白酶(caspase)家族激活途径的细胞死亡叫外源性凋亡(extrinsic apoptosis)[6-7]。应用caspase抑制剂可以阻止这种途径凋亡的发生。这种途径的细胞凋亡是否参与AKI所引起的肝细胞损伤国内外尚无详细的报道。本文应用光、电镜技术以及免疫印迹、免疫组织化学染色方法探讨AKI导致肝细胞凋亡的细胞学特点。
材料和方法
1 动物
健康SD大鼠,雌雄各半,体质量200~250 g,购于辽宁医学院实验动物中心。
2 主要仪器及试剂
兔抗大鼠 TNFRα抗体、caspase-3抗体购自Abcam,PV6001 II抗试剂盒、DAB显色试剂盒均购自北京中杉金桥生物公司;石蜡切片机、超薄切片机(Leica);透射电镜(日本电子公司)。
3 主要方法
3.1 动物的选择及AKI模型的建立 健康SD大鼠按实验条件分3组:IAKI组10只,苯巴比妥钠麻醉后开腹,应用无损伤血管夹阻断双侧肾动脉血流60min后放开血管夹;假手术(sham)组10只,手术过程同前,只是不阻断肾动脉血流BNx组10只,行双肾切除。3组动物关腹后于无菌条件下饲养24 h后取材。先经腹主动脉取血2 mL用于肾功能和肝功能的常规检查。取部分左肾,肝左叶组织用于免疫印迹分析。然后采用2.5%多聚甲醛戊二醛灌流右肾、肝右叶组织进行光镜、电镜标本制备。
3.2 肾功能和肝功能的测定 应用自动生化分析仪,比色法测定血清肌酐(serum creatinine,SCr)和尿素氮(blood urea nitrogen,BUN),赖氏法测定丙氨酸氨基转移酶(alanine aminotransferase,ALT)。
3.3 TNFRα和caspase-3免疫印迹测定 新鲜肾(只测caspase-3)和肝组织加入RIPA裂解液,0℃下剪碎和超声波粉碎20 s后静置30 min,4℃、12000 r/min离心20 min,留取上清液,BCA法测定蛋白含量,并按每20 μL含50 μg蛋白制成样品,-20℃冰箱保存。取已制备样品适量加入电泳槽,100 V电压下电泳,转膜,常温下半干转印,TBST冲洗后,5% 小牛血清白蛋白室温封闭1~2 h。分别加入I抗(TNFRα抗体,caspase-3抗体,稀释度为1∶1000)4℃孵育过夜,TBST缓冲液洗脱3次,每次5 min;分别加入II抗(辣根过氧化酶标记的IgG抗体,稀释度为1∶200)室温孵育1 h,TBST缓冲液洗脱3次,每次5 min;ECL发光显色;采用β-actin作为内参照。扫描电泳条带,用凝胶分析软件分析各蛋白目的条带吸光度。根据目的条带与内参照条带吸光度的比值表示待测蛋白含量。
3.4 光、电镜标本的制备 经2.5%多聚甲醛戊二醛灌流固定的右肾,肝右叶组织再加入2.5%多聚甲醛戊二醛续固定24 h。部分梯度乙醇脱水、二甲苯透明、石蜡包埋,Leica RM2135石蜡切片机切片,厚度5~7 μm切片,HE染色。部分组织经1% 锇酸固定,梯度乙醇、丙酮脱水,Epon812环氧树脂包埋剂包埋,LKB-V超薄切片机1 μm半薄切片,甲苯胺蓝染色后光镜观察,定位后再进行超薄切片,重金属双染,1200EX透射电子显微镜下观察。
3.5 Caspase-3的免疫组织化学染色 采用石蜡切片免疫组化Envision法染色。切片常规脱蜡至水,3% 过氧化氢溶液处理30 min以去除内源性过氧化物酶,高压修复抗原,分别滴加适当稀释的Ⅰ抗(单克隆抗体caspase-3),4℃过夜,滴加辣根酶标记羊抗兔多聚体(PV6001)37℃孵育 30 min,DAB显色。以上各步骤之间用0.01 mol/L PBS洗涤3次,苏木素复染,脱水,透明,中性树胶封片,光学显微镜下观察。阴性对照用PBS替代Ⅰ抗。蛋白阳性表达呈棕黄色。
4 统计学处理
用SPSS 13.0统计软件进行分析。数据用均数±标准差()表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 肾功能和肝功能检查结果
BNx组动物血 BUN 为(36.1 ±2.1)mmol/L,SCr为(321±26)mmol/L。IAKI组动物血BUN为(39.1±2.7)mmol/L,SCr为(318 ±26)mmol/L。Sham 组动物血 BUN 为(4.2 ±0.8)mmol/L,SCr为(88 ±17)mmol/L。IAKI组 ALT为(378±33)U/L,BNx组为(367±43)U/L,sham 组为(97±22)U/L。与 sham组相比较,IAKI组和BNx组的肾、肝功能指标均有明显差异(P <0.05)。
2 免疫印迹的结果
与sham组动物肝脏相比,无论是IAKI组还是BNx组动物肝脏的TNFRα和caspase-3的表达均明显增强,见图1A。与sham组肾脏相比,IAKI组肾脏caspase-3的表达增强,见图1B。
3 光镜下HE染色切片和caspase-3免疫组化染色观察结果
3.1 肾脏 Sham组动物肾脏显示出正常的组织学结构,见图2A。IAKI动物肾脏肾小管大面积坏死,表现为细胞肿胀,崩溃脱落,有时整个小管截面细胞消失。特别在近髓质以及髓质外带中近端小管细胞大片坏死,坏死细胞浅淡,细胞内大量空泡出现。在坏死的细胞之间可见大量散在的凋亡细胞,表现为细胞固缩,着色深,核染色质固缩表现,见图2B。Caspase-3 IHC染色sham组肾脏呈阴性反应,见图2C。IAKI组髓质外带近端小管上皮内可见较多的caspase-3阳性细胞,阳性反应颗粒出现在细胞质内,见图2D。
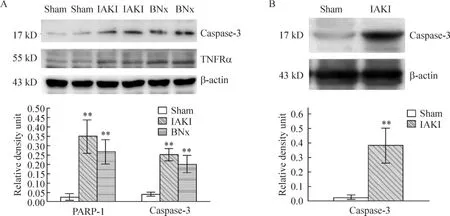
Figure1.The results of Western blotting.A:both IAKI and BNx rat livers had stronger expression of TNFRα and caspase-3;B:IAKI rat kidneys had stronger expression of caspase-3..n=10.**P<0.01 vs sham.图1 免疫印迹结果
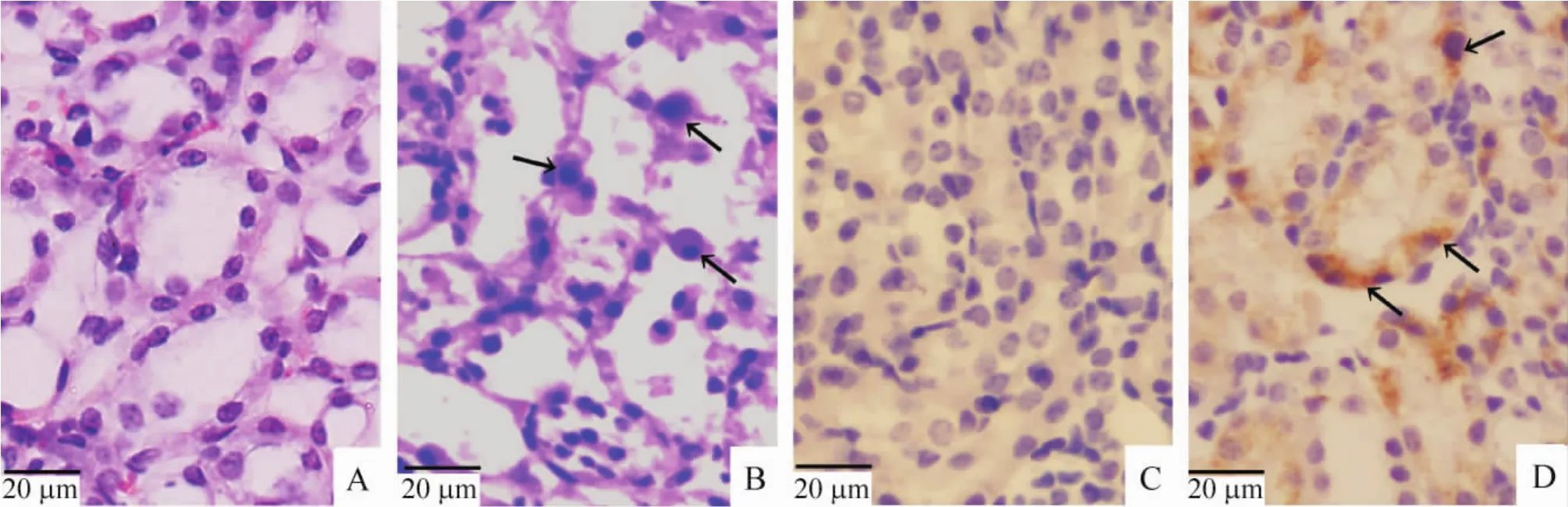
Figure2.Light microscopic photographs of rat kidneys with HE staining(A,B)and caspase-3 immunohistochemical staining(C,D)(×400).A,C:sham group;B,D:IAKI group.Arrows in B indicate apoptotic cells,while those in D indicate caspase-3-positive cells.图2 各组大鼠肾脏HE染色和caspase-3免疫组化染色的光镜照片
3.2 肝脏 Sham组动物肝脏呈正常组织表现,见图3A。AKI诱导的肝脏发生了明显的灶状坏死,这种坏死灶可大可小,着色苍白。在坏死灶内虽然可见排列紊乱的肝板但已无可辨认的肝细胞存在,被嗜酸性絮状物所代替。絮状物内无完整的肝细胞核,只残留少许核碎片及粒细胞浸润。此外还可见到固缩的肝细胞散在肝板内,细胞染色深,与周边肝细胞明显不同。有的细胞核固缩,有的核萎缩。细胞形状分2种,一种细胞呈星状,见图3B,另一种呈球状,见图3C,前者细胞核萎缩,后者细胞核染色质固缩。
Sham组肝脏caspase-3 IHC染色呈阴性反应,见图3D。AKI组肝脏可见较多的caspase-3 IHC染色阳性细胞,阳性反应颗粒出现在细胞质内,见图3E、F,特别是在坏死灶周边以及肝小叶界板内多见。
4 电子显微镜观察所见
Sham组肝细胞显示出正常结构:细胞核染色质疏松,核仁明显,各种细胞器均发达,内含物丰富,见图4A。AKI动物肝脏内呈星状的固缩肝细胞表现出副凋亡特点:细胞基质电子密度高,细胞核萎缩,内质网呈小空泡串珠样扩张,线粒体变性均质状或空泡化,见图4B。呈近球形的固缩肝细胞表现出了凋亡细胞结构特点:细胞皱缩,基质电子密度也高,线粒体、内质网等细胞器结构正常,细胞核染色质固缩,见图4C。
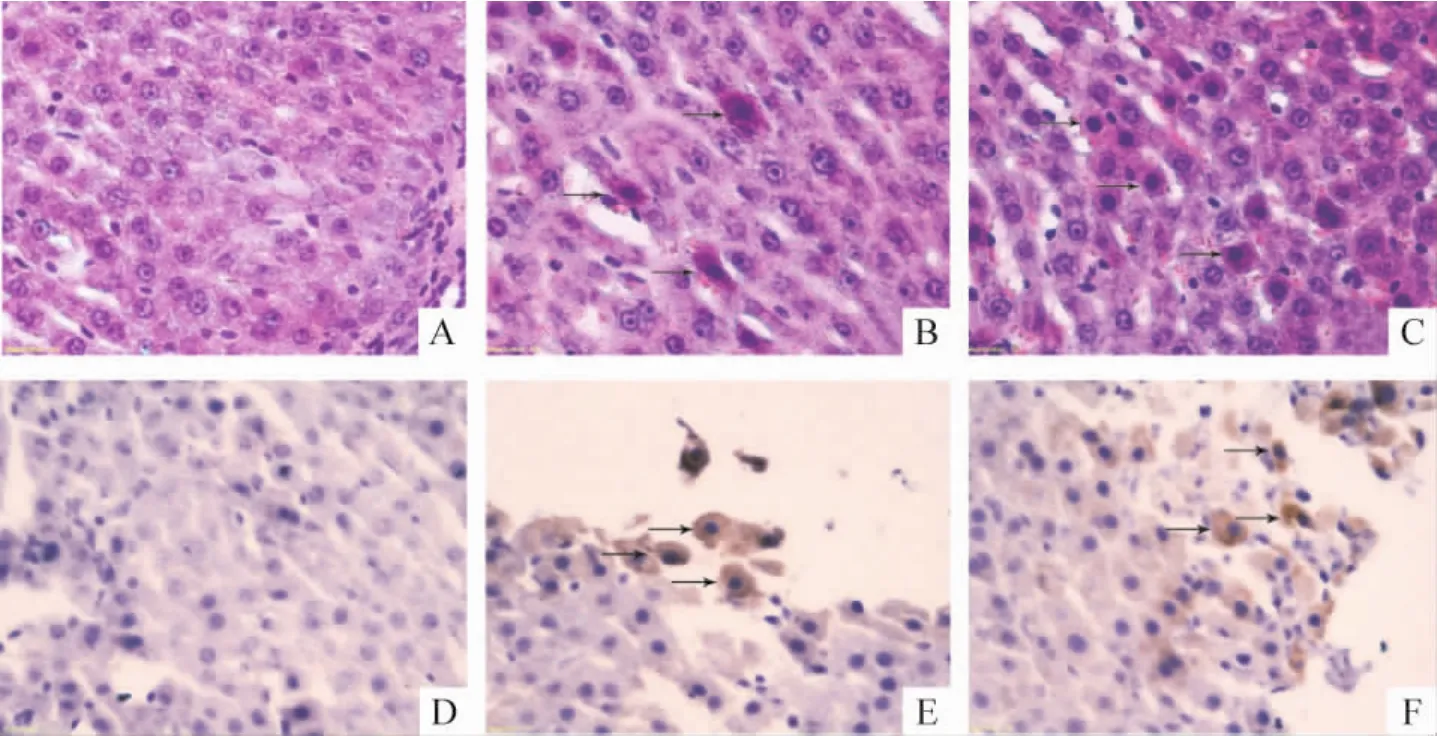
Figure3.Light microscopic photographs of rat livers with HE staining(A,B,C)and caspase-3 immunohistochemical staining(D,E,F)(×400).A,D:sham group;B,E:BNx group;C,F:IAKI group.Arrows in B and C indicate pyknotic hepatocytes,while those in E and F indicate caspase-3 -positive hepatocytes.图3 各组大鼠肝脏HE染色和caspase-3免疫组化染色的光镜照片
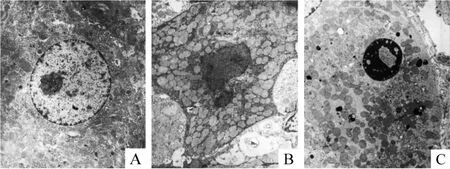
Figure4.Electron microscopic photographs of rat hepatocytes(×8000).A:a photograph of a normal hepatocyte in sham group;B:a photograph of hepatocyte undergoing para-apoptosis in BNx group showed mitochondrial vacuolization and nuclear shrinkage;C:a photograph of a hepatocyte undergoing apoptosis in IAKI group showed cytoplasmic shrinkage and a nucleus with pyknotic and marginated chromatin.图4 各组大鼠肝细胞电镜图像
讨 论
大鼠肾缺血45~60 min再灌注24 h引起的AKI是国内外公认的IAKI动物模型,而BNx又是公认的非缺血性AKI的动物模型[3-4]。从研究的结果可以看出大鼠肾缺血60 min再灌注24 h后肾功能严重损伤,与双肾切除24 h的动物血清BUN和SCr的水平相近,说明2组动物的肾功能都发生了损伤,也说明本文的缺血性和非缺血性AKI动物模型都是成功的。同时本文也发现IAKI动物和BNx动物都发生了血清ALT明显增高,说明2组动物的肝脏功能受到了较严重的损害。
本文形态学观察发现IAKI肾小管是肾缺血再灌注损伤的重灾区。特别是近髓质和髓质外带区域中的近端小管损伤尤为严重,表现为大面积上皮细胞坏死以及坏死细胞之间明显的细胞凋亡,构成了IAKI动物急性肾功能损伤的病理学基础。免疫印迹和免疫组化染色结果说明IAKI肾脏出现了明显的caspase依赖的细胞凋亡,说明除了肾小管细胞坏死外细胞凋亡也构成了肾脏缺血60 min再灌注24 h后的一个不可忽视的细胞损伤方式。
从免疫印迹法检测的结果可以看出 TNFRα蛋白在AKI(包括IAKI和BNx)动物肝脏内的表达明显增强,说明AKI诱导的肝细胞凋亡是由于某些外源性因素通过TNFRα启动而引起的。同时AKI动物肝脏的caspase-3蛋白表达明显增强。免疫组化染色结果也证实caspase-3阳性细胞在AKI动物肝脏内的存在。现已公认caspase家族的激活可使受损细胞向细胞凋亡方向发展,具体的凋亡执行者(executor)是激活了的caspase-3,是外源性细胞凋亡的主要途径。因此被称作为caspase依赖性细胞死亡(caspase-dependent cell death)[6-7]。Hassoun等[8]发现肾缺血性再灌注损伤时肺脏内出现了经TNFRα启动的caspase依赖性细胞死亡。本文的结果说明经TNFRα启动的caspase依赖的细胞死亡也参与了AKI诱导的肝细胞损伤。这为AKI肾外器官特别是肝脏受损机理的研究提供了新的视野。
IAKI组动物和BNx组动物相比较会发现两者肾功能衰竭的程度相近,免疫印迹法和免疫组化染色结果也相似,不同是前者体内有一对缺血60 min再灌注24 h内含细胞凋亡的肾脏而后者没有。然而BNx动物肝脏内却出现了与IAKI动物同样的细胞凋亡,说明AKI诱导肝脏内的细胞凋亡是由于AKI所致尿毒物质引起的。而与IAKI引起的细胞凋亡无关。换句话说,在IAKI肝脏内的细胞凋亡并不是肾缺血再灌注损伤诱导的。
形态学观察的结果说明细胞坏死和细胞凋亡共同构成了AKI诱导肝功能损伤的形态学基础。本文用光学显微镜观察发现了固缩肝细胞的出现。固缩肝细胞可分2种;一种呈球形,细胞核固缩,用电子显微镜观察证明属于细胞凋亡(图4C)。而另外一种呈星形,它与Park及助手们在2011年光镜下发现的相一致,遗憾的是他们当时没有进行电镜观察,只把它归于一种死亡的肝细胞,命名为固缩性细胞死亡(pyknotic cell death)[9]。我们也发现了这种细胞出现在AKI肝脏内,并用电镜观察发现它既不具有坏死细胞的形态学特点,也不具有细胞凋亡的表现。其细胞核萎缩但染色质无固缩边聚的表现,细胞基质电子密度极高,细胞内被细小空泡化的内质网和空泡化的线粒体所充满。这与副凋亡细胞的超微结构很相似。有学者认为副凋亡又称为非溶酶体空泡性细胞死亡(non-lysosomal vesiculate cell death),其细胞核不具有凋亡细胞核的表现,特点是由于内质网或线粒体空泡化而造成的细胞质死亡(cytoplasmic death)[10]。这些描述与本文电镜下所见相同(图4B),因此我们认为Park所说的固缩性死亡是一种副凋亡的肝细胞。至于AKI引起肝细胞副凋亡的机制如何尚需要进一步探讨。
综上所述,我们认为:(1)AKI所致肝细胞凋亡可能是经TNFRα启动的caspase依赖的细胞死亡;(2)副凋亡也参与了AKI所致肝细胞损伤。
[1]吴 昱,李晓玫.急性肾损伤相关生物标志物的研究进展[J].中国病理生理杂志,2010,26(8):1650-1653,1661.
[2]Faubel S.Acute kidney injury and multiple organ dysfunction syndrome[J].Minerva Urol Nefrol,2009,61(3):171-188.
[3]Golab F,Kadkhodaee M,Zahmatkesh M,et al.Ischemic and non-ischemic acute kidney injury cause hepatic damage[J].Kidney Int,2009,75(8):783 -792.
[4]Golab F,Kadkhodaee M,Zahmatkesh M,et al.Hepatic changes during various period of reperfusion after induction of renal ischemia in rats[J].Transplant Proc ,2009,41(7):2749-2750.
[5]White LE,Hassoun HT.Inflammatory mechanisms of organ crosstalk during ischemic acute kidney injury[J].Int J Nephrol,2012,2012:505197.
[6]Galluzzi L,Vitale I,Abrams JM,et al.Molecular definitions of cell death subroutines:recommendations of the Nomenclature Committee on Cell Death 2012[J].Cell Death Differ,2012,19(1):107 -120.
[7]Pradelli LA,Beneteau M,Ricci J.Mitochondrial control of caspase-dependent and -independent cell death[J].Cell Mol Life Sci,2010,67(10):1589 -1597.
[8]Hassoun HT,Lie ML,Grigoryev DN ,et al.Kidney ischemia-reperfusion injury induces caspase-dependent pulmonary apoptosis[J].Am J Physiol Renal Physiol,2009,297(1):F125-F137.
[9]Park SW,Chen SW,Kim M,et al.Cytokines induce small intestine and liver injury after renal ischemia or nephrectomy[J].Lab Invest,2011,91(1):63 -84.
[10]Sperandio S,de Belle I ,Bredesen DE.An alternative nonapoptotic form of programed cell death[J].Proc Natl Acad Sci U S A,2000,97(26):14376 -14381.
