Survivin-siRNA真核重组质粒对前列腺癌移植瘤的抑制作用*
2012-08-02沈维高赵丽晶闫喜惠刘艳波赵雪俭
郭 鹏, 沈维高, 赵丽晶, 闫喜惠, 刘艳波, 赵雪俭△
(北华大学1附属医院肾病风湿病科,2基础医学院病理生理学教研室,吉林 吉林 132013;3吉林大学前列腺疾病防治研究中心,吉林 长春 132001)
凋亡抑制基因survivin是1997年分选出来的一个新基因。人类survivin基因定位于染色体17q25,长约75~130 kb,含3个内含子和4个外显子,无TATA启动子结构,其编码链包含1个开放阅读框架,产生由142个氨基酸组成的分子量约16.6 kD的胞质蛋白[1]。Survivin在大多数人类肿瘤中均有高表达,前列腺癌也不例外,且与前列腺癌的发生、发展关系密切[2],其表达强度和前列腺癌细胞凋亡呈负相关[3]。RNA干扰可作为引物使mRNA转变成dsRNA,新生的dsRNA被降解,在消除靶mRNA同时又产生更多的siRNA,如此循环[4]。因此siRNA具有特异性、作用效率较高和干扰作用可扩散等特点,具有很强的抑制目的基因表达的作用。本课题组前期工作表明,针对survivin靶点的siRNA重组质粒体外明显抑制激素非依赖性前列腺癌DU145细胞生长并促进其凋亡[5],本实验主要研究survivin-siRNA是否具有体内抑瘤效应,并简要探讨其作用机制。
材料和方法
1 材料
人激素非依赖性前列腺癌DU145细胞株,由吉林大学前列腺疾病防治研究中心馈赠;大肠杆菌JM109为该中心保存;survivin-siRNA及对照质粒构建及鉴定按本课题组以前方法[5];DNA纯化试剂盒、DNA提取试剂盒为上海华舜生物工程有限公司产品;IMDM培养基为HyClone生产,新生牛血清购自北京鼎国公司;兔抗人survivin抗体及羊抗兔Ⅱ抗购自 Santa Cruz,台盼蓝购自 Sigma,K-PBS溶液(NaCl 30.8 mmol/L、KCl 20.7 mmol/L、Na2HPO48.1 mmol/L、KH2PO41.46 mmol/L、MgCl210 mmol/L 溶解于双蒸水)为自制;TUNEL染色试剂盒购自南京建成生物试剂公司;其它试剂为进口或国产分析纯;ECM830电转染仪购自BTX。
2 动物
裸鼠购自中国医学科学院实验动物研究所。BALB/c nu/nu雄性裸鼠,15只,4~6周龄,体重18~20 g,饲养于恒定温度(22~25℃)、恒定湿度(40% ~50%)的SPF层流室中,经高压灭菌的标准饲料和水供动物自由食用。
3 方法
3.1 裸鼠动物模型的建立及处理 将DU145细胞用胰蛋白酶消化成细胞悬液,离心,细胞团块在IMDM培养液中吹散,经台盼蓝实验证实细胞活力≥95%,最终细胞浓度为2.5×1010cells/L,取5×106个细胞(0.2 mL)接种于裸鼠左侧背部皮下。待移植瘤长至直径8 mm时将瘤无菌条件下取出,分成直径约2 mm的瘤块植入另取的15只裸鼠皮下。质粒溶解于K-PBS溶液中,定量,调节质粒浓度为1 g/L。待移植瘤长至直径约8 mm时将裸鼠随机分为3组,每组5只动物,mock组注射20 μL K-PBS;scrambled siRNA及survivin-siRNA进行质粒治疗(每只20 μg);在注射结束后于注射局部实行电转染。电脉冲治疗仪的参数设定:电场强度500 V/cm,脉冲时值5 μs,次数2次,频率1 Hz。两排银电极插入肿瘤组织两侧,使肿瘤位于电极中央。10 d后重复注射质粒1次。
3.2 肿瘤观察及测量 每天观察裸鼠各种生活变化,每隔5 d测量肿瘤的长径(length,L)和短径(width,W),根据公式 V=L×W2×0.52计算肿瘤的体积,绘制肿瘤的生长曲线并计算抑瘤率(inhibitory rate,IR),IR(%)=(1-治疗组瘤重/对照组瘤重)×100%。
3.3 肿瘤标本处理 在初次电转染25 d后颈椎脱臼处死裸鼠,迅速剪开皮肤,完整剥离肿块,称重,部分组织甲醛溶液固定。
3.4 病理学检查 取10%甲醛固定后的组织,石蜡包埋,4 μm连续切片分别行HE染色和survivin免疫组织化学染色。每张切片观察3个视野,每个视野连续数300个细胞,计算阳性细胞百分比。阳性细胞百分比=阳性细胞数/总细胞数×100%。结果判定:survivin在肿瘤细胞胞浆或细胞间质内出现棕黄色颗粒,且着色强度高于背景非特异性染色者判定为阳性。
3.5 TUNEL法检测肿瘤细胞凋亡 切片常规脱蜡入水,新鲜配制的3%H2O2室温处理10 min,蒸馏水洗2 min×3次。标本用proteinase K 37℃消化15 min,加标记缓冲液,每片20 μL;然后加稀释的 TdT和DIG-dUTP混合液,37℃孵育2 h。TBS洗2 min×3次。加封闭液每片 50 μL,室温 30 min,不洗。再加入生物素化抗地高辛抗体于标本片上,37℃反应30 min。TBS洗2 min×3次。加稀释的SABC染色60 min,TBS洗5 min×3次。DAB显色,苏木素轻度复染,脱水,透明,封片,显微镜观察。
细胞核染为棕黄色者即为凋亡细胞,每张切片观察3个视野,每个视野连续数300个细胞,计数凋亡细胞百分比即为凋亡指数(apoptotic index,AI)。AI(%)=凋亡细胞数/总细胞数×100%。
4 统计学处理
结 果
1 肿瘤体积监测
裸鼠背部皮下注射DU145细胞后可成功复制出荷瘤动物模型,然后将肿瘤组织取下,分成约2 mm×2 mm×2 mm小块接种背部,待移植瘤长至直径约8 mm,平均体积约(161.5±14.4)mm3时,随机分为3组,每组5只动物,并进行治疗,10 d后重复给药1次。从种植瘤块当天开始连续观察肿瘤的生长情况,并绘制各组裸鼠肿瘤的生长曲线图,见图1。与mock组及scrambled siRNA组相比,survivin-siRNA治疗组动物移植瘤生长较缓慢,初次治疗后15 d,肿瘤体积明显缩小(P<0.05);且随时间延长,治疗组动物肿瘤生长显著减慢(P<0.01)。于初次电转染25 d(即瘤块接种后35 d)处死动物取移植瘤称重,与两对照组相比,治疗组移植瘤重量明显减轻(P<0.01),见表 1。
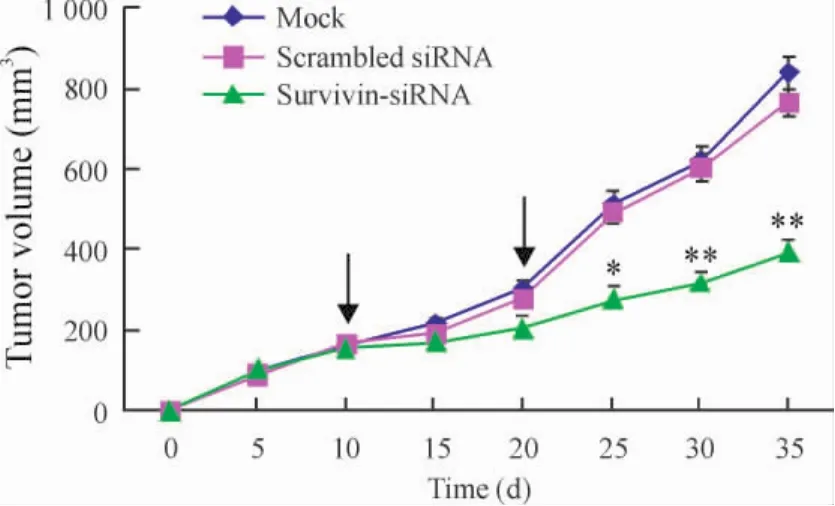
Figure1.Growth curves of DU145 xenografts treated with survivin-siRNA.Each treatment with the plasmid is shown using an arrow..n=5.*P<0.05,**P<0.01 vs mock or scrambled siRNA.图1 Survivin-siRNA对裸鼠肿瘤生长曲线的影响
表1 Survivin-siRNA对前列腺癌移植瘤重量的影响Table1.The effect of survivin-siRNA on xenograft weight(g..n=5)

表1 Survivin-siRNA对前列腺癌移植瘤重量的影响Table1.The effect of survivin-siRNA on xenograft weight(g..n=5)
**P <0.01 vs mock or scrambled siRNA.
Group Weight Mock 1.64 ±0.46 Scrambled siRNA 1.67 ±0.33 Survivin-siRNA 0.62 ±0.14**
2 肿瘤组织形态学变化
HE染色显示,两对照组动物肿瘤生长旺盛,细胞核较大深染,而治疗组与两对照组相比,瘤组织内死亡细胞较多,细胞崩解为碎片,细胞核固缩碎裂,正常组织结构消失,呈现无结构嗜伊红染色区等形态学改变,见图2。
3 肿瘤组织survivin表达
由图3可知,survivin表达的阳性颗粒主要位于肿瘤细胞的胞浆内,少数位于细胞核和间质中。Mock组阳性细胞为(67.2±11.3)%,scrambled siRNA组阳性细胞为(71.2±8.91)%,而survivin-siRNA组其表达明显降低,阳性率为(31.2±8.3)%,与两对照组比较差异显著(P<0.01)。
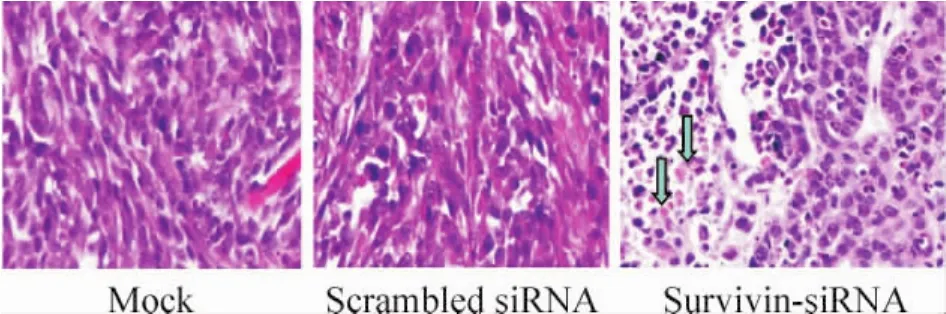
Figure2.HE staning for DU145 xenografts treated with survivin-siRNA(×200).Blue arrows represent death cells.图2 前列腺癌移植瘤HE染色结果
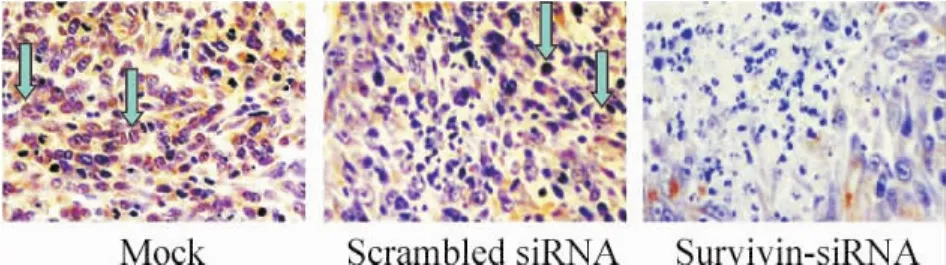
Figure3.Immunohistochemical analysis of survivin expression inDU145 xenografts treated with survivin-siRNA( × 200) . Blue arrows represent survivin - positivecells.图3 前列腺癌移植瘤survivin免疫组织化学染色结果
4 肿瘤细胞凋亡检测
治疗组肿瘤组织内见大量细胞核染为棕黄色的凋亡细胞,而两对照组仅见少许凋亡细胞,见图4。如表2所示,治疗组细胞凋亡指数明显高于对照组(P <0.01)。
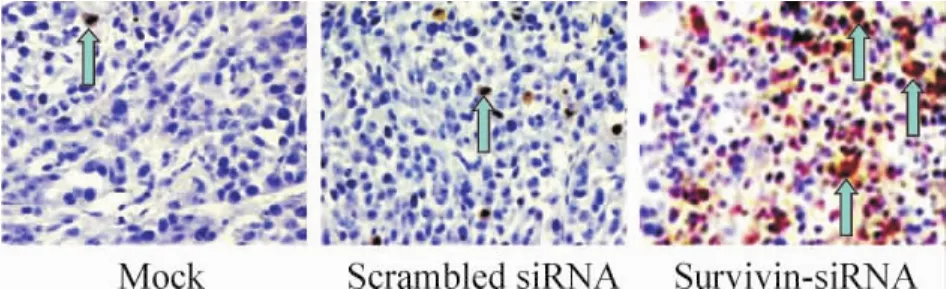
Figure4.Apoptosis of DU145 xenografts treated with survivinsi RNA detedcted by TUNEL assay(×200).Blue arrows represent apoptotic cells.图4 TUNEL染色检测前列腺癌移植瘤细胞凋亡情况
表2 Survivin-siRNA对DU145细胞移植瘤凋亡指数的影响Table2.Apoptotic index(AI)of DU145 xenografts treated with survivin-siRNA(%..n=5)

表2 Survivin-siRNA对DU145细胞移植瘤凋亡指数的影响Table2.Apoptotic index(AI)of DU145 xenografts treated with survivin-siRNA(%..n=5)
**P <0.01 vs mock or scrambled siRNA.
Group AI Mock 4.13 ±1.71 Scrambled siRNA 5.64 ±1.32 Survivin -siRNA 27.90 ±5.91**
讨 论
Survivin作为新的凋亡抑制因子,其独特的组织表达特异性及促进增殖、抑制凋亡等生物学功能受到国内外学者广泛关注。围绕survivin的分子生物学特点、生物学功能,特别是在细胞凋亡中的作用进行了一系列研究,证实survivin是一个多功能的分子[6]。其功能主要包括:(1)在染色体过客蛋白复合物中定位和有丝分裂中起关键作用;(2)survivin通过caspase和非caspase途径对肿瘤细胞凋亡进行调控;(3)survivin在肿瘤细胞中的表达情况与肿瘤的放、化疗抵抗关系密切,某些药物可通过抑制survivin的表达发挥抗癌效应。根据现有的研究,其抗凋亡作用及在肿瘤发生、发展中的作用已经逐步得到肯定[7]。此外,肿瘤细胞中survivin过表达会帮助肿瘤细胞逃避细胞周期检验点,从而使肿瘤细胞逃避凋亡,实现异常增殖。Zhang等[8]研究发现,用雄激素刺激激素依赖性前列腺癌细胞(LNCaP)能够增加survivin的表达,相反,抗激素治疗会降低其表达。通过转染增加survivin的表达还会降低抗雄激素药物的治疗效果。进一步研究发现[9],在LNCaP和激素非依赖性前列腺癌细胞(PC-3和DU145)过表达survivin会增加对紫杉醇(抗肿瘤药)的抗性等。
本课题组应用真核细胞转染技术将特异性survivin-siRNA表达质粒转染前列腺癌DU145细胞株,发现该质粒可促进细胞凋亡并抑制细胞内survivin基因及蛋白表达[10],为体内研究奠定了坚实基础。本实验复制裸鼠前列腺癌皮下移植瘤模型,并在肿瘤内注射了DNA,但裸DNA转染效率低,抑制靶蛋白表达作用不理想。其主要原因可能有:(1)DNA必须穿过细胞膜;(2)DNA到达细胞内后,需通过核膜进入细胞核。因而严重阻碍了该技术的进一步应用。如何提高siRNA的抑制效率,寻找更有效的体内基因转染手段,日益受到重视。电脉冲介导的基因转染方法,克服了病毒载体容量小、具有安全隐患等问题。所谓电脉冲法是将组织置于高压脉冲电场内,在注射部位给予短时间的电脉冲,通过电刺激,使细胞膜产生可逆性穿孔,促使肿瘤周围DNA渗进细胞内,易于获得更多的DNA质粒到细胞质,但目前尚不清楚是否电刺激有利于质粒穿过细胞核屏障到达细胞核内[11]。但有研究表明,电脉冲基因转染效率较单纯注射质粒基因转染效率提高近50倍,并可持续表达,最长可持续6个月以上[12]。本实验利用电脉冲方法将治疗质粒及对照质粒转染肿瘤细胞内,结果证实:与两对照组相比,survivin-siRNA组在初次治疗后15 d肿瘤体积与对照组相比具有统计学意义(P<0.05),随着治疗时间的延长,平均瘤体积和瘤重量均明显降低(P<0.01)。这说明电脉冲介导的基因体内治疗方法可行,并具备安全、简单、经济等优点,具有实际应用前景。
通过HE染色和TUNEL染色发现,治疗组肿瘤细胞发生明显凋亡,凋亡指数明显升高;免疫组织化学染色发现,survivin-siRNA重组质粒降低肿瘤组织内survivin蛋白表达,说明survivin-siRNA抑制肿瘤生长是通过促进细胞凋亡实现的,但具体的凋亡途径还需进一步探讨。
[1]Li F,Abmrosini G,Chu EY,et al.Control of apoptosis and mitotic spindle checkpoint by survivin[J].Nature,1998,396(6711):580 -584.
[2]刘艳波,沈维高,葛 贺.等.Survivin和GRIM-19在前列腺癌组织中的表达[J].中华男科学杂志,2011,17(12):21-26.
[3]Al-Maghrebi M,Kehinde EO,Anim JT,et al.The role of combined measurement of tissue mRNA levels of AMACR and survivin in the diagnosis and risk stratification of patients with suspected prostate cancer[J].Int Urol Nephrol,2012,44(6):1681-1689.
[4]孔祥平.核糖核酸干扰[J].中国病理生理杂志,2004,20(5):900-903.
[5]刘艳波,沈维高,芦丽莉,等.Survivin-siRNA对前列腺癌DU145细胞的促凋亡作用[J].中国病理生理杂志,2010,26(8):1474-1478.
[6]Li F,Ling X.Survivin study:An update of“what is the next wave?”[J].J Cell Physiol,2006,208(3):476 -486.
[7]Liu YB,Zhang L,Guo YX,et al.Plasmid-based Survivin shRNA and GRIM-19 carried by attenuated Salmonella suppresses tumor cell growth[J].Asian J Androl,2012,14(4):536-545.
[8]Zhang M,Latham DE,Delaney MA,et al.Survivin mediates resistance to antiandrogen therapy in prostate cancer[J].Oncogene,2005,24(15):2474 -2482.
[9]Zhang M,Mukherjee N,Bermudez RS,et al.Adenovirus-mediated inhibition of survivin expression sensitizes human prostate cancer cells to paclitaxel in vitro and in vivo[J].Prostate,2005,64(3):293-302.
[10]刘艳波,葛 贺,芦丽莉,等.Survivin-siRNA真核重组质粒的构建和鉴定及对前列腺癌DU145细胞的影响[J].中国老年学杂志,2010,30(5):642-645.
[11]Lucas ML,Heller R.Immunomodulation by electrically enhanced delivery of plasmid DNA encoding IL-12 to murine skeletal muscle[J].Mol Ther,2001,3(1):47 -53.
[12]Bureau MF,Scherman D.Plasmid DNA electrotransfer:a new non viral method for gene therapy in oncology[J].Technol Cancer Res Treat,2002,1(2):149 -152.
