玉米ZmAATP基因的克隆及遗传转化载体的构建
2012-07-16于林卉刘保申李文兰张宪省赵翔宇
于林卉,刘保申,李文兰,张宪省,赵翔宇
(山东农业大学,山东省作物生物学重点实验室,作物生物学国家重点实验室,山东 泰安 271018)
三磷酸腺苷(ATP)是生物体内主要的能源载体。ATP跨膜转运是生物体能量运用的重要方式。ATP-ADP转运蛋白(ATP-ADP translocator protein,AATP)是真核生物的一种腺苷酸转运载体,是质体ATP浓度的主要调节者[1]。虽然叶绿体具有通过光合作用产生ATP的能力,但当夜间ATP不能直接产生时,则需要通过跨膜转运的方式将ATP能量转运到叶绿体内,维持其正常的生理代谢[2]。而在非光合质体中,一些依赖ATP的反应(如淀粉和脂肪酸合成)必须依靠从细胞质中转运ATP来维持自身的生理代谢[3]。另有研究表明,增加细胞内ATP含量、降低细胞外ATP水平可抑制花药开裂,由此发现ATP的外运是影响花粉成熟和授粉能力的一种新型的细胞外信号[4]。到目前为止,质体的ATP/ADP转运被发现存在于所有高等和低等植物中[5]。AATP是一种普遍存在于质体膜上转运载体,它能够介导细胞质中高浓度的ATP转运到质体腔内,同时专一地与质体腔内等量的ADP分子结合并转移到膜外释放[6]。由此可见,质体腔内一些依赖ATP提供能量的重要代谢途径(如淀粉合成、脂肪酸合成等)均受到AATP活性的调控。
质体ATP-ADP转运蛋白家族与腺苷酸转运家族具有很高的同源性[7]。在拟南芥中,至少有两组不同的转运蛋白家族成员横跨质体内膜介导ATP转运。双突变T-DNA插入敲除AtAATP1和AtAATP2导致一系列不同的表型,其中包括减少根系生长,延迟叶片叶绿素积累,种子中的脂肪含量减少等[8]。AtAATP1和AtAATP2为表达模式不同的异构体。AtAATPT1为糖诱导基因,主要在根和茎中表达,外源葡萄糖或蔗糖出现时其表达水平提高。AtAATP2则在幼根和子叶中表达量最高。在种子发育的脂类积累过程中AtAATP1和AtAATP2均有所表达。由此可见,质体中AATP蛋白的转运活性对拟南芥种子中的脂质合成具有显著的调节作用[8]。
在马铃薯块茎中,质体ATP-ADP转运蛋白(StAATP)调控块茎内淀粉积累[9],并且在此代谢途径中具有较高的控制系数[10]。J.Tjaden等将AATP基因cDNA的正向和反向结构转入马铃薯,结果表明,转基因马铃薯块茎中的AATP表达量受到相应影响,且正向表达结构转基因马铃薯块茎的淀粉含量从18.8%提高到22.7% ~27.0%,反向表达结构转基因马铃薯块茎的淀粉含量则下降到11.5% ~18.0%。事实上,ATP-ADP转运蛋白在马铃薯淀粉合成途径中的转运活性控制系数达到0.78以上[10]。由于质体内部承载着广泛的代谢途径,推测ATP进入质体的过程受到损害将导致一系列不同表型。反义抑制StAATP1马铃薯已被证明不仅导致块茎中淀粉含量下降,也导致块茎出现不定芽等形态变化。同时,转基因块茎中对链格孢菌引起的马铃薯早疫病和欧文氏菌属引起的马铃薯软腐病的抗性增强,而且转基因植株叶片对马铃薯晚疫病的抗性也有所增加[11,12]。这种增强抗病性的机理仍不清楚,但可能与触发已知的植物防御基因、增加H2O2的释放能力有关[12,13]。Tremblay等利用RNA干扰的方式敲除ATP-ADP转运蛋白,转基因马铃薯块茎中合成物质积累增加了30%,块茎中可溶性蛋白含量比野生型增加近50%[14]。由此可见,ATP-ADP转运蛋白是植物质体能量代谢中必不可少的能量转运载体,同时在植物一系列ATP依赖的生理代谢途径中发挥着重要的作用。
淀粉是谷类作物胚乳中贮存光合能量的主要方式。玉米作为重要的粮食作物,其籽粒中淀粉含量占总粒重的70~80%。在玉米籽粒淀粉合成途径中,ADP-葡萄糖(ADP-Glc)是淀粉合成的直接前体,它是由ATP供能在ADP-葡萄糖焦磷酸化酶(AGPase)的催化作用下在细胞质中生成[15]。在淀粉质体内多种淀粉酶均需要在ATP供能的条件下来完成相应的催化反应从而合成淀粉。研究表明,水稻AATP在花后6~7d的幼穗中具有较强的表达,尤其在淀粉合成旺盛进行的灌浆中期,穗内OsAATP基因的合成代谢增强[16]。另外,植物细胞的胞质和淀粉体中有很高的ATP/ADP比率,提高细胞质内ATP的浓度,可以影响AGPase和淀粉酶的催化活性,促进淀粉合成。因此,具有调动ATP进入淀粉体的能力是维持质体内淀粉合成的基本需求。提高植物细胞内可利用的ATP含量,增加限速步骤中的能量来源,则可能促进淀粉合成速率和改变淀粉结构。由此可见,ATP-ADP转运蛋白在淀粉合成中起到的重要的作用[9]。
所有的质体ATP-ADP转运蛋白,如拟南芥AtNTT转运蛋白,马铃薯StAATP转运蛋白,均在特异性底物和底物亲和力方面表现出类似的输运性质[5,9,17]。由此可见,在玉米中ATP-ADP转运蛋白必然在植株能量供应和非光合质体内代谢合成等生理活动中发挥重要作用。因此,寻找玉米中存在的ATPADP转运蛋白同源基因,确定ZmAATP蛋白在玉米生长发育过程中细胞内能量代谢和质体物质交换等方面的生理作用,以期待其在提高玉米籽粒的淀粉合成能力上发挥重要作用。
本研究克隆了玉米ZmAATP基因并构建其玉米遗传转化载体,为进一步研究该基因在玉米籽粒发育和物质积累中的生物学功能奠定了基础。
2 材料与方法
2.1 植物材料
所取植物材料为玉米Q319自交系的根、茎、叶片、成熟子房、授粉后3 d种子(Days After Pollination,DAP)、8DAP种子、15DAP胚、15DAP胚乳、20DAP胚、20DAP胚乳、25DAP胚、25DAP胚乳,材料种植在山东省泰安市农科院实验田。
2.2 实验方法
2.2.1 植物组织总RNA的提取 利用Trizol试剂盒(上海生物工程公司)提取不同材料的总RNA,MMLV逆转录酶生成cDNA模板,-20℃保存。
2.2.2 玉米ZmAATP基因的克隆 基因克隆利用的是BioLabs公司的Phusion超保真DNA聚合酶试剂盒。以玉米胚乳的cDNA为模板,PCR扩增获得目的基因片段。基因克隆引物(上海生物工程公司合成)为:AATP-5:5'-GCAGATCTGCCACTGTCATTATTTATAGCCA-3',AATP-3:5'-TAAGATCTGTAGCAAGCACGAAGCAGCAAAG-3'。
PCR 反应总体积为 25.00 μL:5 × Phusion GC buffer 5.00 μL,dNTP(10 mM each)2.00 μL,cDNA template 2.00 μL,Forward Primer(5mM)2.50(L,Reverse Primer(5mM)2.50 μL,ddH2O 10.75(L,Phusion DNA polymerase 0.25 μL。AATP 基因扩增条件为:98 ℃ 30 s,98 ℃ 10 s,56 ℃ 25 s,72 ℃ 50 s,34个循环,72℃10 min,4℃结束反应。琼脂糖凝胶电泳回收目的片段,-20℃保存。将目的片段连接到平末端克隆载体PJet 1.2/blunt Vector上(Fermenta公司),22℃连接30 min。鉴定阳性质粒测序,利用分子生物学软件DNAMAN对测序结果与目的序列进行比对确认。
2.2.3 系统进化分析 通过检索GenBank数据库和利用DNAMAN软件进行多重序列比较和同源性分析。用 NCBI的 blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi.)对 ZmAATP 基因的氨基酸序列进行比对,在 NCBI上(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析基因的功能区。采用分子生物学软件DNAMAN分析ZmAATP氨基酸序列的系统进化关系。
2.2.4 荧光定量PCR分析 将反转录所得cDNA样品稀释至0.5~2 ng/μL。RT-PCR按SYBR Green PCR Master Mix说明书进行操作。使用18 sRNA作为内参基因,相同反应条件进行PCR扩增。扩增引物为:18s-S:5'-GATACCGTCCTAGTCTCAACC-3';18s-A:5'-GCCTTGCGACCATACTCC-3';AATP-DS:5'-CTGCTGCTGCTGCTAAGG-3';AATP-D:5'-TTGCTCATCTTAGTGTCCTTCC-3'。PCR 反应条件如下:95.0 ℃ 3 min;95.0 ℃ 10 s;63.0 ℃ 20 s;72.0 ℃ 15 s;Plate Read;Goto line 2 for 45 more times;Incubate at 65℃ for 20 s;Melting curve from 65 ℃ to 95 ℃,read every 0.5 ℃,hold 20 s;End。
2.2.5 基因表达载体的构建 用限制性内切酶BglⅡ单酶切携带ZmAATP基因的克隆载体,同时用限制性内切酶BamHⅠ单酶切pZP211::Ubi和pZP211::GluAⅠ空载体,回收目的片段和载体线性片段,T4连接酶连接。PCR筛选正向连接菌落,提取质粒-20℃保存。
3 实验结果
3.1 ZmAATP基因的克隆
在NCBI数据库中,检索拟南芥AtAATP基因在玉米基因组中的同源序列,根据目的序列设计引物,利用高保真酶从玉米自交系齐319的胚乳cDNA中特异性扩增并获得约1.7 Kb目的条带。经测序,该基因片段全长为1704 bp,其中开放式阅读框部分为1590 bp,由此推得,该基因编码530个氨基酸,并将其命名为ZmAATP(Zea mays.AATP)。通过在玉米MaizeGDB数据库中分析发现,ZmAATP基因定位在玉米基因组第1条染色体上,预测编码玉米ATP-ADP转运蛋白。生物信息学软件DNAMAN分析预测,ZmAATP蛋白质分子量为59.7KD,蛋白的等电点(PI)约为6.12。将其氨基酸序列在GenBank中检索,发现与已发现的 ZmATPase3(玉米,NP_001148126.1)、TaAATP(小麦,ACJ22514.1)、OsAATP(水稻,ABA97668.2)、AsAATP1(拟南芥,NP_198817.1)相比,氨基酸同源性分别为80%、79%、71%、55%,相似性比较如图1所示。
3.2 玉米ZmAATP基因的进化树分析
利用NCBI Blast程序和DNAMAN生物软件对ZmAATP基因的氨基酸序列与其它相近氨基酸进行比对分析(图2)。由ATP-ADP转运蛋白的同源关系可知,与ZmAATP亲缘关系最近的是玉米的ZmATPase3,同源性达到80%,以及高粱属中的一种未知蛋白,同源性为78%。由ZmAATP的系统发育关系可知,ZmAATP与两种蛋白的亲缘关系最近,分别是ATPase和与细胞分裂有关的ATPase蛋白家族。ZmAATP与大麦HvATPase和拟南芥AtAATP1同源关系分别为69%和55%。ZmAATP与小麦TaCDAP、水稻OsCDAP细胞分裂有关ATPase蛋白的同源关系分别为78%和71%。ZmAATP的氨基酸序列与ATPase酶的亲缘关系最近,并且部分ATPase的基因表达与细胞分裂相关,因此,ZmAATP蛋白的功能可能与ATPase相近,表现出具有与ATP代谢能力相关的性质,并且可以预见在细胞分裂旺盛的部位AATP蛋白具有一定的表达,这也与已知的AATP同源基因的生理功能相吻合。

图1 ZmAATP蛋白与玉米(Zea mays)的ZmATGase3、小麦(Triticum aestivum)的TaAATP蛋白、水稻(Oryza sativa)的OsAATP蛋白、拟南芥(Arabidopsis thaliana)的AtAATP1蛋白的氨基酸序列比对。黑色部分表示相同的氨基酸残基。Fig.1 Alignment of amino acid sequences of ZmAATP(Zea mays),ZmATPase3(Zea mays),TaAATP(Triticum aestivum),OsAATP(Oryza sativa)and AtAATP1(Arabidopsis thaliana). Identical amino acid residues are shaded inblack.
我们利用NCBI Blast分析程序对ZmAATP蛋白序列结果进行保守区分析。结果如图3所示,ZmAATP含有一个AAA P-loop NTPase superfamily结构域,在序列第255个氨基酸附近具有一个ATP结合位点,其后连接一个线粒体跨膜转运的结构域,由此可见,玉米ATP-ADP转运蛋白与ATP具有一定的亲和力,并且具有可以通过质体内膜进行跨膜转运的能力。ZmAATP蛋白这一结构域说明其在玉米植株内具有与ATP能量代谢相关的生理功能,并且能够为玉米植株正常的生理活动提供能量。
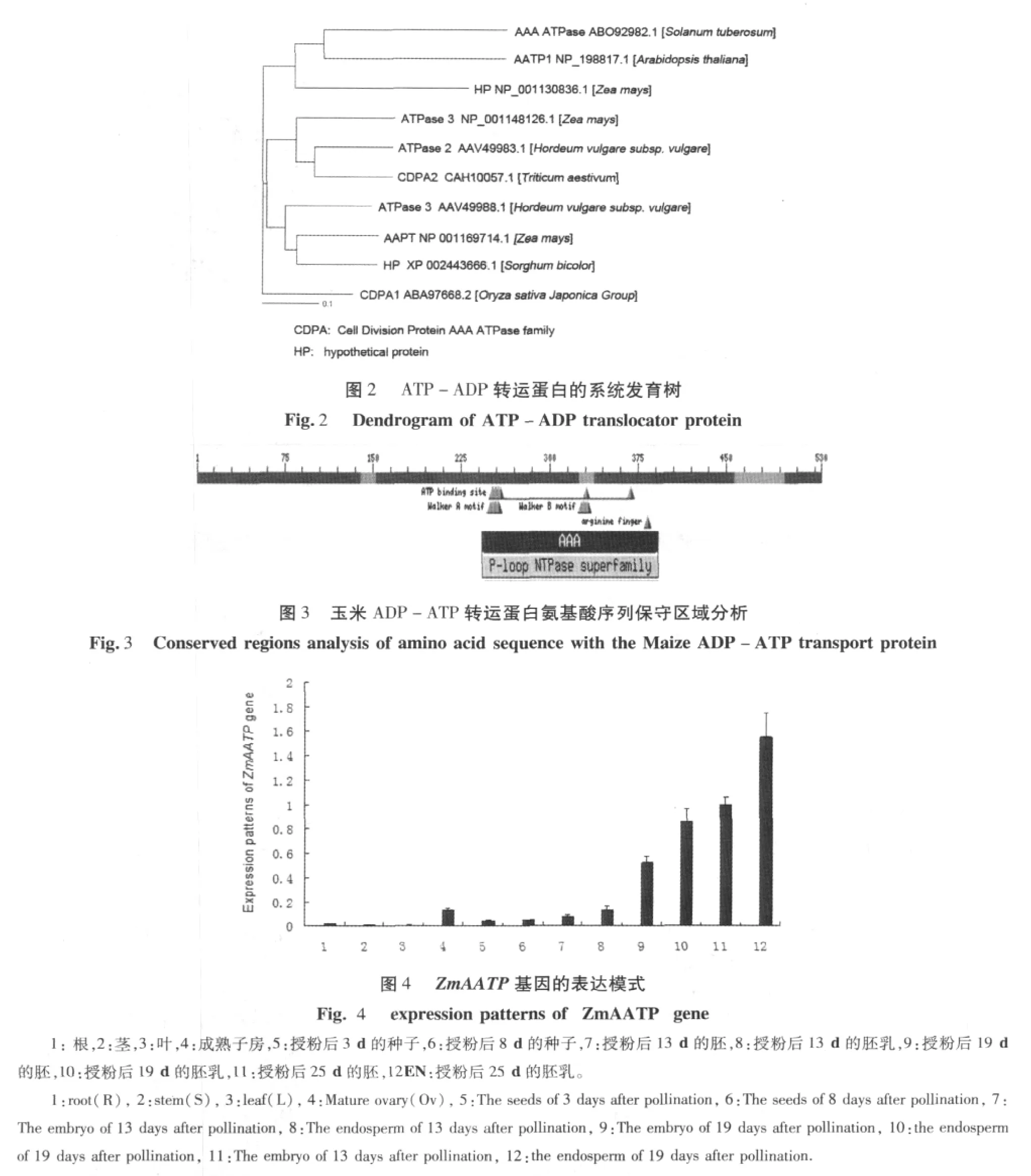
3.3 玉米ZmAATP基因的表达模式分析
为了进一步研究ZmAATP基因在玉米植株中表达模式,我们利用实时荧光定量PCR技术对ZmAATP基因在不同发育时期的不同玉米组织中的表达模式进行分析。分别以玉米根(R)、茎(S)、叶(L)、成熟子房(Ov)、授粉后3 d种子(Days After Pollination,DAP)、8DAP种子、15DAP胚、15DAP胚乳、20DAP胚、20DAP胚乳、25DAP胚、25DAP胚乳的cDNA为模板,设计引物进行荧光定量PCR扩增。从结果中可以看出(图4),ZmAATP基因在玉米植株中呈现组织特异性表达。在玉米根、茎、叶中表达量较低,成熟子房中有一定的表达量,而授粉后其基因的表达量降低,但随着玉米籽粒的发育,ZmAATP基因的表达量逐渐提高,并在授粉后25 d的种子内表达量达到最大值。
3.4 玉米ZmAATP基因表达载体的构建
为了进一步利用转基因技术研究该基因的生物学作用,我们构建了不同启动子驱动该基因的表达载体。本实验所用表达载体骨架是pZP211,启动子为组成型表达的Ubi(ubiquitin)启动子和胚乳特异型启动子GluAⅠ。在基因扩增时在ZmAATP引物两端添加BglⅡ酶切位点,其中,BamHⅠ和BglⅡ为具有相同黏性末端的同尾酶。将已经获得的、测序无误的ZmAATP基因片段经限制性内切酶BglⅡ单酶切后,连接到pZP211载体的Ubi启动子和GluAⅠ启动子下游的BamHⅠ酶切位点,构建组成型表达载体pZP211Ubi::AATP以及胚乳特异性表达载体pZP211GluA1::AATP。载体图与酶切检测结果如图5所示。

图5 玉米ZmAATP基因的载体图与酶切检测结果Fig.5 The expression vector map of ZmAATP gene and the result of cutting the vector of ZmAATP gene using restriction enzymes.
4 讨论
玉米籽粒是玉米最重要的营养器官,籽粒中贮藏淀粉的含量占总粒重的70% ~80%。因此,提高籽粒中淀粉含量,对玉米提高产量具有重要作用。淀粉质体是玉米胚乳细胞内淀粉合成的主要场所,质体内含有淀粉合成一系列关键酶及同工酶。淀粉合成底物ADP-葡萄糖是在ATP供能的条件下由ADP-葡萄糖焦磷酸化酶(AGPase)催化在细胞质中生成[18]。胚乳细胞的淀粉合成前体ADP-Glc必须经过质体内膜上的转运蛋白跨膜转运才能参与淀粉合成,而ADP-Glc的转运则需要质体内等量ADP交换才能完成[15]。在这过程中,细胞质中AGPase和质体内一系列淀粉酶的催化反应均需要ATP供能,酶的活性受到ATP的调控,因此,具有调动ATP进入淀粉体的能力是维持质体内淀粉合成的基本需求[19]。由此可见,ATP-ADP转运蛋白在维持玉米胚乳细胞的正常淀粉合成途径中发挥重要的作用。
克隆得到的ZmAATP(NM_001176243)的基因,编码玉米胚乳细胞ATP-ADP腺苷酸转运蛋白。该基因在玉米植株中特异性表达,其表达蛋白与玉米ZmATPase3同源性为80%,拟南芥AtAATP1同源性为55%,含有ATP结合域和线粒体跨膜转运结构域。可以预测ZmAATP蛋白的功能与ATPase功能相近,可能具有ATP酶的活性,该基因也必然会在ATP能量代谢和ATP跨膜转运中发挥作用。ZmAATP基因主要在种子中表达,并且随着授粉后玉米籽粒的发育其表达量逐渐提高。授粉后,籽粒中ZmAATP基因的表达量有所下降,这种变化可能是由于受精作用导致籽粒中基因表达模式发生剧烈变化所致。然而随着授粉后种子的发育和物质代谢的进行,无论是胚中还是胚乳中ZmAATP基因的表达量均随授粉后时间的增加而逐渐增大,并且在授粉后13 d左右其表达量急剧增强,最终在籽粒发育成熟时达到最高峰。前人研究表明,在水稻籽粒灌浆期间OsAATP的表达量有所提高[16],此时ZmAATP的高水平表达同水稻中的表达相一致。由此推测授粉后13 d左右也玉米籽粒的灌浆期,此时籽粒内淀粉合成和新陈代谢旺盛进行,细胞分裂能力增强,物质积累对能量需求增加,需要AATP转运大量的ATP能量为籽粒内的生理活动供能。由此可见,ZmAATP基因在玉米籽粒灌浆中期胚和胚乳中的表达量急剧升高,反映了AATP转运蛋白在非光合质体能量供应和物质代谢中的重要作用。
另外,在玉米籽粒的胚和胚乳中均有ZmAATP基因的表达,而在玉米胚乳中的表达量明显高于其在胚中的表达量。由于淀粉是玉米籽粒主要的贮藏物质,ZmAATP基因的表达与淀粉合成直接相关,因此,在胚乳细胞中该基因的表达较高。因此,可以期待同源的玉米ZmAATP基因,在促进玉米胚乳内的淀粉合成,提高籽粒中的淀粉含量等方面做出一定的贡献。而在玉米胚中含有大量脂类代谢物,胚中具有独立的脂肪代谢途径。有研究表明,在拟南芥种子的脂类积累过程中AtAATP1和AtAATP2均有一定的表达量[8]。另外,ATP也是脂肪酸合成途径的能量供体,由此可以预见AATP基因在胚内脂类合成的过程中也将发挥一定作用。据此推测,ZmAATP转运蛋白参与到玉米胚内脂肪酸合成的过程中,为玉米胚的发育提供能量。这也说明AATP基因在种子的胚和胚乳的发育中均发挥作用,在提供淀粉合成和脂肪酸合成所需能量,促进玉米籽粒物质积累、籽粒成熟等生理活动中扮演着重要的角色。
综上所述,ZmAATP基因在玉米种子内贮藏物质合成和质体内能量代谢等方面发挥重要作用,在促进玉米籽粒发育和物质积累等生理活动中扮演着重要的角色。依据ATP-ADP转运蛋白的性质,我们构建了玉米组成型启动子(Ubi)和胚乳特异性启动子(GluAⅠ)启动的ZmAATP基因的过量表达载体。利用转基因技术提高ZmAATP在玉米植株和胚乳中的表达量,进一步验证ZmAATP的基因功能及在玉米淀粉合成和种子发育中的重要作用,并且对于促进玉米籽粒中淀粉和脂类合成,提高籽粒粒重,增加玉米产量等方面具有重要意义。
5 结论
本研究克隆得到一个玉米ZmAATP基因,预测其表达蛋白具有ATPase活性,证明其在授粉后玉米籽粒的发育和物质积累过程中具有较高表达,构建了分别由组成型启动子(Ubi)和胚乳特异型启动子(GluAⅠ)驱动的ZmAATP基因的过表达载体,为进一步研究该基因在玉米中的生物学功能奠定了基础。
[1]Winkler H H,Neuhaus H E.Non-mitochondrial ATP transport[J].Trends Biochem Sci,1999,24:64-68
[2]Deniaud A,Panwar P,Frelet-Barrand A,etal.Oligomeric status and nucleotide binding properties of the plastid ATP/ADP transporter 1:toward a molecular understanding of the transport mechanism[J].PLoS One,2012,7(3):e32325
[3]Linka N.,Weber A P.Intracellular metabolite transporters in plants[J].Mol Plant,2010,3:21-53
[4]Rieder B,Ekkehard Neuhaus H.Identifi cation of an Arabidopsis Plasma Membrane–Located ATP Transporter Important for Anther Development[J].The Plant Cell,May 2011,23:1932-1944
[5]Linka N,Hurka H,Lang B F,etal.Phylogenetic relationship of non-mitochondrial nucleotide transport proteins in bacteria and eukaryotes[J].Gene,2003,306:27-35
[6]Tjaden J,Schw ppe C,M hlmann T,etal.Expression of the plastidic ATP/ADP transporter gene in Escherichia coli leads to a functional adenine nucleotide transport system in the bacterial cytoplasmic membrane[J].Biol Chem,1998b,273:9630-9636.
[7]Kampfenkel K,M hlmann T,Batz O,etal.Molecular characterization of an Arabidopsis thaliana cDNA encoding a novel putative adenylate translocator of higher plants[J].FEBS Lett,1995,374:351-355
[8]Reiser J,Linka N,Lemke L,etal.Molecular physiological analysis of the two plastidic ATP/ADP transporters from Arabidopsis[J].Plant Physiol,2004,136:3524-3536
[9]Tjaden J,M hlmann T.,Kampfenkel K,etal.Altered plastidic ATP/ADP-transporter activity infl uences potato(Solanum tuberosum)tuber morphology,yield and composition of tuber starch[J].Plant Journal,1998a,16:531-540
[10]Geigenberger P,Stamme C,Tjaden J,etal.Tuber physiology and properties of starch from tubers of transgenic potato plants with altered plastidic adenylate transporter activity[J].Plant Physiol,2001,125:1667-1678
[11]Linke C,Conrath U,Jeblick W,etal.Inhibition of the plastidic ATP/ADP transporter protein primes potato tubers for augmented elicitation of defense responses and enhances their resistance against Erwinia carotovora[J].Plant Physiol,2002,129:1607-1615
[12]Conrath U,Linke C,Jeblick W,etal.Enhanced resistance to Phytophthora infestans and Alternaria solani in leaves and tubers,respectively,of potato plants with decreased activity of the plastidic ATP/ADP transporter[J].Planta,2003,217:75-83
[13]Orozco-Cadenas M L,Narvaez-Vasquez J,Ryan C A.Hydrogen peroxide acts as a second messenger for the induction of defense genes in tomato plants in response to wounding,systemin,and methyl jasmonate[J].Plant Cell,2001,13:179-191
[14]Tremblaya R,Diaob H,Hunera N,etal,The development of a high-yield recombinant protein bioreactor through RNAi induced knockdown of ATP/ADP transporter in Solanum tuberosum[J].Journal of Biotechnology,2011,156:59-66
[15]Beckles D M,Craig J.ADP-glucose pyrophosphorylase is located in the plastid in developing tomato fruit[J].Plant Physiol,2001,126(1):261-6
[16]黄伟奇,胡昌泉,苏 军,等.转ATP/ADP转运蛋白基因籼稻的初步研究[J].福建农林大学学报,2007,36(5):1671-5470
[17]Mohlmann T.,Tjaden J,Schwoppe C,etal.Occurrence of two plastidic ATP/ADP transporters in Arabidopsis thaliana L.molecular characterisation and comparative structural analysis of similar ATP/ADP translocators from plastids and Rickettsia prowazekii.Eur[J].Biochem,1998,252:353-359
[18]Kirchberger S,Leroch M.,Huynen M A,etal.Molecular and biochemical analysis of the plastidic ADP-glucose transporter(ZmBT1)from Zeamays.The Journal of Biological Chemistry[J].2007,282(31):22481-22491
[19]Preiss J,Ball K,White S B,etal.Starch biosynthesis and its regulation[J].Biochem Soc Trans,1991,19:539-547
