泡桐MSAP体系建立及引物筛选
2012-07-14曹喜兵赵改丽范国强
曹喜兵,赵改丽,范国强
(河南农业大学泡桐研究所,河南郑州450002)
DNA甲基化是真核细胞基因组主要的修饰方式之一,DNA甲基化特别是胞嘧啶甲基化具有表观遗传效应和突变效应,与基因表达调控、细胞分化、基因组印记、性染色体失活及细胞记忆等生物学过程密切相关[1~4].检测 DNA甲基化的方法有高效液相色谱法、重亚硫酸盐法、甲基化特异性PCR、基因芯片法、质谱或色谱法以及甲基化敏感扩增多态性等方法[5].其中,甲基化敏感扩增多态性( Methylation sensitive amplification polymorphism,MSAP)是最常用的方法.该技术是在 AFLP技术基础上建立起来的,用甲基化敏感的同裂酶Hap II和Msp I代替AFLP高频内切酶Mse I.目前,该方法在毛竹(Phyllostachys heterocycla Var)、红豆杉(Taxus media)、杉木(Cunninghamia laneeolata(lamb.))、落叶松(Larix.leptolepis)、橡胶树(Hevea brasiliensis)[6~10]等研究中得到应用.泡桐(Paulownia spp.)是中国重要的速生用材和绿化树种之一,在改善生态环境和提高农民生活水平等方面起到重要作用,但丛枝病的发生严重影响了人们种植泡桐的积极性.研究表明,泡桐丛枝病的发生与DNA甲基化水平改变有关[11],但目前国内外还未见有DNA甲基化模式变化与丛枝病发生相关的报道.本研究以豫杂一号泡桐为材料,建立了泡桐MSAP体系,并进行了引物筛选,以期为进一步阐明丛枝病发生与DNA甲基化的关系奠定基础.
1 材料与方法
1.1 试验材料
河南农业大学泡桐研究所林木生物技术实验室培养30 d的豫杂一号泡桐(Paulownia tomentosa×Paulownia fortunei)组织培养幼苗长约1 cm的顶芽.
1.2 试验方法
1.2.1 泡桐DNA提取 泡桐DNA的提取参照文献[12].
1.2.2 泡桐MSAP双酶切体系优化 300 ng模板DNA,2.5 μL Buffer T,2.5 μL 0.1%BSA,16 U EcoR I,10 U HapⅡ,加离子水至25 μL.另1 种双酶切反应体系为300 ng 模板 DNA,2.5 μL Buffer T,2.5 μL 0.1%BSA,16 U EcoR I,10 U MspⅠ,加离子水至 25 μL.各体系混匀后于Biometra TGRADIENT PCR仪上进行37℃ 消化,80℃ 失活20 min,取5 μL在1%的琼脂糖凝胶上用高电场(4~5 V·cm-1)检测酶切效果.将酶切时间分为4,8,12 h的梯度,经1%琼脂糖电泳后,筛选出最佳酶切时间.
1.2.3 泡桐MSAP连接体系的优化 连接反应体系包括20 μL上述酶切产物以EcoR I/HapⅡ组合为标准(以下同).0.16 μmol·L-1EcoR I接头,1.6 μmol·L-1H/M 接头,2.5 μL 10 × T4Buffer,T4连接酶 (5 U·μL-1)用量为2.0 U,加去离子水至25 μL.混匀后于PCR扩增仪上22℃连接,连接时间分6,8,18 h.
1.2.4 泡桐MSAP预扩增体系优化
1.2.4.1 连接产物用量的优化 在不同体系中分别加入5 μL稀释为1,10,20,50,100倍的连接产物,100 μmol· L-1dNTP,1 U Taq 酶,0.25 μmol·L-1E00,0.25 μmol·L-1H/M00,2 .5 μL 10 ×PCR Buffer,用去离子水补至 20 μL.
1.2.4.2 dNTP浓度的优化 在不同体系中分别加入 dNTP 25,50,100,200 μmol·L-1,5 μL DNA( 连接产物稀释 5 倍 ),0.25 μmol·L-1E00,0.25 μmol·L-1H/M00,1U Taq 酶,2.5 μL 10 × PCR Buffer,用去离子水补至 20 μL.
1.2.4.3 引物浓度的优化 在不同体系中分别加入预扩增引物 E00 和 H/M00 0.15,0.25,0.35,0.5 μmol·L-1,5 μL DNA(连接产物稀释 5 倍),100 μmol·L-1dNTP,1 U Taq 酶,2.5 μL 10 × PCR Buffer,用去离子水补至 20 μL.
1.2.4.4 Taq酶量的优化 在不同体系中分别加入 Taq 酶 (5 U·μL-1)0.25,0.5,1.0,2.0 U,其余为5 μL DNA(连接产物稀释 5倍 ),0.25 μmol· L-1E00,0.25 μmol· L-1H/M00,100 μmol·L-1dNTP,2.5 μL 10 × PCR Buffer,用去离子水补至20 μL.扩增程序为:94℃预变性 2 min,然后94℃,30 s;56℃,1 min;72℃,1 min;扩增29个循环,72℃,10 min;最后4℃保存.
1.2.5 泡桐MSAP选择性扩增体系优化
1.2.5.1 预扩增产物用量的优化 在不同体系中分别加入 5 μL 稀释1,20,30,80,150 倍预扩增产物,0.3 μmol·L-1EcoRⅠ,0.3 μmol·L-1H/M(E+AAA+H/M+AAA),100 μmol·L-1dNTP,1.0 U Taq 酶,2.5 μL 10 × PCR Buffer,加去离子水至20 μL.
1.2.5.2 dNTP浓度的优化 在不同体系中分别加入 dNTP 25,50,100,200 μmol·L-1,稀释 20 倍预扩增产物 5 μL,0.3 μmol·L-1EcoR I,0.3 μmol·L-1H/M(E+AAA+H/M+AAA),1.0 U Taq酶,2 .5 μL 10 × PCR Buffer,加去离子水至20 μL.
1.2.5.3 引物浓度的优化 在不同体系中分别加入EcoRⅠ引物和H/M引物(E+AAA+H/M+AAA)0.05,0.2,0.3,0.4 ,0.5 μmol·L-1稀释 20倍预扩增产物 5 μL,100 μmol·L-1dNTP,1.0 U Taq 酶,2.5 μL 10 × PCR Buffer,加去离子水至20 μL.
1.2.5.4 Taq酶量的优化 在不同体系中分别加入 Taq 酶 0.25,0.5,1.0,2.0 U,稀释20 倍预扩增产物 5 μL,0.3 μmol·L-1EcoRⅠ,0.3 μmol·L-1H/M,100 μmol·L-1dNTP,2.5 μL 10 × PCR Buffer,加去离子水至20 μL.泡桐MSAP体系建立所用选择性扩增引物为(E+AAA+H/M+AAA).
1.2.6 泡桐 MSAP引物筛选 以优化后的 MSAP体系,均采用3个选择性碱基合成的64×64对选择性引物进行筛选.取选择性扩增后样品5 μL在2% 琼脂糖上 (4~5 V·cm-1)电泳检测扩增效果.然后,将2.5 μL uffer加到装有试验效果较好的15 μL引物扩增产物的PCR管内混匀,95℃变性5 min后,取5 μL样品,用4% 变性聚丙烯酰胺凝胶,在60 W恒功率条件下电泳2 h,凝胶银染后扫描,选择谱带清晰和易计数的引物作为 MSAP反应的最佳引物.扩增程序为:94℃预变性 2 min,然后94℃,30 s;65℃,1 min(以后每循环降0.7℃ );72℃,1 min,扩增12个循环;94℃ ,30 s;54℃,30 s;72℃,1 min;扩增24个循环,72℃,10 min,最后4℃ 保存.
2 结果与分析
2.1 泡桐MSAP酶切反应体系优化
本试验在AFLP的基础上采用300 ng的模板DNA进行MSAP体系的优化,并对300 ng的模板DNA进行不同时间的酶切处理,经1% 琼脂糖电泳检测发现,经4,8,12 h酶切后,DNA片段都能被完全切开,并且几乎没差别(图1),为保证MSAP试验顺利进行,故本研究采用8 h酶切.
图1 不同时间酶切DNA的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of DNA products
2.2 泡桐MSAP连接反应体系的优化
连接时间对泡桐MSAP连接体系的影响较大(图2).连接的好坏直接关系到后续的扩增结果,在连接时间分别为6,8,18 h条件下,随着连接时间的延长,预扩增产物量逐渐增加.为试验操作方便,本体系选择连接反应时间为18 h.
图2 不同时间连接DNA的琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of DNA products of different ligation time
2.3 泡桐MSAP预扩增体系的优化.
通过对预扩增反应的各因素优化发现,连接产物用量对预扩反应影响较大(图3).当用连接产物原液进行扩增时,条带拖带严重,如果用原液进行扩增,浓度太大,影响后续试验,同时影响结果的准确性,随着稀释倍数增大,条带逐渐变弱,当连接产物稀释用量超过50倍时,泳带亮度较弱,为保证后续试验的顺利进行,泡桐MSAP预扩增体系中连接产物稀释10倍为宜.dNTP用量对预扩增反应有较大的影响(图 4).当 dNTP 浓度为 25 μmol·L-1时,带型微弱,随着dNTP浓度增大,条带逐渐清晰,且扩增产物增多,当dNTP浓度为100 μmol·L-1时,预扩增产量较高,当 dNTP浓度大于100 μmol·L-1时,预扩增产物量减少,可能是因为dNTP与Taq酶竞争Mg2+,导致Taq酶活性下降,抑制PCR反应所致,在本试验设置的浓度范围内,选择100 μmol·L-1为预扩增体系中dNTP的适宜浓度.引物浓度对预扩增产物影响较大(图5).当引物浓度为 0.3 μmol·L-1时,预扩增产物量较少,随着引物浓度的增大,扩增带型逐渐清晰,并在引物浓度达到 1 μmol·L-1时,产物最多,但有出现二聚体的趋势,为节省引物用量,选择引物浓度为 0.5 μmol·L-1为该体系的最佳引物浓度.
Taq酶量优化试验结果(图6)说明,Taq酶量对预扩增反应影响最大.当Taq酶量为0.25 U时,扩增产物量较少,当Taq酶量为0.5~1 U时,扩增产物带型清晰,但当Taq酶量增加到2 U时,扩增产物明显增多,但同时拖带现象比较严重,泳带不清晰.因此,从节约考虑,选择0.5 U作为泡桐MSAP预扩增体系中的最佳Taq酶用量.
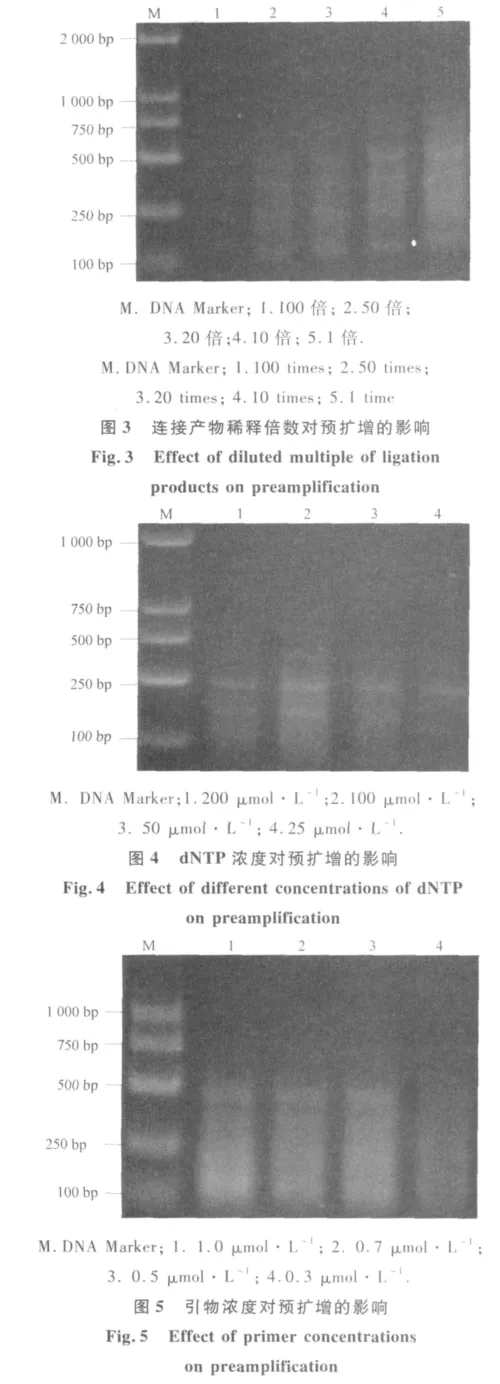
图6 Taq酶量对预扩增的影响Fig.6 Effect of Taq enzyme dosage on preamplification
2.4 泡桐MSAP选择性扩增反应体系的优化
从优化的选择性扩增体系得出,预扩增产物用量对选择性扩增影响较大(图7),300 ng DNA经酶切,连接和预扩后,预扩产物分别按1,20,30,80,150倍进行稀释,扩增产物在2% 琼脂糖凝胶上电泳检测发现,当用预扩增原液进行选择性扩增时,电泳结果主次分明的条带不明显,呈弥散状态,且拖带现象严重,随着稀释倍数的增大,泳道带型变化不大.为保证试验顺利进行,选择泡桐MSAP选扩增体系中预扩产物稀释30倍为宜.dNTP用量对于选择性扩增有较明显的影响(图8).当dNTP 浓度 25 μmol·L-1时,dNTP 含量太少,并且形成二聚体,出现非特异性扩增产物,

图7 连接产物稀释倍数对选择性扩增的影响Fig.7 Effect of diluted multiple of ligation products on selective amplification
当 dNTP 为 100 μmol·L-1时,选择性扩增产物较多,泳带较亮,当浓度增加为 200 μmol·L-1时,预扩增产物拖带现象严重,不利于试验的正常进行.因此,将泡桐MSAP选择性扩增体系中dNTP的浓度设定为100 μmol·L-1.引物浓度对选择性扩增反应有较大的影响(图9).当引物浓度为0.1 μmol·L-1时,扩增量较少,随着引物浓度得升高,扩增量随之增加,且带型逐渐清晰.因引物与模板比太高,易产生二聚体,因此,选取引物浓度为0.6 μmol·L-1.Taq酶量对于选择性扩增反应有较大的影响(图10).当Taq酶为0.25 U时,泡桐MSAP没有扩增产物量,当Taq酶为0.5~1 U时,带型最好,但当Taq酶增加到2 U时,扩增产物量迅速增加.但拖尾严重,由于酶用量过多会产生高的错配率,导致特异性降低.因此,选择0.5 U为泡桐MSAP选择性扩增体系中Taq酶的最适用量.

图8 dNTP浓度对选择性扩增的影响Fig.8 Effect of different concentrations of dNTP on selective amplification
2.5 泡桐MSAP选择性扩增引物的筛选
按以上优化出的选择性扩增体系,根据最终4% 聚丙烯酰胺凝胶上条带所反映的清晰度,数目及重复性情况,从64×64对引物组合筛选出96对引物,序列如表1所示.其中前18对引物的聚丙烯酰胺凝胶电泳结果如图11所示,筛选出的引物,电泳显示条带清晰,并且多态性丰富,可以用来进行 泡桐的DNA甲基化分析.

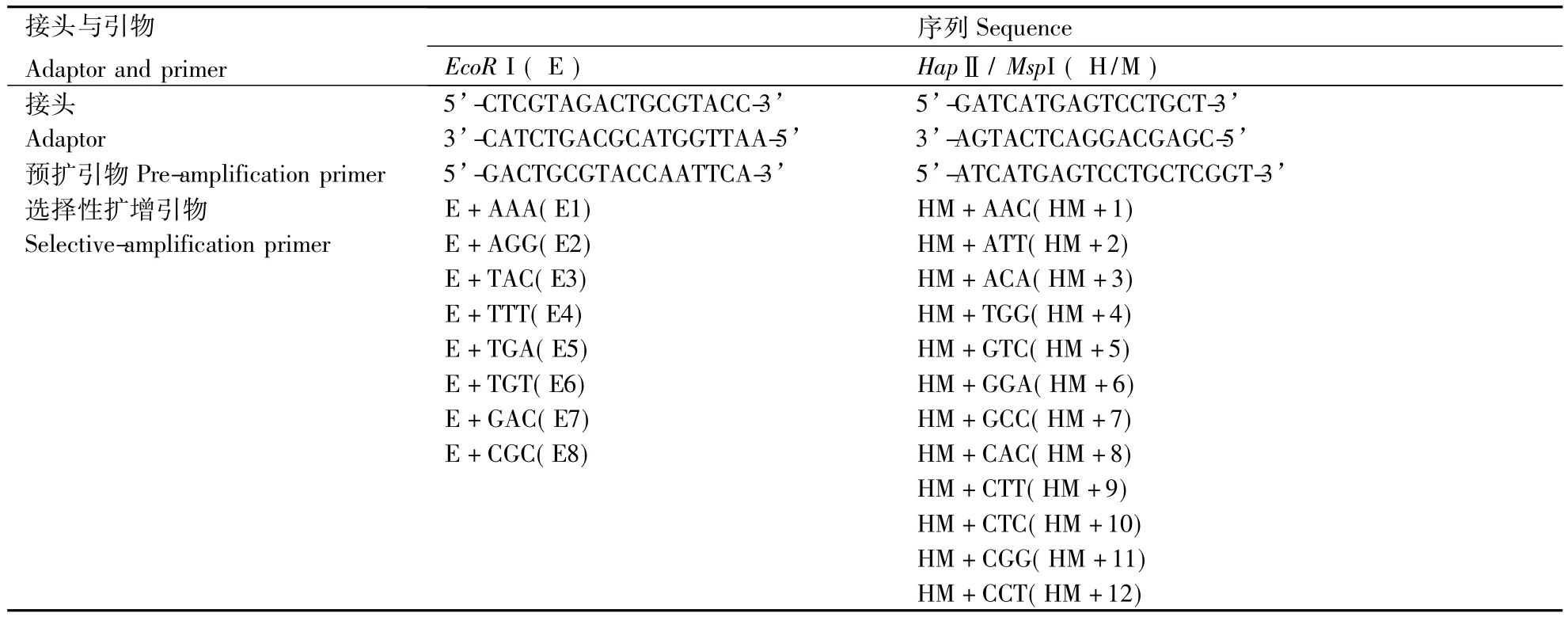
表1 泡桐MSAP选择性扩增引物Table 1 Primer for MSAP of the selective amplification
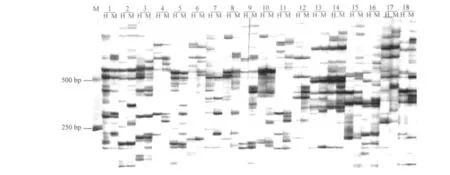
图11 18对引物的MSAP选择性扩增Fig.11 MSAP of selective amplification with 18 pairs of primers
3 结论与讨论
经过对MSAP各因素的优化,建立了适合泡桐分析的MSAP体系.25 μL酶切体系中,300 ng泡桐模板DNA经10 h双酶切效果最佳;经22℃连接18 h后,稀释10倍进行预扩增,为保证选择性扩增产物有足够的模板,预扩增产物稀释30倍进行选扩,在4% 聚丙烯酰胺凝胶上可以显示的多态性丰富、清晰度高、完整的带型.经引物筛选,从64×64对组合中筛选出适合泡桐分析的96对引物.
在优化体系的过程中发现,MSAP对DNA的质量要求比较高,提取的DNA在含有多糖、多酚和蛋白质的情况下,容易造成酶切失败,进而在聚丙烯酰胺胶上显示上端细小大片段带型较多,胶板上端背景加深,反之,高质量的DNA 300 ng即可获得效果较好的谱带.另外,不同组织器官提取的DNA选扩带型差异较大,这也体现在油菜种子萌发的研究中[13].酶切后的连接是整个试验最关键的一步,连接成功是预扩的前提,若连接时间过短,会造成人工接头与酶切片段不能完全接上,过长不仅对连接效率没有太大提高,还对仪器损害较大,因此应适当延长连接时间,以保证接头顺利连接;dNTP浓度对试验结果有较大的影响,dNTP加入量过多,因dNTP与Taq酶竞争 Mg2+,导致 Taq酶活性下降,抑制PCR反应,反之容易出现非特异性条带,DNA聚合酶浓度对MSAP的扩增带型较敏感,随着酶的浓度增大,条带拖尾,容易造成带型显示失真,特异性降低,酶浓度较小,扩增不出条带.电泳时温度的高低对结果影响也较大,若电泳温度太高,胶板中下部分的泳带发散,温度太低,条带发虚模糊不清,电泳时温度维持在45~55℃之间最佳.染色时间对试验结果的影响较大,时间过长则会使胶板背景加深而影响观察,否则条带微弱、发散.因此,染色10 min为宜.总之,MSAP技术影响因素较多,各因素相互协调复杂,本研究通过对各参数的优化,建立的MSAP体系可以满足后续泡桐DNA甲基化变化分析的要求.
[1] SAZE H,MITTELSTEN SCHEID O,PASZKOWSKI J.Maintenance of CpG methylation is essential for epigenetic inheritance during plant gametogenesis[J].Nat Genet,2003,34(1):65 -69.
[2] CHAN S W L,HENDERSON I R,JACOBSEN S E.Gardening the genome:DNA methylation Arabidopsis thaliana[J].Nat ReV Genet,2005(6):351 - 360.
[3] XIAO W,CUSTARD K D,BROWN R C,et al.DNA methylation is critical for Arabidopsis embryogenesis and seed viability[J].Plant Cell,2006,18(4):805 - 814.
[4] JULLIEN P E,KINOSHITA T,OHAD N,et al.Maintenance of DNA methylation during the Arabidopsis life cycle is essential for parental imprinting[J].Plant Cell,2006,18(6):1360 -1372.
[5] DAHL C,GULDBERG P.DNA methylation analysis techniques[J].Biogerontology,2003,4(4):233 - 250.
[6] 郭广平,顾小平,袁金玲,等.不同生理年龄毛竹DNA甲基化的MSAP 分析[J].遗传,2011,33(7):794-800.
[7] 李丽琴,付春华,赵春芳,等.红豆杉脱分化过程中的遗传和表观遗传变异[J].植物生理学通讯,2009,45(6):544-548.
[8] 洪 舟,施季森,郑仁华,等.杉木亲本自交系及其杂交种DNA甲基化和表观遗传变异[J].分子植物育种,2009,7(3):591-598.
[9] 魏华丽,吴 涛,杨文华,等.落叶松体细胞胚胎发生过程中DNA甲基化模式变化分析[J].东北林业大学学报,2011,39(2):33 -37.
[10] 李海林,吴春太,李维国.巴西橡胶树DNA甲基化的MSAP分析[J].分子植物育种,2011,9(1):69-73.
[11] 黎 明,翟晓巧,范国强,等.土霉素对豫杂一号泡桐丛枝病幼苗形态和DNA甲基化水平的影响[J].林业科学,2008,44(9):152 -156.
[12] 张延召,曹喜兵,翟晓巧,等.适用于AFLP分析的泡桐DNA提取方法研究[J].河南农业大学学报,2009,43(6):610-614.
[13] 陆光远,伍晓明,陈碧云,等.油菜种子萌发过程中DNA甲基化的MSAP分析[J].科学通报,2005,50(24):2750-2756.
