渗透胁迫下不同抗旱性小麦品种的幼苗叶片抗氧化特性差异
2012-07-14李冠甲王志强梁威威林同保
李冠甲,王志强,梁威威,林同保
(河南农业大学农学院,河南郑州450002)
由于受季风气候影响,中国小麦生长季节恰逢旱季,干旱已成为限制小麦产量进一步提升的主要非生物逆境之一.干旱对植物的伤害很大程度上是破坏生物膜的生理功能而引起的[1].正常条件下,植物体内的活性氧(ROS)及其清除体系之间存在动态平衡,植物体内存在的超氧化物保护酶(SOD)可使植物体内产生的超氧阴离子自由基(O—·2)歧化生成活性较弱的H2O2和O2,然后再由过氧化氢酶(CAT)、过氧化物酶(POD)等将H2O2还原为水,从而降低体内活性氧的积累,防御膜脂过氧化,维持体内正常的生理功能[2].干旱等多种逆境胁迫会打破植物体内的活性氧动态平衡,从而导致细胞内的O—·2,H2O2和·OH等活性氧自由基积累、膜脂过氧化作用加强[3]、生物膜受到伤害,最终降低作物产量.有关膜脂过氧化反应与保护酶(SOD,POD,CAT等)活性变化的研究已被广泛用于植物对逆境反应机理的研究[4],多年来都有报道[5~7].研究表明,植物的抗旱性与其抗氧化能力有关[8],干旱胁迫能引起植物体内SOD,CAT和POD活性的变化[9~11],在轻度干旱胁迫下,植物 SOD,CAT和POD活性升高,重度干旱胁迫下随胁迫时间延长呈先升高后下降趋势[9,10].抗氧化能力的高低可反应植物抗旱性的强弱[12],但不同植物、不同干旱程度,植物SOD,CAT和POD的响应也有所差别.目前,以不同抗旱性小麦品种为材料,研究其抗氧化保护系统的差异还鲜见报道,为此,研究采用聚乙二醇6000(PEG-6000)渗透胁迫处理,研究了不同抗旱性小麦品种幼苗叶片抗氧化特性差异,以期为小麦抗旱分子调控和品种改良提供理论依据.
1 材料与方法
1.1 试验材料
供试小麦品种为抗旱性强的品种洛旱7号和抗旱性弱的品种豫农202.选整齐一致的小麦种子用质量分数0.1%HgCl2消毒10 min,用蒸馏水冲洗干净,平铺于3层湿润滤纸上,放入25℃的黑暗培养箱中使其萌发,期间保持滤纸湿润.3 d后转入人工气候箱中培养,每天光照12 h,光照度为110 μmol·m-2·s-1,昼夜温度分别为 25 和 20℃.1 d后选取长势均匀的小麦幼苗移栽入盛有营养液的小桶内(直径20 cm,深17 cm),营养液(pH值6.8)的组成如下:2 mmol·L-1Ca(NO3)2,0.25 mmol·L-1KH2PO4,0.75 mmol·L-1K2SO4,0.65 mmol·L-1MgSO4,30 μmol·L-1FeCl3,2 μmol·L-1MnCl2,25 μmol·L-1H3BO3,0.5 μmol·L-1CuSO4,2 μmol·L-1ZnSO4和 0.1 μmol·L-1(NH4)6Mo7O24.
1.2 试验设计
在小麦幼苗转入营养液后第4天开始进行处理,试验设3个处理,分别为对照(CK)、低渗透胁迫(PEG质量浓度150 g·L-1,T1)和高渗透胁迫(PEG 质量浓度300 g·L-1,T2),处理5 d 后,选取生长一致的小麦幼苗进行相关指标的测定.重复3次.
1.3 测定项目及方法
1.3.1 生物量 取长势一致的小麦幼苗10棵,用滤纸吸干表面水分后,放入105℃烘箱中杀青15 min,再调至75℃烘至质量恒定,用1/1 000的电子天平直接称量,换算成每棵小麦幼苗的干质量.
1.3.2 酶液提取 取小麦叶片鲜样0.5 g,用预冷10 mL 0.05 mol·L-1磷酸缓冲液(pH 值 7.8,内含1 mmol·L-1EDTA、质量分数2%聚乙烯吡咯烷酮),冰浴研磨匀浆,取混合液3 mL在4℃,15 000 g下离心15 min上清液用于 SOD,POD,CAT的测定[13].
SOD活性的测定采用NBT光化还原法[14].
CAT 活性的测定[15]:反应混合液(0.1 mol·L-1pH 值 7.0 磷酸缓冲液、0.1 μmol·L-1EDTA,0.1%H2O2)3 mL,最后加入 0.2 mL 酶提取液,迅速倒入比色杯中,立即测定240 nm下吸光值变化,每隔1 min读数1次,共测定3 min.
POD 活性的测定[16]:反应混合液(0.1 mol·L-1pH 值 6.0 磷酸缓冲液、3 mmol·L-1愈创木酚、10 mmol·L-1H2O2)3 mL,最后加入 0.21 mL酶提取液,迅速倒入比色杯中,立即测定470 nm下吸光值变化,每隔1 min读数1次,共测定5 min.
1.3.3O—·2产生速率的测定[14]取小麦叶片鲜样 0.5 g,用预冷 3 mL 0.05 mol·L-1磷酸缓冲液(pH 值 7.8,内含 1 mmol·L-1EDTA、质量分数2%聚乙烯吡咯烷酮),冰浴研磨匀浆,混合液在4℃,10 000 g下离心10 min.取上清液0.5 mL加0.5 mL 0.05 mol·L-1磷酸缓冲液(pH 值7.8),再加入0.1 mL 10 mmol·L-1盐酸羟胺,在25 ℃下反应1 h后,再加入1 mL 17 mmol·L-1磺胺和1 mL 7 mmol·L-1α -萘胺,在25 ℃下反应20 min.测定530 nm的吸光值.用亚硝酸钠做标准曲线.
1.3.4 H2O2含量的测定[17]取小麦叶片鲜样0.5 g,用3 mL质量分数3%TCA冰浴研磨匀浆,于4℃,12 000 g下离心15 min,用1 mL上清液加入1 mL,0.1 mol·L-1磷酸钾缓冲液(pH 值7.0),再加2 mL 1 mol·L-1KI溶液,测定390 nm吸光值,根据标准曲线计算.
1.3.5 MDA含量的测定[18]取小麦叶片鲜样0.5 g,用 5 mL 0.05 mol·L-1磷酸缓冲液(pH 值7.8)冰浴研磨匀浆,10 000 g,4 ℃下离心 20 min,取1 mL上清液加入2 mL 0.6%TBA沸水浴中煮15 min,迅速冷却,4 000 r·min-1下离心 10 min,测定上清液600,532,450 nm的吸光值.
1.4 数据处理
试验数据采用Microsoft Excel 2003进行处理和制图,采用SPSS 13.0软件进行统计分析,多重比较采用LSD法(P=0.05).
2 结果与分析
2.1 渗透胁迫下不同抗旱性小麦品种幼苗生物量的变化
由图1可以看出,小麦幼苗生物量随胁迫程度逐渐降低,不同抗旱性品种之间存在差异.处理间相比,抗旱性强的洛旱7号降幅小于抗旱性弱的豫农202.在低渗透和高渗透胁迫下,豫农202的生物量分别比对照降低了24.3%和49.8%,洛旱7号分别比对照降低了18.7%和48.6%.
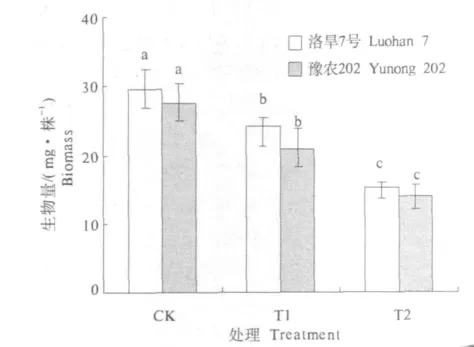
图1 渗透胁迫对不同抗旱性小麦品种幼苗生物量的影响Fig.1 Effect of osmotic stress on biomass of wheat seedlings with different drought resistant variety
2.2渗透胁迫下不同抗旱性小麦品种幼苗产生速率和H2O2含量的变化
由图2可以看出,渗透胁迫下,O—·2产生速率均有所增加.抗旱性强的洛旱7号在高渗透胁迫下比对照增加了54.34%,增加幅度显著;而低渗透胁迫下增幅不明显,为13.96%.抗旱性弱的豫农202在渗透胁迫下增幅显著,并随胁迫程度加大,增幅加大,在低渗透和高渗透胁迫下分别增加了30.85%和 73.57%.
小麦幼苗H2O2含量随渗透胁迫程度的加重而增加,但不同胁迫程度下增幅均不明显,豫农202和洛旱7号在低渗透胁迫下增幅分别为5.7%和2.76%;在高渗透胁迫下分别为 15.54%和14.52%.就不同品种之间来说,抗旱性弱的豫农202增加幅度大于抗旱性强的洛旱7号.
2.3 渗透胁迫下不同抗旱性小麦品种幼苗SOD,POD和CAT活性的变化
由图3可以看出,小麦叶片SOD活性均随渗透胁迫程度的加重而增加,不同品种增加幅度有所差异.方差分析表明,抗旱性弱的豫农202在低渗透胁迫下为对照的1.32倍,增加不显著;在高渗透胁迫下为1.91倍,增加显著;抗旱性强的洛旱7号在渗透胁迫下均显著增加,低渗透和高渗透胁迫下分别为对照的1.35和2.08倍.从不同品种看,抗旱性强的洛旱7号大于抗旱性弱的豫农202.
POD活性变化趋势与SOD变化一致(图3).抗旱性弱的豫农202在低渗透胁迫下是对照的1.07倍,增加不显著;在高渗透胁迫下是对照的2.03倍,增加显著.抗旱性强的洛旱7号在低渗透和高渗透胁迫下均显著增加,分别为对照的1.39和2.47 倍.
渗透胁迫下,小麦幼苗CAT活性均增加,但不同抗旱性品种增幅不同,抗旱性强的洛旱7号在不同渗透胁迫下均高于抗旱性弱的豫农202.抗旱性弱的豫农202在低渗透和高渗透胁迫下分别是对照的1.20和1.08倍,增加不显著.抗旱性强的洛旱7号在低渗透胁迫下增加显著,是对照的1.26倍,在高渗透胁迫下增加不明显.
2.4 渗透胁迫下不同抗旱性小麦品种幼苗丙二醛含量的变化
由图4可以看出,小麦幼苗MDA含量在渗透胁迫下呈增加趋势,增加显著.抗旱性强的洛旱7号在对照、低渗透和高渗透胁迫下MDA含量均高于抗旱性弱的豫农202,比其分别高20%,8%和5%.但渗透胁迫下洛旱7号增幅要小于豫农202,低渗透和高渗透胁迫下,前者分别是对照的1.47和1.82 倍,后者分别是1.63 和2.09 倍.
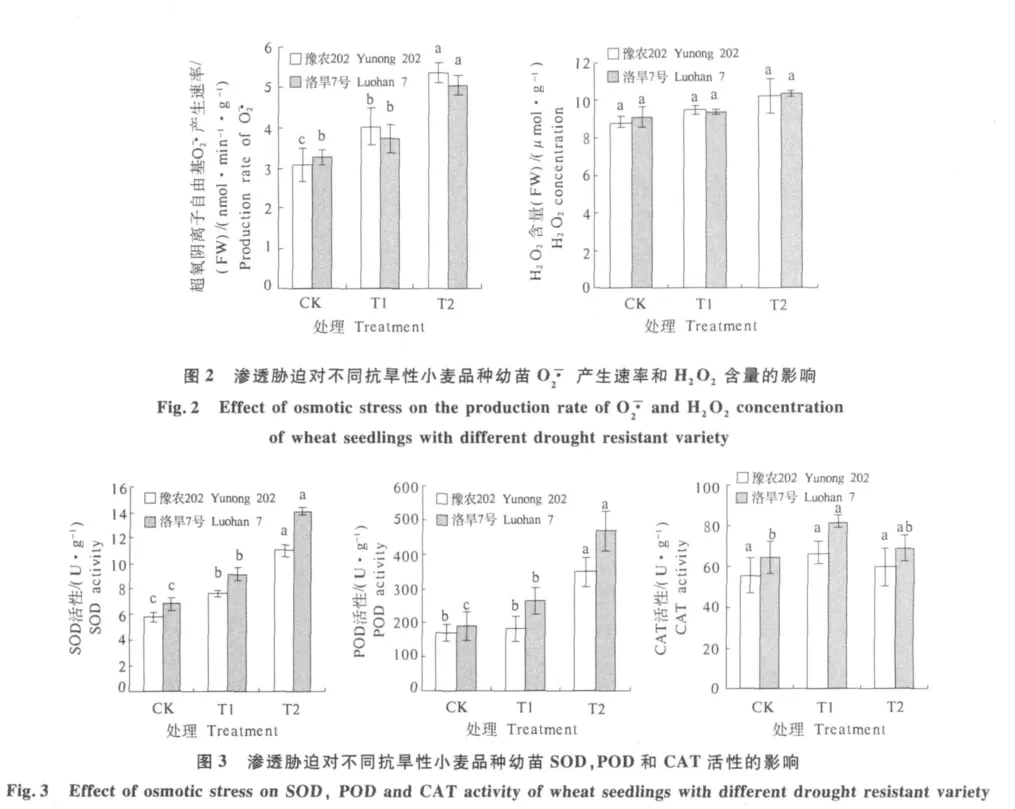

图4 渗透胁迫对不同抗旱性小麦品种幼苗MDA含量的影响Fig.4 Effect of osmotic stress on MDA concentration of wheat seedlings with different drought resistant variety
3 结论与讨论
渗透胁迫下小麦幼苗生物量明显降低,抗旱性弱的豫农202降幅高于抗旱性强的洛旱7号,尤其在高渗透胁迫下表现更为明显.超氧阴离子自由基产生速率在渗透胁迫下均有所增加,豫农202增幅高于洛旱7号.自由基伤害学说认为,植物在干旱等逆境因素下体内活性氧自由基大量积累,能启动自由基链式反应及其他类型的再氧化等产生羟基自由基、单线态氧和过氧化氢[19].这些活性氧能直接或间接的启动细胞膜脂质过氧化作用,膜脂过氧化作用可直接导致细胞膜结构和功能的破坏,进而影响到植物的生理生化代谢和其他生长过程.由此推测,渗透胁迫下活性氧自由基的大量积累是植物生长受抑制的原因之一,抗旱性强的品种表现为对其较高的适应性和强的清除能力.
丙二醛是膜脂过氧化作用的主要产物之一,其含量高低反映了活性氧代谢及对细胞膜破坏的程度[20~21].本试验显示,渗透胁迫下2种小麦品种幼苗的MDA含量、产生速率和H2O2含量均有所增加,表明了细胞内等活性氧自由基积累增加,细胞内活性氧积累和清除之间的平衡遭到了破坏,对细胞膜结构和功能的破坏作用增强;抗旱性弱的豫农202小麦品种幼苗MDA含量和O—·2的产生速率在渗透胁迫下增加幅度均比较明显,而抗旱性强的洛旱7号只有在重度干旱下增幅显著,H2O2含量虽然在渗透胁迫下增加不明显,但豫农202增幅大于洛旱7号,这表明和抗旱性弱的品种相比,抗旱性强的品种细胞内活性氧自由基积累少,细胞膜结构和功能受到破坏小,说明其体内有强的清除能力,应该和清除活性氧的酶类有关.
正常情况下,植物细胞内活性氧自由基的产生和消除处于动态平衡,不易产生膜脂过氧化[22].当植物处于各种逆境下活性氧积累过多,会使膜脂产生脱酯化作用,磷脂游离,膜结构遭破坏.SOD,CAT和POD是细胞内清除活性氧的主要酶类,对活性氧清除能力是决定细胞对胁迫抗性的关键因素,整个活性氧清除酶系统防御能力的变化取决于这几种酶彼此协调的综合结果[23,24].试验结果表明,2种小麦品种在不同程度的渗透胁迫下,此3种保护酶均有所提高,与前人研究结果一致[25~27].方差分析表明,2种小麦品种幼苗叶片SOD,POD和CAT活性,在低渗透胁迫下,抗旱性强的洛旱7号显著高于对照,而抗旱性弱的豫农202增加不明显,结合前面渗透胁迫下抗旱性强的品种活性氧自由基积累少,膜脂过氧化弱说明增强SOD,POD和CAT活性与提高小麦对渗透胁迫的抗性有关.高渗透胁迫下,CAT活性增加不显著,可能是由于活性氧的大量积累抑制了酶活性提高,而SOD和POD活性增加显著,加上此时H2O2含量增加亦不明显,说明其主要原因可能是重度干旱下H2O2的清除依赖于SOD和POD,但仍需进一步研究.
综上所述,抗旱品种可能由于在渗透胁迫下具有较高的抗氧化酶活性,从而提高抗逆性.由于抗氧化酶活性较低,抗旱性弱的品种活性氧积累较高,膜脂过氧化作用增强,从而使抗旱性降低,与刘晓忠等[28]在玉米上的结果一致.所以,提高SOD,POD和CAT活性能提高小麦抗旱性.
[1] 毛桂莲,许 兴.枸杞耐盐突变体的筛选及生理生化分析[J].西北植物学报,2005,25(2):275-280.
[2] MITTLER R.Oxidative stress,antioxidants and stress tolerance[J].Trends in Plant Science,2002,7(9):405-410.
[3] 张玉鑫,康恩祥,马凌之,等.NaCl胁迫对甜瓜幼苗叶片膜脂过氧化和渗透调节物质的影响[J].果树学报,2007,24(2):194-198.
[4] BLOWLER C,MONTAGU V.Superoxide dismutase and stress tolerance[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43:83-116.
[5] CAKMAK I,MARSCHNER H.Effect of zinc nutritional status on activities of superoxide radical and hydrogen peroxide scavenging enzymes in bean leaves[J].Plant and Soil,1993,156:127 -130.
[6] MEHLHORN H,WENZEL A.Manganese deficiency enhances ozone toxicity in bush beans(Phaseolus vulgaris L.CV.Saxa)[J].Journal of Plant Physiology,1996,148:155-159.
[7] 吴振球,吴岳轩.铜,锌对水稻幼苗生长及超氧物歧化酶的影响[J].植物生理学报,1990,16(2):139-146.
[8] 赵丽英,邓西平,山 仑.活性氧清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-415.
[9] 魏 炜,赵欣平,吕 辉,等.三种抗氧化酶在小麦抗干旱逆境中的作用初探[J].四川大学学报:自然科学版,2003,40(6):1173-1177.
[10] 柯世省,金则新.干旱胁迫对夏腊梅叶片脂质过氧化及抗氧化系统的影响[J].林业科学,2007,43(10):28-33.
[11] REDDY A R,CHAITANYA K V,VIVEKANANDAN M.Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants[J].Journal of Plant Physiology,2004,161(11):1189 -1202.
[12] 张中华,杨建平,陈圣栋,等.低温胁迫对韭菜膜透性及保护酶活性的影响[J].西北农业学报,2006,15(2):124-127.
[13] QIU Z B,LIU X,TIAN X J,et al.Effect of CO2laser pretreatment on drought stress resistance in wheat[J].Journal of Photochemistry and Photobiology B:Biology,2008,90:17-25.
[14] GIANNOPOLITIS C N,RIES S K.Superoxide dismutases:1.occurrence in higher plants[J].Plant Physiology,1977,59(2):309-314.
[15] CAKMAK I,MARSCHNER H.Magnesium deficiency and high light intensity on enhance activities of superoxide dismutase,peroxidase and glutathione reductase in bean leaves[J].Plant Physiology,1992,98:1222 -1227.
[16] ZHANG J X,KIRHARN M B.Drought stress-induced changes in activities of superoxide dismutase,catalase and peroxidase in wheat species[J].Plant Cell Physiology,1994,35(5)785 -791.
[17] SHI S Y,WANG G,WANG Y D,et al.Protective effect of nitric oxide against oxidative stress under ultraviolet-B radiation[J].Nitric Oxide,2005 13:1 -9.
[18] ZHANG Y H,JIA A J.Potassium nitrate application alleviates sodium chloride stress in winter wheat cultivars differing in salt tolerance[J].Journal of Plant Physiology,2008,165:1455 -1465.
[19] 李 明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,2002,22(4):503-507.
[20] 齐 曼·尤努斯,李秀霞,等.盐胁迫对大果沙枣膜脂过氧化和保护酶活性的影响[J].干旱区研究,2005,22(4):503-507.
[21] 袁 琳,克热木.NaCl胁迫对阿月浑子实生苗活性氧代谢与细胞膜稳定性的影响[J].植物生态学报,2005,29(6):985-991.
[22] 孙国荣,阎秀峰.盐胁迫对星星草幼苗保护酶系统的影响[J].草地学报,2001,9(1):34-38.
[23] 孙存华,李 杨,杜 伟.藜对干旱胁迫的生理生化反映[J].生态学报,2005,25(10):2556-2561.
[24] HERNANDEZ J A,JIMENEZ A,MULLINEAUX P,et al.Tolerance of pea(Pisum sativum L.)to long-term salt stress is associated with induction of antioxidant defenses[J].Plant Cell& Environment,2000,23:853 -862.
[25] 崔香环,李欢庆,郝福顺.水分胁迫下小麦幼苗的抗氧化机制分析[J].河南农业科学,2007(4):25-28.
[26] 任红旭,陈 雄.抗旱性不同的小麦幼苗在水分和盐胁迫下抗氧化酶和多胺的变化[J].植物生态学报,2001,25(6):709-715.
[27] 张 峰,杨颖丽,何文亮,等.水分胁迫及复水过程中小麦抗氧化酶的变化[J].西北植物学报,2004,24(2):205-209.
[28] 刘晓忠,李建坤,王志霞,等.涝渍逆境下玉米叶片超氧物歧化酶和过氧化氢酶活性与抗涝性的关系[J].华北农学报,1995,10(3):29-32.
