难治性颞叶癫痫海马星形胶质细胞中P-gp、p53表达与凋亡探讨
2012-07-05段宝奇高觉民
段宝奇,刘 忆,胡 静,高觉民
(江苏省中医院神经外科1、血液净化中心2,江苏 南京 210029)
难治性颞叶癫痫易引起早逝、外伤、精神病、认知障碍等严重后果[1],多需要手术切除海马,虽然诸多学者对海马神经元改变致耐药难治等进行广泛研究,但关于海马星形胶质细胞在其中的作用研究较少。本文通过免疫组化、免疫印迹法(Western blot)、原位末端标记(TUNEL)方法检测P-gp、p53和细胞凋亡在星形胶质细胞的表达,探讨其在难治性颞叶癫痫患者中的作用。
1 资料与方法
1.1 一般资料 17例难治性颞叶癫痫手术患者为2005年4月至2011年8月在我科手术的患者,其中男性7例,女性10例,年龄8~36岁,平均23.5岁,病程3~32年,平均10.5年。所有患者均正规服用抗癫痫药物治疗两年以上,仍不能控制发作,平均每个月发作>3次。术前患者均进行了长程视频脑电图检测棘波定位于颞叶;头部MR检查符合海马硬化诊断标准;癫痫血药浓度检测在有效浓度范围;均在皮层和深部电极监测下行前颞叶切除术。对照组为手术内减压治疗严重颅脑外伤3例和半球脑梗塞2例,均无癫痫发作史。所有患者均有患者或家属签署手术同意书。
1.2 标本 手术切除的每例脑组织标本均留取部分放入液氮保存备用,其余予4%多聚甲醛固定,常规石蜡包埋,切成6 μm厚的切片,备行免疫组化和凋亡检测。
1.3 主要试剂 P-糖蛋白抗体购自Santa Cruz公司;p53抗体、β-action和二抗购自武汉博士德公司;原位末端标记检测细胞凋亡(TUNEL)试剂盒由Roche公司提供;即用型快速免疫组化MaxVision试剂盒,二氨基联苯胺(DAB)显色试剂等购自福州迈新生物公司。
1.2 方法
1.2.1 免疫组化 采用即用型快速免疫组化MaxVision试剂盒。分别加入P-gp、p53一抗,37℃孵育1 h,磷酸盐缓冲液(PBS)冲洗2 min×3次,滴加MaxVision二抗,37℃或室温孵育10~15 min,PBS冲洗2 min×3次,DAB显色,苏木素复染。P-gp在胞膜和胞浆、p53在胞核染成黄色或棕色为阳性。在高倍显微镜下随机选取视野,计数100个细胞中的阳性细胞个数,重复5次,取其均值。
1.2.2 凋亡细胞检测 使用TUNEL试剂盒进行检测,按说明书操作,以细胞核染成紫褐色为阳性。在高倍显微镜下随机选取视野,计数100个细胞中的阳性细胞个数,重复5次,取其均值。
1.2.3 免疫印迹法 取出液氮保存的脑组织标本,在冰浴下用玻璃研磨器磨碎,加入细胞裂解液裂解细胞1 h;4℃下12 000 r/min离心20 min,取上清后采用Bradford比色法进行蛋白定量。取等量的蛋白样品,经10%聚丙烯酰胺凝胶电泳分离蛋白,并转运于硝酸纤维素膜上。用含5%脱脂奶粉的TBST室温封闭2 h,洗膜后分别与一抗P-gp(1:500)、p53(1:200)及β-抗体(1:6000)孵育4℃过夜,次日TBST洗脱5 min共3次,加HRP标记的二抗(1:400)孵育2 h。加入增强化学发光剂中反应数分钟,最后以高效显影胶片曝光并冲洗胶片。Labworks软件分析结果时以蛋白条带作为内参照。计算P-gp、p53蛋白条带及β白条带与内参照蛋白条带像素灰度的百分比值,作为蛋白表达的相对水平。
1.3 统计学方法 采用SPSS11.0软件进行统计学分析,所有的实验结果以均数±标准差(±s)表示,两组间的比较采用t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 P-gp免疫组化 对照组P-gp只在微血管内皮细胞膜表达,而实验组微血管内皮细胞和部分星形胶质细胞膜都有表达(图1)。

图1 P-gp免疫组化(×200)
2.2 p53免疫组化 对照组未见明显p53阳性细胞,实验组有14例可见p53阳性细胞,主要为星形胶质细胞,少部分神经元细胞(图2)。
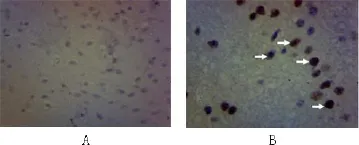
图2 p53免疫组化(×200)
2.3 TUNEL 对照组未见凋亡阳性细胞,实验组可见凋亡阳性细胞,主要为星形胶质细胞,少数神经元细胞(图3)。

图3 TUNEL(×200)
2.4 Western blot分析 P-gp和p53在癫痫患者中表达较对照组明显增高(图4、图5)。

图4 Western blot分析

图5 Western blot分析
2.5 统计学分析 显微计数显示实验组P-gp、p53免疫组化和凋亡阳性细胞较对照组明显增加;Western blot分析提示实验组P-gp、P53较对照组表达明显增加,结果见表1。
表1 两组免疫组化(p53、P-gp)、TUNEL、Western blot结果(±s)

表1 两组免疫组化(p53、P-gp)、TUNEL、Western blot结果(±s)
注:t检验,P<0.05。
组别对照组实验组17例数5 P-gp 0 13.84±7.73 P53 0 10.47±7.52 TUNEL 0 5.82±3.41 P-gp 0.72±0.14 1.43±0.42 P53 0.37±0.16 1.26±0.37 Western blot
3 讨论
颞叶癫痫多为难治性癫痫,即表现出对多种抗癫痫药物耐药,人们发现多药转运体与耐药相关,其中又以P-gp的作用为著。P-gp是多耐药基因编码的170 kD膜蛋白,在正常脑组织中主要在微血管内皮细胞表达,可阻止内源性和外源性物质进入中枢神经系统,成为血脑屏障作用的一部分,许多抗癫痫药物也是其作用底物而被排出细胞膜外。癫痫发作可以造成内皮细胞损伤,血脑屏障被破坏,进而构成第二道屏障的胶质细胞产生级联反应,也高表达P-gp。从本组实验我们发现:实验组免疫印迹法显示P-gp较对照组有更高的表达;而免疫组化显示除血管内皮细胞外有部分星形胶质细胞P-gp阳性,对照组未见阳性P-gp胶质细胞。胶质细胞P-gp高表达,可进一步限制抗癫痫药物作用于异常放电的神经元[2],促成癫痫耐药难治。
难治性颞叶癫痫多有海马神经元丢失、凋亡及胶质细胞反应性增生,本组实验我们也有相似发现。同时免疫组化和免疫印迹法发现实验组胶质细胞较对照组有明显的p53高表达,这与Engel等[3]、Xu等[3]报道结果一致。而TUNEL发现星形胶质细胞较神经元凋亡明显,这可能是由于:(1)脑组织中胶质细胞为神经元细胞的20~50倍,而硬化海马组织中神经元丢失较多,使神经元和胶质细胞比例进一步下降,导致实验组可见的神经元细胞数量减少。(2)癫痫患者的硬化海马组织中神经元细胞以坏死为主要方式,凋亡可能是次要原因[4]。(3)癫痫发作多伴有脑组织的缺氧,而在体条件下星形胶质细胞比神经元更易受损;且海马区星形胶质细胞比神经元更易发生凋亡;同时反应性星形胶质细胞化后,星形胶质细胞更容易发生死亡[5]。结合本组实验结果,我们认为调控细胞凋亡的p53在星形胶质细胞高表达,也支持星形胶质细胞较神经元细胞更易发生凋亡。
随着分子生物学的研究深入,人们在癫痫研究中发现P-gp、p53与凋亡之间有密切关系。如Morrison等[6]发现敲除p53的小鼠可以减少癫痫发作导致的细胞凋亡,并认为缺少p53在癫痫发作中有减少凋亡作用,p53参与了凋亡的调控。而Engel等[3]发现在颞叶癫痫患者海马组织内p53表达上升和凋亡表现,并认为癫痫后受损细胞可以通过p53途径诱导凋亡。研究发现p53也参与了P-gp的调控[7],如表达P-gp的MDR-1下游启动子有p53的结合位点,从而调节P-gp表达;p53还可以与转录调节因子ETS-1协同作用或者通过对核因子R33等多种细胞因子做出反应而增加P-gp的表达,虽然其中可能有p53变异的结果,但野生型p53也同样具有类似的作用。动物模型发现癫痫可以促使p53和P-gp的表达,同样癫痫患者中P-gp表达明显加强[2]。结合本组实验结果,我们认为由于癫痫的反复发作,脑组织胶质细胞受到应激、缺氧等损伤信号的作用,p53水平首先增加,从而提高P-gp的表达,以抵抗损伤的影响,但是P-gp的增加却导致了癫痫耐药;当损伤刺激反复并达到细胞难以修复时,则p53诱导细胞凋亡,而星形胶质细胞凋亡,则其对神经细胞的保护、营养修复作用减弱,这都导致了难治性癫痫的形成。
本实验把p53对P-gp和凋亡的作用联系起来,可能反映了以p53为调控通路的癫痫动态变化,同时我们发现以上变化发生在胶质细胞,所以胶质细胞在癫痫的作用及是否可以通过调控胶质细胞功能协同治疗癫痫值得深入研究。
[1] 练启辉.妥泰治疗难治性部分性癫痫临床研究[J].海南医学,2011,22(11):44-46.
[2] 许尚臣,庞 琦,董 勇,等.海马硬化致耐药性颞叶内侧癫痫的耐药基因蛋白表达及意义[J].立体定向和功能性神经外科杂志,2009,22(1):6-9.
[3] Engel T,Murphy BM,Schindler CK,et al.Elevated p53 and lower MDM2 expression in hippocampus from patients with intractable temporal lobe epilepsy[J].Epilepsy Research,2007,77:151-156.
[4] Xu S,Pang Q,Liu Y,et al.Neuronal apoptosis in the resected sclerotic hippocampus in patients with mesial temporal lobe epilepsy[J].Clin Neurosci,2007,14:835-840.
[5] 王 萍,王 伟,徐运兰,等.大鼠脑缺血再灌注后神经元和星形胶质细胞凋亡的比较研究[J].中国组织化学与细胞化学杂志,2006,16:113-118.
[6] Morrison RS,Agrawal ML,Kight K,et al.Relationship between expression of multiple drug resistance proteins and p53 tumor suppressor gene proteins in human brain astrocytes[J].Neurosci,2003,127:605-612.
[7] Damir Janigro.The cell cycle in the central nervous system[M].United States:Humana Press,2006:373-388.
