体外模拟脑缺血再灌注OGD/R模型的差异凝胶电泳分析
2012-06-20刘守跃胡林森罗毅男关文明
刘守跃,张 影,胡林森,宋 彬,罗毅男,关文明
(1.吉林大学第二医院神经外科,吉林 长春 130041;2.吉林大学第一医院儿科,吉林 长春 130021;3.吉林大学第一医院神经内科,吉林 长春 130021;4.吉林大学第一医院神经外科,吉林 长春 130021)
体外模拟脑缺血再灌注OGD/R模型的差异凝胶电泳分析
刘守跃1,张 影2,胡林森3,宋 彬1,罗毅男4,关文明1
(1.吉林大学第二医院神经外科,吉林 长春 130041;2.吉林大学第一医院儿科,吉林 长春 130021;3.吉林大学第一医院神经内科,吉林 长春 130021;4.吉林大学第一医院神经外科,吉林 长春 130021)
目的:通过体外模拟缺血-再灌注损伤(I/R)诱导细胞凋亡的氧糖剥离再灌注(OGD/R)模型的建立,应用蛋白质组学技术观察凋亡细胞蛋白质组的差异表达,进一步揭示神经元凋亡的发生机制。方法:选用人神经母细胞瘤系SH-SY5Y细胞分为对照组和实验组,实验组给予OGD10h/R24h处理建立OGD/R诱导SH-SY5Y细胞凋亡模型,提取对照组和实验组细胞总蛋白,利用荧光染色双向差异凝胶电泳技术(2D-DIGE)检测细胞蛋白质组的差异表达变化。结果:DeCyder软件分析2D-DIGE凝胶图像显示平均分离了(1 800±156)个蛋白质点;与对照组比较,实验组共有30个蛋白点的表达水平有显著变化(蛋白表达量上调或下调30%以上),其中22个升高,8个降低,与同时间对照组比较差异具有统计学意义(P<0.05或P<0.01)。结论:应用双向差异凝胶电泳的蛋白质组学技术在OGD/R模型中发现有差异蛋白的表达。
氧糖剥离/再灌注;蛋白质组学;二维荧光差异凝胶电泳
缺血-再灌注(I/R)引起的神经元迟发性死亡被证明主要是由各种因素诱导的细胞凋亡[1]。缺血-再灌注时多种直接或间接因素引起凋亡相关基因激活和凋亡相关蛋白表达,通过信号通路调控凋亡程序的开关,最终决定神经元的存亡[2-5]。为了深入研究缺血-再灌注诱导的神经元凋亡,很多模拟缺血-再灌注的动物和细胞模型被成功建立起来。利用这些模型的研究涉及凋亡相关的各种损伤因素,包括信号转导、基因表达及蛋白合成调节、修饰和亚细胞结构等,研究结果显示:凋亡的调控是一个整合多因素多环节的复杂网络系统,很多具体机制仍不清楚,特别是关于蛋白质表达变化、加工处理、修饰和相互作用等蛋白质组方面的信息还有很多空白。本实验在前期氧糖剥离再灌注(OGD/R)诱导SH-SY5Y细胞凋亡模型[6]的基础上,应用蛋白质组学的手段,即荧光染色双向差异凝胶电泳(2-dimentional difference gel electrophoresis,2DDIGE)、图像分析对该模型的差异表达蛋白质进行了研究,为进一步探寻脑缺血性疾病的相关靶蛋白提供基础。
1 材料与方法
1.1 细胞株、试剂及主要仪器
SH-SY5Y细胞购自中国医学科学院肿瘤研究所。高糖DMEM购自Gibco公司;优质胎牛血清购自杭州四季青公司;尿素、硫脲、三羟甲基氨基甲烷(Tris)、3-[(3-胆酰胺丙基)-乙二胺]-1-丙磺酸(CHAPS)、二硫苏糖醇(DTT)、两性电解质(pH3~10)、固相 pH 梯 度 (immobilized pH gradient,IPG)干胶条(pH3~10,13cm)、覆盖油、IPG缓冲液、甘油、十二烷基磺酸钠(SDS)、碘乙酰胺(IAA)、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵(APS)、四甲基乙二胺(TEMED)、甘氨酸、琼脂糖、蛋白酶抑制剂、核酸酶、胰蛋白酶、三氟乙酸(TFA)、乙腈(ACN)、α-氰基-4-羟基肉桂酸(4-HCCA)及相对分子质量marker、PhastGel Blue、CyDye荧光标记物(Cy2,Cy3,Cy5)、二甲基甲酰胺(DMF)、赖氨酸、IPG干胶条(pH3-10,24cm)、Clean-up试剂盒及2DQuant定量试剂盒等均购自Amersham Biosciences-GE Healthcare公司。hACTH(19-39)和AngⅢ购自Sigma公司。异丁醇、溴酚蓝、甲醇、冰醋酸和三氯乙酸(TCA)等购自北京北化精细化学品有限责任公司。CO2培养箱(Heraeus和SANYO);Ultrospec 3300Pro分光光度计、Ettan IPGphorⅡ等电聚焦仪、Ettan DALT Six电泳系统、Typhoon 9400系列多功能激光扫描系统、DeCyder差异分析软件为Amersham Biosciences-GE Healthcare公司产品、凝胶图像扫描仪、ImageMaster 2DEvolution软件、Ettan切胶仪、Ettan酶切仪、Ettan点靶仪和基质辅助激光解吸/电离飞行时间质谱(MALDITOF MS) 均 为 Amersham Biosciences-GE Healthcare公司产品。
1.2 细胞培养及模型建立
参照文献[6]进行 SH-SY5Y 细胞培养及OGD/R模型建立,细胞接种的浓度为2×105mL-1。
1.3 采用2D-DIGE检测差异蛋白
1.3.1 样品的制备 随机选取4批不同代数的细胞,设为对照组C1~4和实验组T1~4。将细胞接种于底面积35cm2培养瓶中,培养24h后,实验组给予OGD,对照组给予高糖无血清培养基置于37℃、5%CO2孵箱,10h后均更换为含10%胎牛血清的高糖DMEM完全培养基,置于37℃、5%CO2孵箱中继续培养。24h后倾去培养基,加5mL冷PBS,细胞刮棒刮取对照组和实验组细胞,移至2个玻璃离心管中,500g、4℃离心6min,弃上清,冷PBS洗涤2~3次,每次5min,将沉淀转移至1.5mL Eppendorf管中,500g、4℃离心5min。向沉淀中加入细胞裂解储液(按细胞湿重体积比1∶5~8计算)、1%体积蛋白酶抑制剂、1%体积核酸酶,充分混匀后4℃超声(调至50%)20次,室温静置1h以上,25 000g、4℃离心30min,上清转移至新的Eppendorf管。应用Clean-up试剂盒去除样品杂质,取5μL样品用2D Quant定量试剂盒于分光光度计下进行蛋白质定量(浓度在3~5g·L-1为宜),剩余样品-70℃冻存备用。
1.3.2 荧光标记 用50mmol·L-1NaOH 溶液将各样品的pH 值调至8.5~9.0,从 T1~4、C1~4各取50μg,分别以1μL(400pmol)CyDye荧光染料Cy3、Cy5进行相应标记;再取各组样品25μg混合制成内标,用4μL(1 600pmol)Cy2标记,冰上避光孵育30min。如表1进行分组。加入1μL 10mmol·L-1赖氨酸溶液冰浴避光10min终止反应。

表1 样品分组与荧光标记Tab.1 Samples grouping and FL labeling
1.3.3 双向电泳 1向等电聚焦:如表1所示,分别将Gel1~4标记好的3种荧光样品混合在一起,加入水化液至各胶上样液总体积为450μL。将上样液均匀加入对应的IPG胶槽中,胶面朝下放入24cm IPG干胶条,使之完全浸润,吸取1.4mL覆盖油覆盖胶条,置于Ettan IPGphorⅡ等电聚焦电泳仪上,进行水化与等电聚焦。等电聚焦结束之后,IPG胶条可-70℃冻存备用或继续进行垂直电泳。2向垂直电泳清洗、安装24cm垂直电泳灌胶模具,每块胶60mL灌胶液,另加80mL填充液,聚合1h以上 (可室温过夜),查看凝胶上沿出现水化层时为聚合凝固良好。此时将IPG胶条在平衡液Ⅰ、Ⅱ中各平衡15min。然后将胶条转移至12.5%的 SDS-PAGE 凝胶 (24cm×20cm×1.0cm)上端与之紧贴,用加热融化的0.5%琼脂糖封胶。安装好循环水管接口及电泳槽,在Ettan DALT Six电泳系统中以40mA恒流电泳转移60min,然后换用8W (2W/胶)恒功率电泳6h,直至溴酚蓝前缘到达PAGE胶的底端。
1.3.4 凝胶图像扫描 使用Typhoon 9400扫描仪在荧光模式下先以1 000μm的精度粗扫描,在激发波长520、580、670nm及对应的光电倍增管(PMT)电压值800、500、480V左右的条件下分别收集Cy2、Cy3和Cy5标记的荧光图像,按粗扫结果调节软件中的PMT电压值,使ImageQuant中的各图像MaxValue值介于60 000~90 000,最后以100μm精度进行精扫描,再次查看MaxValue值,若在上述范围内将图像剪切存盘,若超出,则调整PMT重新扫描至结果符合为止。共得到12幅双向电泳图像。
1.4 统计学分析
采用DeCyder 5.0版本软件分析,应用BAV模式进行胶间匹配,定义本次实验的差异表达蛋白标准:蛋白表达量上调或下调30%以上,同时P<0.05或P<0.01。差异蛋白质点组间比较采用显著性Student-t检验和单因素方差分析。
2 结 果
对照组和OGD/R组蛋白质表达差异分析:对8组荧光标记蛋白样品进行2D-DIGE分离,用DeCyder软件分析后显示,4块凝胶平均分离了(1 800±156)个蛋白点,蛋白点匹配率约为80%。BVA软件处理后共得到对照组和实验组30个差异表达蛋白 (蛋白表达量上调或下调30%以上),其中有22个点表达水平上调,8个表达水平下降,与同时间对照组比较差异有统计学意义(P<0.05或P<0.01)。差异表达蛋白点胶图中的编号、胶中出现的频数、t检验P值、实验组与对照组表达水平的比率见表2。图1和2分别是对照组 (Cy3标记)细胞和OGD10h/R组 (Cy5标记)细胞的蛋白电泳胶图。图3(封二)是对照组(Cy3标记)、OGD10h/R组 (Cy5标记)、内标组(Cy2标记)及3组蛋白重叠的二维荧光胶图。图4从整体到局部放大详细标记出了DeCyder软件检测到的差异表达蛋白质点胶图中的位置、编号、表达丰度的变化。
3 讨 论
前期实验[6]通过检测对照组和 OGD/R组SH-SY5Y细胞活力、形态学变化、细胞氧化应激相关酶及代谢物、流式细胞术多项指标证实了OGD10h/R模型成功诱导了SH-SY5Y细胞的凋亡,并认为再灌注24h细胞凋亡明显,比例高,适合进一步进行凋亡发生机制的相关研究。本研究在前期实验的基础上应用2D-DIGE蛋白质组学方法对凋亡相关蛋白质组的变化进行了初步探索。二维荧光差异凝胶电泳技术是由Unlu等[7]发明。实验时不同样品蛋白分别用荧光染料Cy3、Cy5和内标Cy2标记,内标是所有样品的等比例混合体[8],以不同的激发波长扫描胶图,得到样品中蛋白点的相对丰度值。DIGE和传统的二维凝胶电泳(2-DE)相比具有很多的优点:①内标Cy2使样品信号的比较具备统一的基准,进而最大限度缩小了胶间差异;②荧光素相对分子质量和电荷相匹配,且与蛋白的比率低,使不同样品同时电泳时蛋白点定量和配对更容易;③蛋白点能够检测到pg量级,灵敏度更高,线性更宽,统计学更可靠;④可显著提高样品电泳通量,减少操作时间和工作量;⑤DIGE与质谱兼容[8-9]。因此,DIGE是目前差异蛋白质组研究中可信度和精确度最高的方法之一[10-12]。
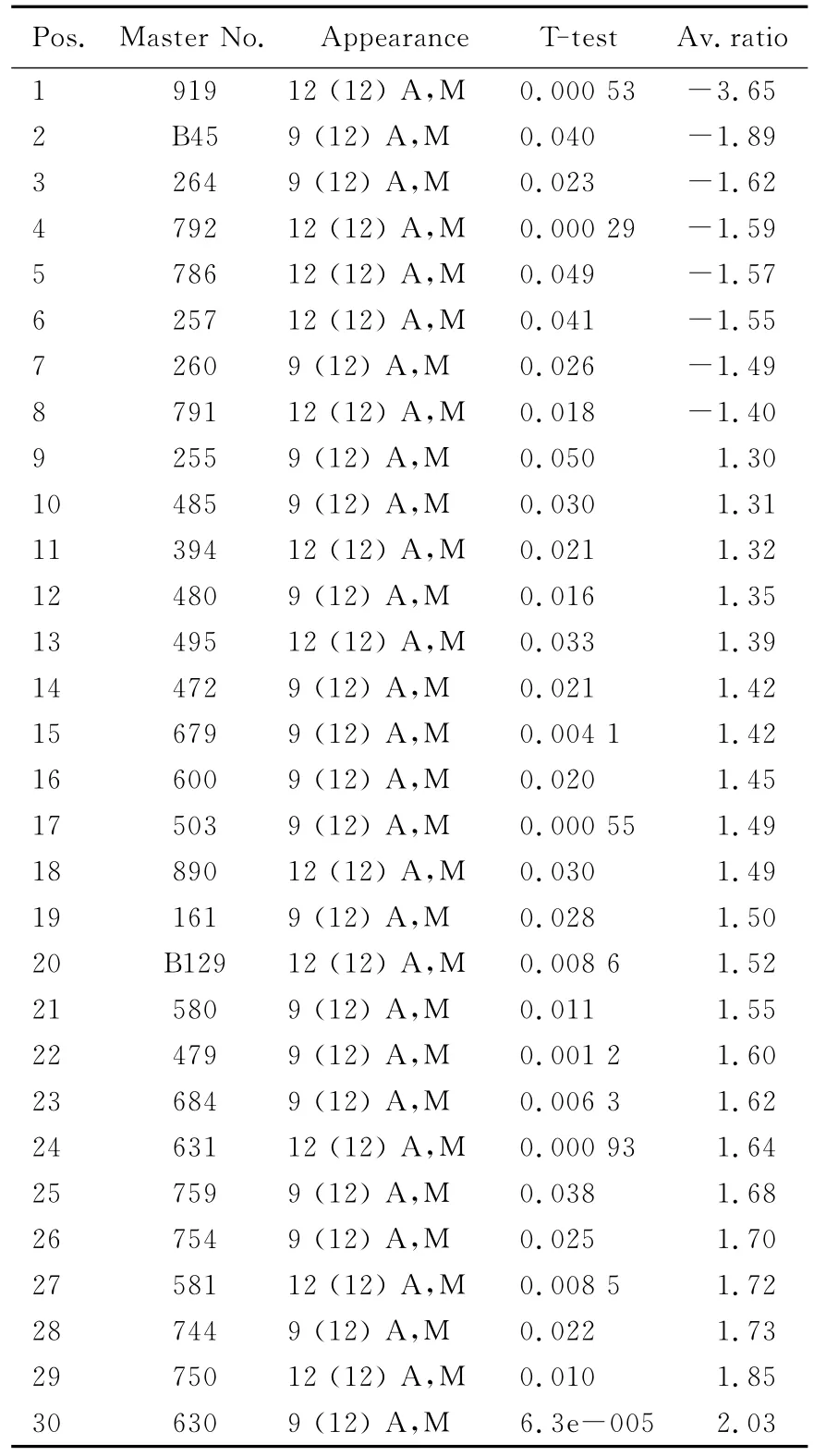
表2 对照组及OGD10h/R组差异表达蛋白统计分析Tab.2 Statistical analysis of differential proteins between control and OGD10h/R groups

图1 Cy3标记的对照组SH-SY5Y细胞的蛋白电泳胶图Fig.1 2-DE of Cy3-labeled proteome extracted from SHSY5Ycells in control groups
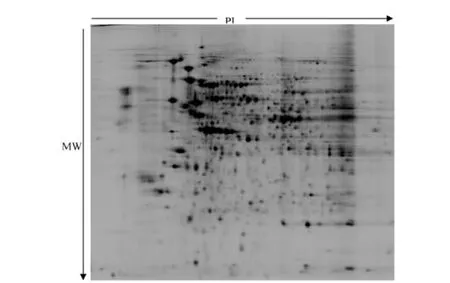
图2 Cy5标记的OGD10h/R组SH-SY5Y细胞的蛋白电泳胶图Fig.2 2-DE of Cy5-labeled proteome extracted from SHSY5Ycells in OGD10h/R groups
本实验研究了OGD10h/R诱导SH-SY5Y细胞凋亡模型的差异表达蛋白,结果显示:共发现30个有统计学意义的差异表达蛋白,其中22个点表达水平升高,8个点表达水平降低,其是否在缺血再灌注损伤中发挥重要作用还有待于进一步研究证实。OGD/R组与对照组差异表达蛋白质的分析结果说明了细胞内很多蛋白成分在缺血再灌注的病理生理过程中发生了改变,而这些变化的蛋白可能参与了神经细胞对缺血再灌注损伤的耐受与抵抗。通过对这些差异表达蛋白的进一步分析鉴定,可以发现与病理生理改变密切相关的特异性蛋白,本研究结果为探索缺血再灌注损伤引起神经元凋亡的机制提供新的线索,同时也可能作为神经细胞缺血再灌注损伤的分子标记,为治疗及药物开发提供新的靶点。
到目前为止,本实验尚不能确定上述差异表达蛋白的种类,因此无法深入分析这些差异表达蛋白在神经元缺血再灌注损伤过程中的功能,以及相互作用关系,只有对这些发生变化的蛋白进行鉴定后才可能对其机制做出进一步合理解释。因此后续工作主要集中于应用基质辅助激光解吸电离飞行时间质谱 (MALDI-TOF MS)鉴定差异表达蛋白,并通过生物信息学方法分析上述蛋白在缺血再灌注后 神经细胞凋亡过程的作用及其相互关联性。

图4 Decyder软件检测的差异表达蛋白质点整体及局部放大胶图Fig.4 Overview and zoom of differential proteins detected by Decyder software
[1]Liu CW,Millen L,Roman TB,et al.Conformational remodeling of proteasomal substrates by PA700,the 19S regulatory comp lex of the 26Sproteasome[J].Biol Chem,2002,277 (30):26815-26820.
[2]Dixon EP,Stephenson DT,Clemens JA,et al.Bcl-Xshort is elevated following severe global ischemia in rat brains[J].Brain Res,1997,776 (1/2):222-229.
[3]Röth E, Marczin N,Balatonyi B,et al.Effect of a glutathione S-transferase inhibitor on oxidative stress and ischemia reperfusion induced apoptotic signalling of cultured cardiomyocytes[J].Exp Clin Cardiol,2011,16(3):92-96.
[4]Alves MG, Machado NG,Sardaão VA,et al.Antiapoptotic protection afforded by cardioplegic celsior and histidine buffer solutions to hearts subjected to ischemia and ischemia/reperfusion [J].Cell Biochem,2011,112 (12):3872-3881.
[5]Kim HW,Cho KJ,Lee SK,at al.Apoptosis signalregulating kinase 1(Ask1)targeted small interfering RNA on ischemic neuronal cell death [J].Brain Res,2011,1412 (1):73-78.
[6]刘守跃,张 影,关文明,等.体外诱导SH-SY5Y细胞凋亡的氧糖剥离再灌注模型的建立及评价 [J].吉林大学学报:医学版,2012,38 (4):658-664.
[7]Unlu M, Morgan ME, Minden J. Difference gel electrophoresis:a single gel method for detecting changes in protein extracts[J].Electrophoresis,1997,18:2071-2077.
[8]Freeman WM,Hemby SE.Proteomics for protein expression profiling in neuroscience [J]. Neurochem Res,2004,29 (6):1065-1081.
[9]Saraswathy S,Rao NA.Posttranslational modification of differentially expressed mitochondrial proteins in the retina during early experimental autoimmune uveitis[J].Mol Vis,2011,17:1814-1821.
[10]Hu Y,Wang G,Chen GYJ,et al.Proteome analysis of saccharomyces cerevisiae under metal stress by twodimensional differential gel electrophoresis [J].Electrophoresis,2003,24 (9):1458-1470.
[11]Swatton JE,Prabakaran S, Karp NA,et al.Protein profiling of human postmortem brain using 2-dimensional fluorescence difference gel electrophoresis (2D-DIGE)[J].Mol Psychiatry,2004,9 (2):128-143.
[12]Hayashi T,Nakamichi M,Naitou H,et al.Proteomic analysis of growth phase-dependent expression of Legionella pneumophila proteins which involves regulation of bacterial virulence traits[J].PLoS One,2010,5 (7):e11718.
Difference gel electrophoretic analysis of OGD/R modelinvitroto mimic ischemia and reperfusion
LIU Shou-yue1,ZHANG Ying2,HU Lin-sen3,SONG Bin1,LUO Yi-nan4,GUANG Wen-ming1
(1.Department of Neurosurgery,Second Hospital,Jilin University,Changchun 130041,China;2.Department of Pediatrics,First Hospital,Jilin University,Changchun 130021,China;3.Department of Neurology,First Hospital,Jilin University,Changchun 130021,China;4.Department of Neurosurgery,First Hospital,Jilin University,Changchun 130021,China)
Objective To build oxygen glucose deprivation/reperfusion(OGD/R)modelinvitroto mimic ischemia and reperfusion inducing apoptosis of SH-SY5Ycells,to detect differential proteins by employing proteomics technique and to reveal the potential mechanisms of neuronal apoptosis.Methods SH-SY5Ycells were employed and divided into control group and experimental group in which the cells treated with OGD10h/R24hto set up apoptosis model.After the proteins were extracted from SH-SY5Ycells in control and OGD10h/R24hgroups,2DDIGE techniques was used to detect differential proteins.Results By DeCyder software mean(1 800±156)protein spots were displayed on 2D-DIGE image.In OGD10h/R24hgroup,30protein spots were detected to differentially express compared with control group,of which 22spots were up-regulated and 8spots were downregulated.Compared with control groups at the same time,the differences were significant(P<0.05orP<0.01).Conclusion By employing 2D-DIGE proteomics techniques to analyse OGD/R model,the protein spots are detected to differentially express.
oxygen glucose deprivation/reperfusion;proteomics;2-dimentional difference gel electrophoresis
Q51;R743.31
A
1671-587Ⅹ(2012)05-0861-05
2012-05-03
吉林省科技厅科研基金资助课题 (200905151)
刘守跃 (1971-),男,吉林省长春市人,主治医师,医学博士,主要从事脑血管病基础与临床研究。
关文明 (Tel:0431-88796286,E-mail:lsy2007.2008@yahoo.com.cn)
