云南烟蚜抗药性机制研究
2012-06-09宋春满邓建华
宋春满,邓建华
(云南省烟草农业科学研究院,云南玉溪 653100)
烟蚜Myzus persicae是我国烤烟大田生产期的主要害虫之一,不仅直接为害烟草叶片,降低烟叶品质,而且传播多种病毒病。目前烟蚜已对多种农药产生了抗性,原有化学农药防治效果显著降低。农药使用量的加大,不仅增加了防治成本,而且加剧了环境污染。进行抗性监测及抗性机理的研究,是科学制定抗性治理策略的前提。英国在上世纪70年代初就报道了桃蚜的抗药性,其抗性机制也被相继揭示 (Field et al.,1988,1996,1999,2002;Martinez-Torres et al.,1999;Guillemaud1 et al.,2003;Anstead et al.,2005;Srigiriraju et al.,2010),并且发展了相应的生物化学与分子生物学诊断技术,如利用RPLP-PCR诊断桃蚜的击倒抗性和乙酰胆碱酯酶变构,利用等位基因差异定量PCR技术进行桃蚜击倒抗性的高通量检测等 (Field et al.,1997;Anstead et al.,2004;Cassanellietal.,2005;Crinitietal.,2008)。而国内对烟蚜抗药性的研究相对较少 (吴兴富等,2004;宋春满等,2006;顾春波等,2005,2007;刘筱兵等,2008),至于寄生于烟草的烟蚜,其抗药性机制国内还少见报道。本文初步研究了云南烟蚜抗药性的生化与分子机制,以期为抗性监测与抗性治理提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 试剂
毒扁豆碱、碘化硫代乙酰胆碱 (ATCh)、二硫双硝基苯甲酸 (DTNB)为Fluka产品;固兰B盐、十二烷基硫酸钠 (SDS)、α-乙酸萘酯 (α-NA)、β-乙酸萘酯 (β-NA)为上海生工产品。
酯酶扩增检测引物:E1 5'-GGGAATTTTGGATTCT-3',E2 5'-GGCGGACCTGACGACTC -3',E3 5'- TGGTTGGGATCTAGGG -3'。
钠离子通道突变检测引物:CH1 5'-ATCTGGCATAAGTCTAAGAG -3',CH2 5'- GTCATGGGTATGCAG TTATTTG -3',CH3 5'- CTACTGTTGTCATTGGTAACC -3',CH4 5'- ATAGTACTTATACATACCACGAA-3'。引物均由大连宝生物工程有限公司合成。
1.1.2 供试烟蚜
烟蚜相对敏感品系、烟蚜抗氧化乐果品系(抗性倍数112.9)、烟蚜抗灭多威品系 (抗性倍数44.7)、烟蚜抗高效氟氯氰菊酯品系 (抗性倍数26.3),4个烟蚜品系均由云南省烟草农业科学研究院自行筛选获得,以K326烟叶隔离饲养于人工气候箱内,温度25℃,光照14L∶10D。
1.2 实验方法
1.2.1 酶液制备
挑选室内饲养的个体大小一致的无翅成蚜,每 20头加 1 mL预冷的磷酸缓冲液 (pH8.0,0.02 mol/L),直接于1.5 mL离心管中低温研磨,12000 r/m离心15 min,上清液即为酶液。
1.2.2 解毒酶与靶标酶活力比较
分别以α-乙酸萘酯 (α-NA)、β-乙酸萘酯 (β-NA)为底物,比较抗性品系烟蚜和敏感品系烟蚜的羧酸酯酶 (CarE)活力。羧酸酯酶活力测定:2.5 mL磷酸缓冲液 (0.02 mol/L,pH8.0),加1 mL α -NA 或 β -NA(3×10-4mol/L,含10-5mol/L毒扁豆碱)、50 μL酶液,于37℃保温30 min后加0.5 mL显色剂 (1%固蓝B与5%SDS以 2∶5配制),稳定 10 min后测定 A600或A555。
比较抗性品系烟蚜和敏感品系烟蚜的乙酰胆碱酯酶 (AChE)活力。乙酰胆碱酯酶活力测定:2.6 mL磷酸缓冲液 (0.02 mol/L,pH8.0),加200 μL 酶液、50 μL ATCh(75 mmol/L),于 30℃保温15 min后加入100 μL DTNB(10 mmol/L),再加毒扁豆碱100 μL(1 mmol/L)终止反应,测定A412。
1.2.3 抗性的分子检测
(1)烟蚜DNA提取:按杨子祥 (2006)等方法进行。
(2)烟蚜酯酶基因扩增检测
反应体系:Taq酶 1U;10×Buffer 2 μL;MgCl22 μL;dNTP 2 μL;E1 1.5 μL;E2 1.5 μL;E3 1.5 μL;DNA 1.5 μL;ddH2O 9.3 μL。
反应程序:94℃ 3 min;94℃ 1 min,52℃1 min,72℃ 2 min,35cycles;72℃ 10 min。
反应结束后将PCR产物在0.8%琼脂糖凝胶上电泳检测。
(3)烟蚜钠离子通道突变检测
反应体系:Taq酶 1U;10×Buffer 2 μL;MgCl22 μL;dNTP 2 μL;CH1 1.5 μL;CH2 1.5 μL;CH3 1.5 μL;CH4 1.5 μL;DNA 1.5 μL;ddH2O 6.3 μL。
反应程序:94℃ 2 min;94℃ 30 s,57℃ 45 s,72℃ 30 s,35 cycles;72℃ 8 min。
反应结束后将PCR产物在0.8%琼脂糖凝胶上电泳检测。
2 结果与分析
2.1 烟蚜解毒酶与靶标酶活力比较
分别以α-NA、β-NA为底物比较了烟蚜抗性品系和敏感品系的羧酸酯酶活力,结果如表1,由表1可知,烟蚜敏感品系与抗性品系之间,α-NA羧酸酯酶活力差异显著,其中以抗氧化乐果品系活力最高,抗灭多威品系次之,抗高效氟氯氰菊酯品系较低。β-NA羧酸酯酶活力在抗性品系与敏感品系之间差异不显著。由此可见,α-NA羧酸酯酶活力增强是烟蚜对有机磷类杀虫剂氧化乐果、氨基甲酸酯类杀虫剂灭多威以及菊酯类杀虫剂高效氟氯氰菊酯的抗性机制之一。
烟蚜敏感品系与抗性品系的乙酰胆碱酯酶(AChE)活力表明,烟蚜抗氧化乐果品系的AChE活力与敏感品系差异显著,但增幅较小,抗灭多威品系的AChE活力与敏感品系差异不显著。由此可知,AChE在烟蚜对氧化乐果的抗性中起着重要作用,但不排除还有AChE敏感性降低的因素。
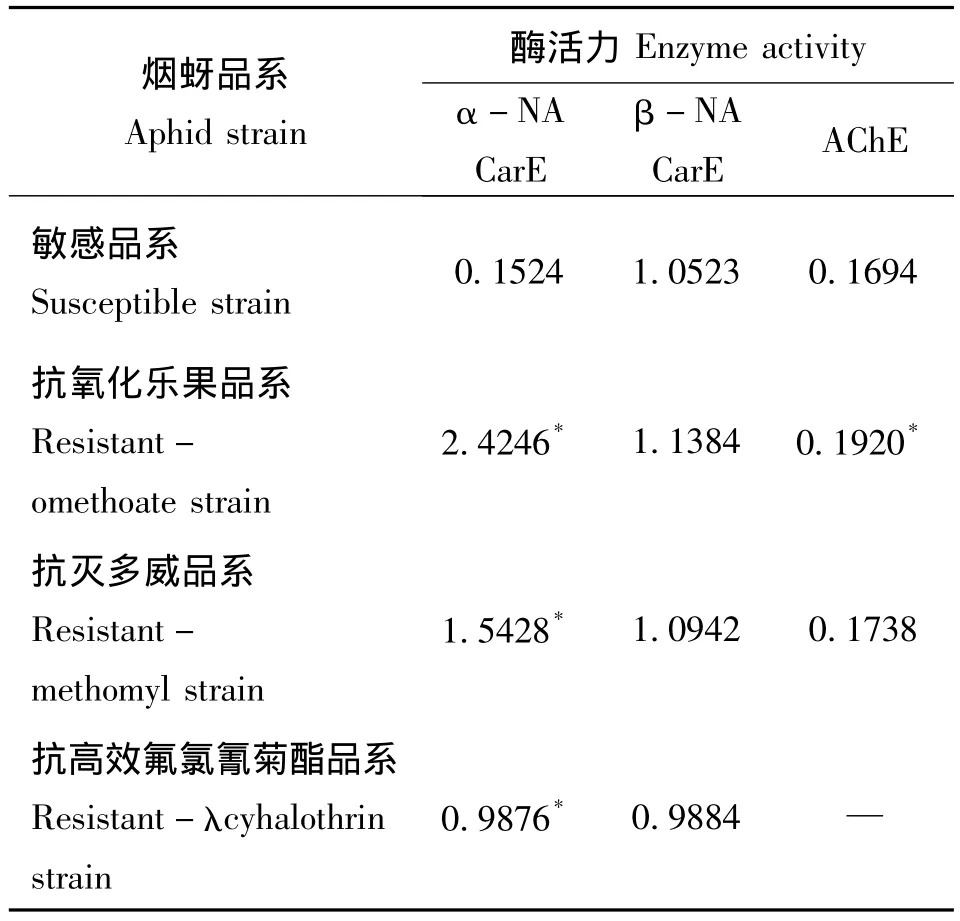
表1 烟蚜抗性品系与敏感品系酶活力比较Table 1 Difference of enzyme activity among susceptible strain and resistant strain
2.2 酯酶扩增检测
酯酶基因扩增PCR产物电泳图谱如图1,根据报道 (Field1 et al.,1999,2002),如果烟蚜酯酶基因发生了扩增,即基因拷贝数增加,所设计的引物预计扩增的电泳条带应为572 bp或865 bp强带,如果酯酶基因没有发生扩增,则PCR扩增产生572 bp和865 bp两条弱带,据此可以判断,3个抗性品系烟蚜均没有发生酯酶基因扩增。一般认为烟蚜酯酶基因拷贝数的增加导致了酯酶的过量表达,从而产生对杀虫剂的抗性。从实验结果看,云南烟蚜3个抗性品系均未发生酯酶结构基因的扩增,说明云南烟蚜的抗性仍处于较低的水平。
2.3 钠离子通道突变检测
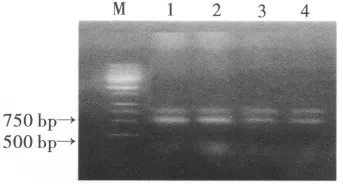
图1 酯酶基因扩增PCR产物电泳图谱Fig.1 Map of PCR product of esterase genes on agarose gel electrophoresis
钠离子通道基因PCR产物电泳图谱如图2,根据报道 (Guillemaud et al.,2003),如果烟蚜钠离子通道为抗性纯合型 (kdr/kdr),则PCR扩增产生300 bp条带,如果烟蚜钠离子通道为敏感纯合型 (kds/kds),则PCR扩增产生600 bp条带,如果烟蚜钠离子通道为抗性杂合型 (kdr/kds),则PCR扩增产生300、600 bp条带。据此可以判断,抗高效氟氯氰菊酯品系烟蚜为抗性杂合型,即抗高效氟氯氰菊酯烟蚜品系发生了钠离子通道突变。一般认为烟蚜对拟除虫菊酯的击倒抗性与钠离子通道发生改变有关 (Martinez-Torres et al.,1999),本文结果与此相符。但实验结果显示,相对敏感品系烟蚜也为抗性杂合型,这说明将有机磷相对敏感品系作为拟除虫菊酯相对敏感品系不合适。
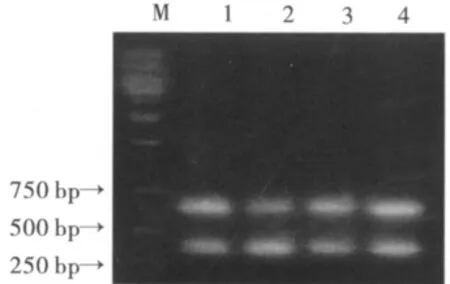
图2 钠离子通道PCR产物电泳图谱Fig.2 Map of PCR product of sodium channel on agarose gel electrophoresis
3 结论与讨论
有关桃蚜的抗性机制,在遗传学主要有3种。第一种机制:认为两种相似的羧酸酯酶 (E4或FE4)的过量产生导致了抗性,它们隔离和降解某些农药以阻止其到达靶标部位,产生了对有机磷类杀虫剂高水平抗性和氨基甲酸酯类杀虫剂的低水平抗性,以及对菊酯类杀虫剂的一定抗性。Field等 (1999,2002)对桃蚜与杀虫剂抗性有关的酯酶基因进行了克隆和分析,发现酯酶过量产生是其结构基因扩增的结果。第二种机制:认为乙酰胆碱酯酶敏感性降低导致桃蚜对氨基甲酸酯的极强抗性 (Guillemaud1 et al.,2003)。第三种机制:对拟除虫菊酯的击倒抗性与钠离子通道发生改变有关。对于拟除虫菊酯抗性,钠离子通道突变起主要作用,酯酶机制只起增强的次要作用(Martinez-Torres et al.,1999)。本文研究表明,云南烟蚜α-NA羧酸酯酶活力的增强是云南烟蚜对有机磷类杀虫剂氧化乐果、氨基甲酸酯类杀虫剂灭多威以及菊酯类杀虫剂高效氟氯氰菊酯的抗性机制之一,但未发现酯酶基因扩增,仅仅是酶活力的增强,这与Field等 (1999)的结果有所不同,这可能是因为选择压力不高,尚未导致酯酶基因拷贝数的增加,这也表明云南烟蚜对有机磷杀虫剂的抗性水平仍然不高,这有利于抗性的治理。AChE活力的增强对有机磷抗性有一定贡献,至于AChE是否发生变构,尚需进一步研究。本文研究发现,抗拟除虫菊酯烟蚜品系发生了钠离子通道突变,这与前人研究结果相符,敏感品系检测结果也为抗性杂合型,说明拟除虫菊酯相对敏感品系选择不够合适,这也是抗性品系虽然检出钠离子通道发生突变,然而生物测定仍显示抗性水平不高 (26.3倍)的原因。
References)
Anstead JA,Williamson MS,Eleftherianos I,Denholm I,2004.High -throughput detection of knockdown resistance in Myzus persicae using allelic discriminating quantitative PCR.Insect Biochemistry and Molecular Biology,34:871-877.
Anstead JA,Williamson MS,Denholm I,2005.Evidence for multiple origins of identical insecticide resistance mutations in the aphid Myzus persicae.Insect Biochemistry and Molecular Biology,35:249-256.
Cassanelli S,Cerchiari B,Giannini S,Bizzaro D,Mazzoni E,Manicardi GC,2005.Use of the RFLP-PCR diagnostic test for characterizing MACE and kdr insecticide resistance in the peach potato aphid Myzus persicae.Pest Management Science,61:91-96.
Criniti A,Mazzoni E,Cassanelli S,Cravedi P,Tondelli A,Bizzaro D,Manicardi GC,2008.Biochemical and molecular diagnosis of insecticide resistance conferred by esterase,MACE,kdr and superkdr based mechanisms in Italian strains of the peach potato aphid,Myzus persicae(Sulzer).Pesticide Biochemistry and Physiology,90:168-174.
Field LM,Devonshie AL,Forde BG,1988.Molecular evidence that insecticide resistance in peach-potato aphid(Myzus persicae Sulz.)results from amplification of an esterase gene.Biochemical Journal,251:309-312.
Field LM,Crick SE,Devonshie AL,1996.Polymerase chain reactionbase identification of insecticide resistance genes and DNA methylation in the aphid Myzus persicae(Sulzer).Insect Molecular Biology,5(3):197-202.
Field LM,Anderson AP,Denholm I,Foster SP,Harling ZK,Javed N,Martinez-Torres D,Moores GD,Williamson MS,Devonshire LA,1997.Use of biochemical and DNA diagnostics for characterising multiple mechanisms of insecticide resistance in the peach-potato aphid,Myzus persicae(Sulzer).Journal of Pesticide Science,51:283-289.
Field LM,Blackman RL,Tyler-Smith C,Devonshie AL,1999.Relationship between amount of esterase and gene copy number in insecticide - resistant Myzus persicae(Sulzer).Biochemical Journal,339:737-742.
Field LM,Foster SP,2002.Amplified esterase genes and their relationship with other insecticide resistance mechanisms in English field populations of the aphid,Myzus persicae(Sulzer).Pest Management Science,58(9):889-894.
Guillemaud1 T,Brun1 A,Anthony N,Sauge MH,Boll R,Delorme R,Fournier D,Lapchin P,Vanlerberghe-Masutti F,2003.Incidence of insecticide resistance alleles in sexually-reproducing populations of the peach-potato aphid Myzus persicae(Hemiptera:Aphididae)from southern France.Bulletin of Entomological Research,93:289-297.
Gu CB,Wang KY,Xin HJ,Guo QL,Wang G,2005.Study on the resistance of Myzus Persicae(Sulzer)in major tobacco planting areas in Shandong Province.Acta Tabacaria Sinica,11(4):21-23.[顾春波,王开运,辛海军,郭庆龙,王刚,2005.山东省主要烟区烟 (桃)蚜抗药性研究.中国烟草学报,11(4):21-23]
Gu CB,Wang KY,Xin HJ,Guo QL,Wang G,2005.Study on the resistance of Myzus persicae(Sulzer)in major tobacco planting areas in Shandong Province.Acta Tabacaria Sinica,11(4):21-23.[顾春波,王开运,辛海军,郭庆龙,王刚,2005.山东省主要烟区烟 (桃)蚜抗药性研究.中国烟草学报,11(4):21-23]
Liu XB,Liu CM,2008.Resistance of Myzus persicae(Sulzer)to insecticides in the major tobacco-planting areas of Fujian Province.Entomological Journal of East China,17(4):253-258.[刘筱兵,刘长明,2008.福建主要烟区烟蚜抗药性.华东昆虫学报,17(4):253-258]
Martinez-Torres D,Foster SP,Field LM,Devonshire AL,Willliamson MS,1999.A sodium channel point mutation is associated with resistance to DDT and pyrethroid insecticides in the peach-potato aphid,Myzus persicae(Sulzer)(Hemiptera:Aphididae).Insect Molecular Biology,8(3):339-346.
Song CM,Wu XF,Deng JH,Lei CL,2006.Monitoring insecticide resistance of Myzus persicae in tobacco fields in Yunnan.Chinese Bulletin of Entomology,43(4):500-503.[宋春满,吴兴富,邓建华,雷朝亮,2006.云南主要烟区烟蚜抗药性的监测.昆虫知识,43(4):500-503]
Song CM,Wu XF,Deng JH,Lei CL,2006.Activity of detoxicating enzyme of Myzus persicae in different tobacco areas of Yunnan.Journal of Environmental Entomology,28(2):55-60.[宋春满,邓建华,吴兴富,雷朝亮,2006.云南主要烟区烟蚜种群解毒酶活力比较.环境昆虫学报,28(2):55-60]
Srigiriraju L,Semtner PJ,Anderson TD,Bloomquist JR,2010.Monitoring for MACE resistance in the tobacco-adapted form of the green peach aphid,Myzus persicae(Sulzer)(Hemiptera:Aphididae)in the eastern United States.Crop Protection,29:197-202.
Wu XF,Liu GH,Deng JH,Ye JW,Song CM,Song K,2004.Primary studies on the difference of insecticides resistance of myzus nicotiance(Blackman)in Yunnan.Journal of Yunnan Agricultural U-niversity,19(1):73-77.[吴兴富,刘光辉,邓建华,叶佳伟,宋春满,宋昆,2004.云南烟蚜的抗药性差异研究初报.云南农业大学学报,19(1):73-77]
Yang ZX,Chen XM,Feng Y,Miao YC,2006.Method improvement for extraction genomic DNA from aphids.Chinese Bulletin of Entomology,43(6):880-884.[杨子祥,陈晓鸣,冯颖,缪迎春,2006.蚜虫基因组 DNA提取方法的改进.昆虫知识,43(6):880 -884]
