长木蜂蜂粮中微生物丰度及抑菌活性菌株的筛选
2012-06-09贺春玲张淑霞嵇保中刘曙雯
贺春玲,张淑霞,嵇保中,刘曙雯
(1.河南科技大学林学院,河南洛阳 471003;2.南京林业大学森林资源与环境学院,南京 210037;3.南京中山陵园管理局,南京 210014)
酿贮蜂粮是膜翅目2万多种花粉蜂较为普遍的习性。雌蜂筑好巢室后,一次性备足幼虫一生所需的蜂粮,然后在蜂粮上产卵并封闭巢室,孵化出的幼虫完全依赖蜂粮为食完成发育 (吴燕如,1965)。蜂粮 (Bee bread)也称蜂面包、蜂巢花粉,是采粉蜂将花粉团卸落在巢房中,通过咬碎、吐蜜湿润等行为对花粉团进行初步加工后,在微生物的作用下,封藏的花粉团经过一定时间的发酵所形成的蜂花粉酿制产物 (嵇保中等,2006)。蜂粮中含有丰富的微生物资源,贮备的蜂粮在巢房中有一个复杂的微生物区系变化和生物化学变化过程 (袁耀东,1991;苏松坤,2000)。Gilliam et al.(1989)从杏仁花粉、蜂花粉和1、3、6周蜂粮样品中分离到芽孢杆菌属的6种芽孢杆菌41个菌落和148株霉菌。苏松坤等 (2001)从中国茶的手采花粉、蜂花粉和不同酿制时间的蜂粮样品中分离出207个细菌菌落和9个属131株霉菌。其中蜂粮中的微生物及其代谢产物能有效抑制蜂粮中杂菌的生长,在蜂粮的酿制过程中具有十分重要的作用 (Gilliam et al,1997;苏松坤,2002)。
长木蜂Xylocopa tranquebarorum属蜜蜂科Apidae木蜂属Xylocopa的野生蜂类,与蜜蜂类似,它们采集芍药 Paeonia lactiflora、虞美人 Papaver rhoeas、槐花Sophora japonica、云实Caesalpinia decapetala、蔷薇Rosa spp、女贞Ligustrum lucidum等植物花粉制作蜂粮 (贺春玲等,2009)。罗禄怡(1992)报道长木蜂蜂粮在巢室内能较长时期保持湿润状态不会霉变。贺春玲等 (2009)报道长木蜂蜂粮的醇提液 (70%)对枯草芽孢杆菌具有很强的抑制作用。关于长木蜂蜂粮的微生物群落变化规律、在酿制过程中的功能以及蜂粮长期保持的机制等问题国内外未见报道。本文以芍药花粉的长木蜂蜂粮为研究对象,初步研究长木蜂蜂粮在酿制过程中微生物的变化规律,同时筛选具有抑菌活性的微生物菌株,为揭示蜂粮酿制及长期保存过程中防腐机制和开发新的防腐资源奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试长木蜂
不同巢室中的越冬雌蜂、酿贮蜂粮盛期的雌蜂及长木蜂的幼虫和蛹均采集于南京林业大学树木标本园、南京中山植物园和南京情侣园花卉公园。
1.1.2 样品的采集
2008年5月芍药盛花期,在南京情侣园花卉公园采集芍药花粉、芍药长木蜂花粉、不同酿制阶段的芍药长木蜂蜂粮样品。具体的采集方法见贺春玲等 (2010)。
手采芍药花粉样品:分为芍药花未开放前采集的样品和芍药花已经开放后的样品,分别表示为花粉 (1)和花粉 (2)。
芍药花未开放前样品采集:在芍药大蕾期,将花苞采下放入灭菌的采集袋中,带回实验室后在无菌操作台上取出花粉放入灭菌的5 mL离心管中,4℃保存备用。
芍药花已经开放后样品的采集:在芍药大蕾期,用细尼龙网袋套将花蕾罩上,待花开放后用灭菌的镊子迅速取下花粉,放入灭菌的的5 mL离心管中,低温带回实验室后4℃保存备用。
长木蜂幼虫虫粪和长木蜂制作的巢室隔板样品采集:2008年5月中旬,在南京情侣园花卉公园的芍药园附近采集捆绑的长木蜂筑巢枯竹,带回实验室后,在无菌操作间解剖取出幼虫的虫粪和巢室隔板放入灭菌的培养皿内,4℃保存备用。
1.1.3 培养基的配置
牛肉膏蛋白胨培养基 (简称NA)、改良LB培养基、改良MRS培养基 (pH4.5、pH6.5)、产芽孢培养基、酵母浸膏麦芽汁培养基、葡萄糖天门冬酰胺培养基和PDA培养基的配置参见周德庆(1986)、凌代文 (1999)、黄秀梨 (1999)、东秀珠等 (2001)、杨洁彬 (1996)的方法进行。本实验所用试剂均为国产分析纯。
1.1.4 指示菌株
测试细菌为金黄色葡萄球菌Staphylococcus aureus、大肠杆菌Escherichia coli、枯草芽孢杆菌Bacillus subtilis;测试真菌为青霉菌Penicillium citrinum、黑曲霉菌Apergillus oryzae、根霉菌Rhizopus、毛霉菌Mucor、假丝酵母Candida sp.和啤酒酵母菌Saccharomyces cerevisiae;所有菌株均由南京林业大学森林资源与环境学院微生物教研室提供。细菌菌种在牛肉膏蛋白胨固体斜面培养基37℃下培养24 h,真菌菌种在PDA固体斜面培养基28℃下培养48 h,4℃下保存备用。
1.2 方法
1.2.1 长木蜂体表微生物的分离
采集不同时期带有长木蜂筑巢的枯竹并带回实验室,在无菌操作间解剖取出越冬雌蜂、酿贮蜂粮盛期的雌蜂以及幼虫、预蛹和蛹并称重,然后分别放入5 mL灭菌离心管中,按照虫体重量每克加入9 mL的无菌水,记为10-1;按照稀释涂布分离法的稀释方法 (周德庆,1986)稀释至10-3、10-4浓度的稀释溶液备用。
稀释到10-3和10-4的稀释液样品分别吸取200 μL用涂棒均匀涂布在NA、改良LB培养基、MRS培养基 (pH6.5、pH5.5和pH4.5)平板上,在28℃培养。随时观察并记录菌株的生长情况,统计样品中的菌落总数,然后用接种针挑取不同形态的菌落移入相应的培养基上纯化、培养。每个样地取不同巢室的虫态 (越冬雌蜂、酿贮蜂粮盛期的雌蜂以及幼虫、预蛹和蛹)各3头,每个样品重复3次,3次的平均值为该样品在各种培养基上的菌落数。
1.2.2 长木蜂幼虫虫粪和巢室隔板的微生物分离
在无菌操作间称取幼虫虫粪和巢室隔板各0.3000 g于灭菌的10 mL离心管中,用无菌的玻璃棒将虫粪和巢室隔板捣碎后,加入2.7 mL去离子水,充分摇匀,记为10-1;按照稀释涂布分离法的稀释方法 (周德庆,1986)稀释至 10-3、10-4浓度的稀释溶液备用。
稀释到10-3和10-4的稀释液样品分别吸取200 μL用涂棒均匀涂布在NA、改良LB培养基、MRS培养基 (pH4.5和pH6.5)平板上,在28℃培养。随时观察并记录菌株的生长情况,统计样品中的菌落总数,然后用接种针挑取不同形态的菌落移入相应的培养基上纯化、培养。每个样品重复3次,3次的平均值为该样品在各种培养基上的菌落数。
1.2.3 芍药花粉、芍药长木蜂花粉和不同日龄的蜂粮样品中微生物分离
称取采集的芍药花粉、新鲜芍药长木蜂采集的花粉、1日、2日、3日、……10日、15日、20日、30日芍药长木蜂蜂粮样品各0.3000 g于灭菌的10 mL离心管中,加入2.7 mL去离子水,充分摇匀,记为10-1;按照稀释涂布分离法的稀释方法 (周德庆,1986)稀释至10-3、10-4浓度的稀释溶液备用。微生物分离培养方法同1.2.2。
不同日龄的蜂粮样品:指长木蜂采集花粉蜜制作蜂粮完成后在蜂粮上产卵开始,记为1日龄,第2天记为2日龄,依此类推3日龄、4日龄……1.2.4 菌株的鉴定
1.2.4.1 细菌菌落形态鉴定
观察菌落表面颜色、隆起度、质地、边缘光滑、粗糙、菌落直径、干燥度、产芽孢有无和革兰氏染色。
湖泊水体是OCPs的一个重要汇集地,具有流动性小、水交换周期长、对污染物的稀释能力弱、生态系统相对较脆弱、生态平衡容易遭到破坏且不容易恢复等特点,所以较其他水环境更容易受到污染[20]。有机氯农药污染湖泊水体的途径有地表径流、大气沉降和湖底沉积物的二次释放。
1.2.4.2 放线菌菌落形态鉴定
插片培养法显微镜观察菌丝形态、颜色、质地、分枝、横隔、孢子着生位置、孢子形状、颜色、孢子丝形状、颜色、气生菌丝、基内菌丝、菌丝颜色、质地、孢子粉颜色、密度等。
1.2.5 抑菌活性菌株的初筛
指示细菌的抑菌活性:采用琼脂块法对所分离得到的菌株进行抑菌活性初筛。具体方法为将分离得到的菌株划线培养与相应的培养基,在28℃培养2~5 d,用打孔器 (Φ=6 mm)将菌落打下并移至含有指示菌的营养琼脂平板上,然后在28℃培养2~5 d,每个菌株重复3次,观察其抑菌活性。
指示真菌的抑菌活性:采用平板对峙培养法,将分离到的菌株与指示真菌在PDA平板上进行对峙培养,用打孔器 (Φ=6 mm)将在PDA上活化的指示真菌打成菌柄块,用接种针移入PDA平板中央,在距中央2 cm处涂分离菌株,27℃恒温培养,待CK长满皿时,测其抑菌带的宽度。每菌株设3皿重复,不接待测菌的为CK。
1.3 数据采集与分析
采用多功能型全自动菌落/显微图像分析仪(杭州迅数科技有限公司生产)进行数据采集;采用Microsoft Excel和SPSS Base Ver.13.0统计软件进行数据分析。
2 结果与分析
2.1 长木蜂体表微生物分离结果
采用 NA、改良 LB培养基、MRS(pH4.5)、MRS(pH5.5)、MRS(pH6.5)培养基对长木蜂雌蜂酿贮蜂粮盛期体表微生物状况进行分离,结果见图1(A),由图1(A)表明在5种培养基上分离到的微生物菌落数不同,在MRS4.5的培养基上分离到的菌落数量最多,为21176±5392个/g;在改良LB培养基上分离到得菌落数最少,为2400±1509个/g。通过菌落形态观察和显微形态观察,发现在五种培养基上分离到的微生物主要有细菌、酵母菌和放线菌,其中在MRS培养基上分离到的菌落主要属于乳酸菌和酵母菌。

图1 长木蜂雌蜂在不同培养基 (A)和不同阶段 (B)体表微生物菌落数量Fig.1 Microorganism colonies on body surface of female in different culture mmedium(A)and in different stages(B)X.tranquebarorum
2.2 长木蜂蜂粮酿制过程中微生物菌落数量变化规律
采用 NA、改良LB培养基、MRS(pH4.5)、MRS(pH6.5)培养基对长木蜂雌蜂酿贮蜂粮过程中蜂粮微生物数量的变化情况进行培养分离 (图2)。芍药未开放之前的花粉样品,在各培养基中均未分离到微生物菌落;在芍药开花后采集的花粉样品,在NA培养基上分离到的细菌菌落数量最多,改良LB培养基上分离的菌落数量少,而MRS(4.5)和MRS(6.5)培养基上未分离到菌落;芍药长木蜂花粉在上述四种培养基上均分离到微生物菌落;长木蜂蜂粮的微生物菌落的变化规律,1日龄蜂粮中菌落数最多,2日龄开始下降,3日龄降至降低点,在4日龄阶段微生物的菌落数出现一个低谷,然后升高;8~12日龄又出现一个小高峰,12日龄后,长木蜂蜂粮中微生物基本趋于稳定状态,由此可知,长木蜂蜂粮在酿制过程中内部的微生物区系发生了很大变化。
2.3 长木蜂蜂粮中分离到的微生物菌株
采用 NA、改良 LB培养基、MRS(4.5)、MRS(6.5)培养基分别对手采芍药花粉、芍药长木蜂花粉和不同酿制时间的蜂粮样品进行微生物分离,根据菌落的颜色、形态、革兰氏染色以及培养时间的长短和培养基的不同,将分离的菌株进行纯化,共分离菌株68株,其中细菌43株,酵母17株,放线菌8株。酵母菌株主要分离自MRS(4.5)和MRS(6.5)上,放线菌菌株主要分离自NA培养基上,蜂粮中的酵母菌主要来自长木蜂雌蜂的体表,雌蜂在酿贮蜂粮过程中添加到蜂粮中。
2.4抑菌活性菌株初筛
2.4.1对指示细菌的抑菌活性
采用琼脂块法对分离的68株菌株进行抑菌活性初筛。68株菌株中其中12株对指示细菌有抑制作用 (表1,图版1)。分离的酵母菌菌株对细菌和真菌均没有抑菌活性,分离的细菌菌株PT-1、NF-25、NF-26、NF-27、NF-28和NF-33对
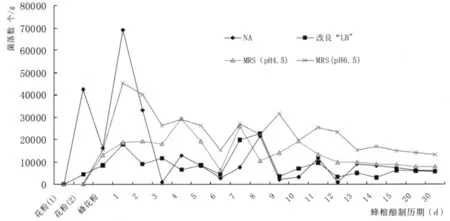
图2 长木蜂蜂粮酿贮过程中微生物数量的变化规律Fig.2 The dynamica changes of the amount of bacterial colonies during the process of brewing bee bread for X.tranquebarorum
指示细菌有明显的抑制作用,对金黄色葡萄球菌有很好的抑菌活性;NF-11、NF-17、NF-18、NF-19、NF-32、NF-34属于放线菌,对金黄色葡萄球菌有抑制作用,其中NF-32和NF-34对枯草芽孢杆菌也表现出很好的抑菌活性。
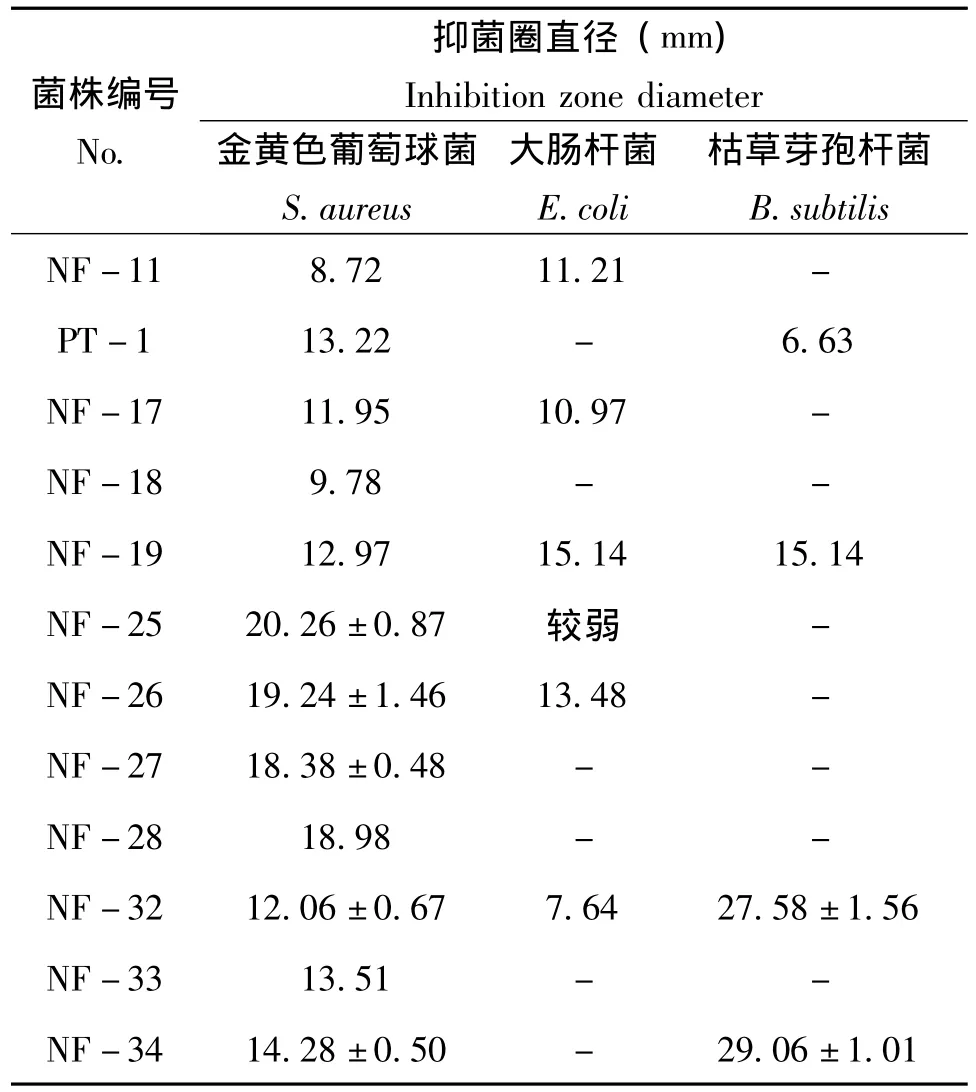
表1 从蜂粮中分离的菌株对指示细菌的抑菌活性Table 1 The antibacterial activity of strains separated form bee bread
2.7.2 对指示真菌的抑菌活性
筛选的68株菌株中,对指示真菌有抑菌活性的有10株 (表3),抑菌活性较强的有3株,分别为NF-25、NF-32和NF-34,其中NF-34菌株对青霉菌、黑曲霉菌、毛霉菌均有很好的抑制作用,对啤酒酵母的抑制作用最强,抑菌圈直径为33.45±2.57mm,但对假丝酵母抑制作用弱 (图版7-1)。
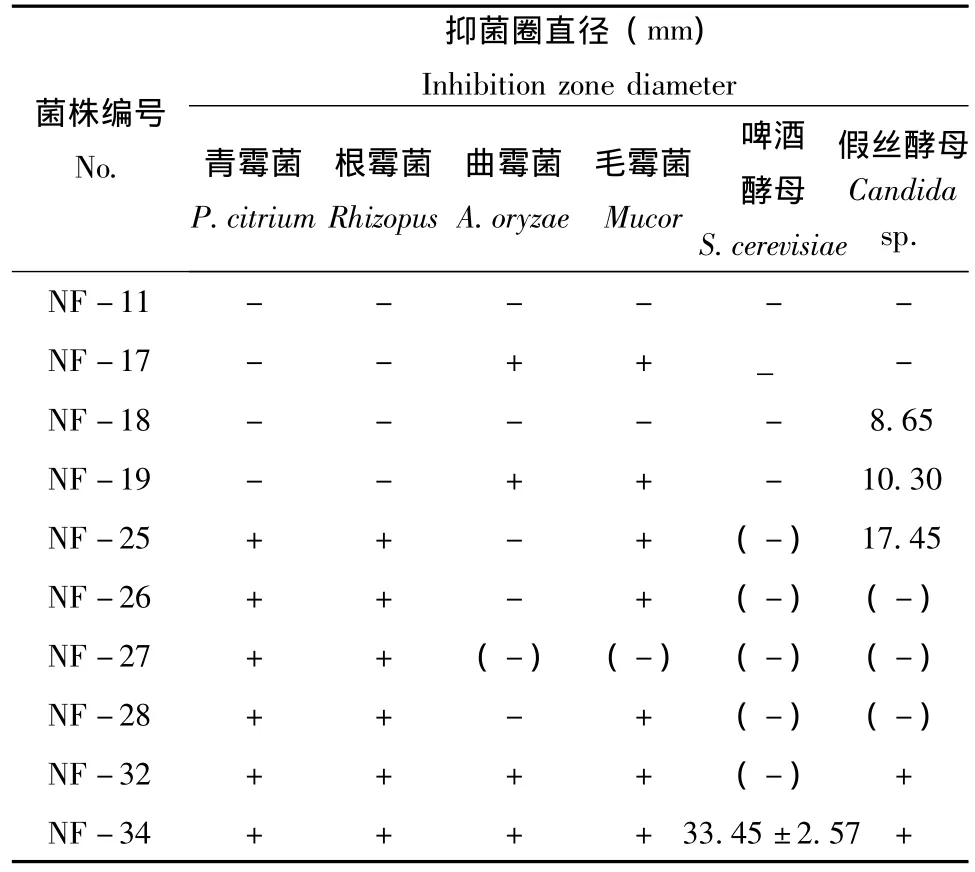
表2 从蜂粮中分离的菌株对真菌的抑菌活性Table 2 The antibacterial activity of strains separated form bee bread to fungi
3 结论与讨论
3.1 培养基种类的选择
没有一种培养基或一种培养条件能够满足自然界中一切生物的生长,在一定程度上所有的培养基都是有选择性的 (沈萍,2002)。我们参照苏松坤 (2000)的细菌分离方法,对长木蜂蜂粮中的有益细菌进行分离,MRS培养基主要是分离乳酸菌的培养基,本实验采用MRS(pH4.5)和MRS(pH6.5)培养基分离到大量的酵母菌菌落,而分离到的细菌菌落很少,分离结果与文献报道不一致,具体原因还有待进一步研究。在NA培养基上,除分离到大量的细菌外,还分离到放线菌菌落,并且发现在放线菌菌落周围可以抑制其它微生物的生长。由于分离微生物采用的是新鲜样品进行分离,酵母菌和放线菌生长时间相对较长,由于取样的限制,我们在分离过程中没有补充专用酵母菌和放线菌的分离培养基,针对选择的几种培养基分离到的菌株进行了微生物群落的分析,可能还不能完全涵盖长木蜂蜂粮微生物的全貌,在以后的研究中有待进一步改进。
3.2 长木蜂蜂粮中微生物的变化规律
本实验结果表明,长木蜂蜂粮中细菌和酵母菌属于优势菌株,在芍药花粉中没有分离到酵母菌,在芍药长木蜂花粉中分离到酵母菌,然后随蜂粮酿制时间的延长,细菌和酵母菌的数量剧增,3日龄酵母菌的数量下降,酸度降低,其变化趋势与长木蜂蜂粮pH的变化趋势基本一致 (贺春玲等,2010)。长木蜂蜂粮中也分离到乳酸菌,但在MRS(pH4.5)和MRS(pH6.5)上分离到的菌株数量较少,而在改良LB培养基上分离到得菌株较多,由此也可以看出长木蜂蜂粮中的乳酸菌与茶蜂粮中的乳酸菌菌株区系可能不同。乳酸菌是能从葡萄糖发酵产生大量乳酸的细菌,是长木蜂蜂粮pH值降低的主要原因,本文通过采用BCG乳酸鉴定培养基初步对分离的有抑菌活性的细菌菌株进行乳酸菌鉴定,但具体属于哪一种乳酸菌还需要进一步鉴定获得。因此,对长木蜂蜂粮中乳酸菌的来源、分离培养培养基的选择以及在蜂粮中担负的抑菌活性功能均有待进一步研究。
3.3 长木蜂蜂粮中微生物来源
蜜蜂蜂粮中细菌主要来自花粉产地的生态环境、蜜蜂自身携带和蜂巢内的部分细菌,在蜂粮酿制过程中,由于蜂巢环境和蜜蜂的作用,导致蜂巢中的细菌发生复杂的变化 (苏松坤,2001)。长木蜂蜂粮中的微生物菌株主要来源于花粉产地的生态环境、长木蜂自身的携带和蜂巢内部的环境。长木蜂营巢主要选择直径1.2~2.5 cm的枯竹上,雌蜂属于独栖性蜂类,多数越冬雌蜂在翌年的4月份另筑新巢,少数利用旧巢,但不论是利用旧巢或另筑新巢,对于旧巢和新巢中的蜂粮微生物培养结果看其区别不大,主要细菌和酵母菌;在不同地点采集的雌蜂,体表微生物分离结果均有酵母菌和放线菌,因此,酵母菌和部分放线菌可能属于长木蜂雌蜂体表的共生菌,在长期进化过程中形成的,对蜂粮的保鲜有非常重要的意义,对于长木蜂体表微生物对蜂粮酿制过程中的保鲜作用还有待进一步研究。
References)
Dong XZ,Cai MY,2001.Common Bacteria System Identification Manual.Beijing:Science Press.350-398.[东秀珠,蔡妙英,2001.常见细菌系统鉴定手册.北京:科学出版社.350-398]
Egorova A,1971.Preservative microflora in stored pollen.Veterinariya,8:40-41.
Gilliam M,Prest DB,Lorenz BJ,1989.Microbiology of pollen and bee bread:taxonomy and enzymology of molds.Apidologie,20:53-68.
Gilliam M,1997.Identification and roles of nonpathogenic microflora associated with honey bees.FEMS Microbiology Letters,155:1 -10.
He CL,Ji BZ,Liu SW,2009.Nesting,foraging and food-storing behavior of Xylocopa tranquebarorum.Acta Entomologica Sinica,52(9):984-993.[贺春玲,嵇保中,刘曙雯,2009.长木蜂筑巢和采粉贮粮行为.昆虫学报,52(9):984-993]
He CL,Ji BZ,Liu SW,2009.Study on the antibacterial activity of the raw extraction from bee bread of Xylocopa tranquebarorum.Journal of Nanjing Forestry University,33(2):17-2l.[贺春玲,嵇保中,刘曙雯,2009.长木蜂蜂粮租提液抑菌活性的研究.南京林业大学学报,33(2):17-2l]
He CL,Ji BZ,Liu SW,2010.Determination of pH and the pollen germination ability during the process from pollen to bee bread of Xylocopa tranquebarorum.Journal of Environmental Entomology,32(1):92-98.[贺春玲,嵇保中,刘曙雯,2010.长木蜂蜂粮酿贮过程中pH和花粉活力的测定.环境昆虫学报,32(1):92 -98]
Huang XL,1999.Microbiology Experiment Guidance.Beijing:Higher Education Press.58-59.[黄秀梨,1999.微生物学实验指导.北京:高等教育出版社.58-59]
Ji BZ,Liu SW,Xu LN,Zhang K,2006.Advances on the bee bread research.Chinese Agricultural Science Bulletin,22(8):165-169.[嵇保中,刘曙雯,徐丽娜,张凯,2006.蜂粮研究进展.中国农学通报,22(8):165-169]
Jia SX,Zhang SX,Jia ZD,2001.Acid survival method of bees.Apicultural Science and Technology,(3):18-20.[贾绍兴,张水仙,贾振东,2001.蜜蜂的酸性生存法.养蜂科技,(3):18-20]
Jiang CL,Xu LH,2001.Microbial Resources Development and Utilization.Beijing:China Light Industry Press.1-19.[姜成林,徐丽华,2001.微生物资源开发利用.北京:中国轻工业出版社,1 -19]
Ling DW,1999.Classification and Identification and Experimental Method of Lactic Acid Bacteria.Beijing:China Light Industry Press.84-109.[凌代文,1999.乳酸细菌分类鉴定及实验方法.北京:中国轻工业出版社,84-109]
Luo LY,Luo CB,Xie JS,Ding YS,1992.Study about domestication and utilization of wild bee on herbage seed breeding farm of red clovcr.Pratacultural Science,9(6):5-8.[罗禄怡,罗次毕,谢继石,丁应生,1992.红三叶草种籽场长木蜂的人工训育及利用研究.草业科学,9(6):5-8]
Shen P,2002.Microbiology.Beijing:Higher Education Press.2 -18.[沈萍,2002.微生物学.北京:高等教育出版社.2-18]
Su SK,2000.Studies on brew mechanism and nutritive value of bee bread.Master thesis of Zhejiang University.[苏松坤,2000.蜂粮的酿制机理和营养价值的研究.浙江大学硕士学位论文]
Su SK,Chen FL,Yu XP,2002.Mutative rule of bacteria during the ferment from pollen to bee bread.Journal of Zhejiang University,28(5):575-577.[苏松坤,陈盛禄,余旭平,2002.蜂粮酿制过程中细菌的变化规律.浙江大学学报,28(5):575-577]
Su SK,Chen FL,Yu XP,Lin XZ,Xu FL,2001.Isolation and identification of bacter ia from pollen and bee bread.Journal of Zhejiang University,27(6):627-630.[苏松坤,陈盛禄,余旭平,2001.花粉和蜂粮中细菌的分离和鉴定.浙江大学学报,27(6):627 -630]
Wu YR,1965.Economic Insect Fauna of China.Fasc.9,Hymenoptera:Apoidea.Beijing:Science Press.4-19.[吴燕如,1965.中国经济昆虫志 (第九册,膜翅目,蜜蜂总科).北京:科学出版社.4-19]
Yang JB,1996.Biological Basis and Application of Lactic Acid Bacteria.Beijing:China Light Industry Press.177-184.[杨洁彬,1996.乳酸菌-生物学基础和应用.北京:中国轻工业出版社.177 -184]
Yuan YD,1991.The composition and role of the bee bread.Apiculture of China,(6):36-37.[袁耀东,1991.蜂粮的成分和作用.中国养蜂,(6):36-37]
Zhou DQ,1982.Microbiology Laboratory Manual.Shanghai:Shanghai Science Press:532-574.[周德庆,1982.微生物学实验手册.上海:上海科学出版社.532-574]
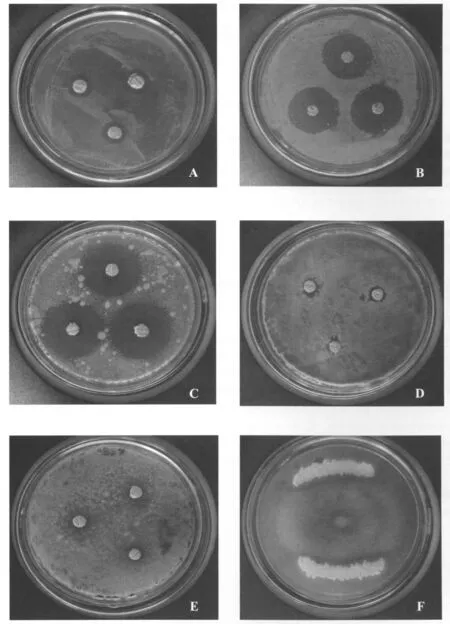
图版1 NF-34菌株的抑菌活性Plate 1 The antibacterial activity of strain NF-34
