高效液相色谱法检测饲料中咪达唑仑的含量
2012-06-08赵建元杨曙明
赵 燕 赵建元, 杨曙明 魏 涛
(1.中国农业科学院农业质量标准与检测技术研究所农业部农产品质量安全重点实验室,北京 100081;2.北京联合大学应用文理学院,北京 100083)
咪达唑仑(midazolam)是临床常用的含咪唑环的苯二氮草类药物,具有抗焦虑、惊厥、肌肉松弛、顺序性遗忘以及催眠的作用,目前广泛应用于麻醉领域[1]。另外,咪达唑仑具有脂溶性高,半衰期短的特点[2-5]。咪达唑仑是一种镇定安定剂,将其添加入饲料可以促使动物入睡,从而产生促增重作用。由于咪达唑仑作为增重剂效果好,经济回报高,部分违法者在畜禽养殖过程中使用咪达唑仑作为饲料添加剂,导致咪达唑仑可能会残留在各种食用组织中,人食用此类动物产品后,会表现出恶心、呕吐、头晕无力等现象,过量中毒可出现昏迷、心跳过速等症状,人久吃则会产生耐药性。我国农业部第176号公告中指出,禁止在饲料中使用咪达唑仑,而我国尚未出台有关饲料中咪达唑仑的检测方法。因此,迫切需要通过系统的研究建立饲料中咪达唑仑的检测方法,从而促进饲料规范生产和科学利用,为促进我国畜牧业发展,饲料产业提升提供技术支持。截止目前,关于饲料样品中的咪达唑仑的检测方法报道不多,尤其是用于饲料样品中咪达唑仑残留量测定的仪器分析确证方法鲜有报道[6]。国内外有关咪达唑仑的研究不多,且多数集中在对血浆中的残留测定方面,未涉及到饲料中咪达唑仑含量的测定[7-8]。本文建立了高效液相色谱法测定饲料中咪达唑仑含量的方法,操作简单、快速、准确、成本低。
1 材料与方法
1.1 材料与试剂
猪配合饲料、猪预混合饲料、猪浓缩饲料均取自国家饲料质量监督检验中心(北京)。乙腈、甲醇为色谱纯。水为Millipore超纯水,标准品纯度>99%,标准储备液为用甲醇配成的浓度为1 mg/ml的咪达唑仑,置于棕色瓶中在-80℃下保存。将储备液用甲醇继续稀释,制成浓度为1、10 μg/ml的标准工作液,4℃避光保存。
1.2 仪器与设备
分析天平,感量0.0001 g;垂直振荡器;高速冷却离心机;氮吹仪;旋涡混合仪;固相萃取柱(waters,C18-3cc-200 mg);1 ml针头过滤器(备有 0.45 μm 的微孔滤膜);高效液相色谱仪(Waters2695,配有紫外检测器2998)。
1.3 试样的处理
1.3.1 提取
准确称取1 g饲料样品(配合饲料、预混合饲料及浓缩饲料),置于50 ml的聚丙烯离心管中,加入5 ml乙腈提取液,垂直振荡10 min使其混匀,后于12000 r/min,4℃条件下离心10 min,转移上清液至10 ml聚丙烯离心管中。向试样中再加入5 ml试样提取液,重复提取1次。合并两次上清液,40℃下将上清液用氮气吹至近干,1 ml的甲醇漩涡振荡溶解备用。
1.3.2 净化
准确移取上述饲料试样各1 ml,再加2 ml水漩涡混匀。注入已用3 ml甲醇和3 ml水活化过的C18固相萃取小柱,然后用3 ml水淋洗,再用2 ml甲醇洗脱并收集洗脱液。洗脱液用氮气吹至近干,1 ml甲醇漩涡混合溶解,过0.45 μm的微孔滤膜,滤液在HPLC上测定。
1.4 色谱条件
色谱柱:Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:溶剂A甲醇+溶剂B超纯水;流速:1.0 ml/min;检测波长:254 nm;进样量:20 μl;柱温:30℃。流动相梯度及洗脱程序见表1。

表1 梯度洗脱程序
2 结果
2.1 校准曲线
在已提取净化好的饲料空白溶液中添加适量的标准工作液,在本实验确定的色谱条件下,从低浓度到高浓度依次进样,按其所得峰面积(纵轴)与对应的咪达唑仑浓度(横轴)做标准曲线,计算出回归方程和相应系数。试验测得咪达唑仑溶液浓度在1.00~10.00 μg/ml范围内线性良好:猪配合饲料线性回归方程为Y=47558X-1469.5,相关系数为R2=0.9976;预混合饲料线性回归方程为Y=49293X-272.47,相关系数为R2=0.9954;浓缩饲料线性回归方程为Y=44482X-5867.4,相关系数为R2=0.9979。标准曲线见图1~图3。

图1 猪配合饲料标准曲线
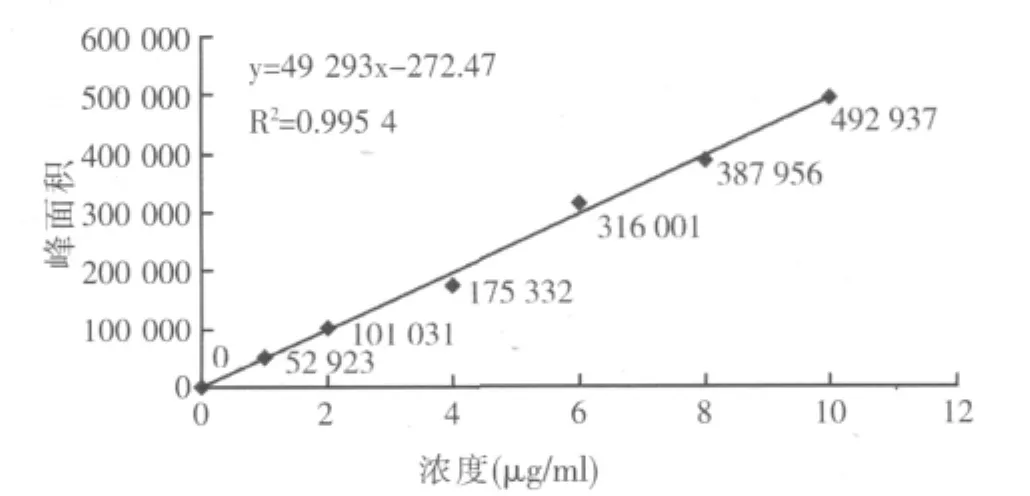
图2 猪预混合饲料标准曲线

图3 猪浓缩饲料标准曲线
2.2 定量限
依据液相色谱目标峰信噪比S/N>10确定方向定量限,测得饲料中咪达唑仑的定量限为1.0 mg/kg。
2.3 方法加标回收率及精密度试验
采用在空白饲料样品中添加目标化合物的方法测得回收率,每种饲料平行测定3次,连续进样3 d,测定结果见表2~表4。由表可知,在1.0 mg/kg的标准添加水平下,猪配合饲料回收率为70%~100%,猪预混合饲料回收率为60%~100%,猪浓缩饲料回收率为65%~100%;相对标准偏差均小于10%。重复性及再现性良好。

表2 猪配合饲料中咪达唑仑添加回收率结果(%)
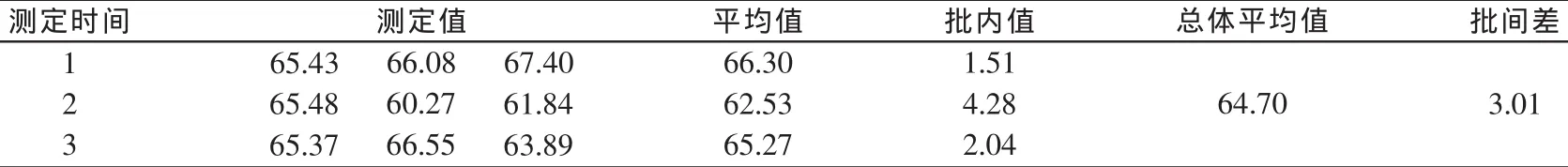
表3 猪预混合饲料中咪达唑仑添加回收率结果(%)
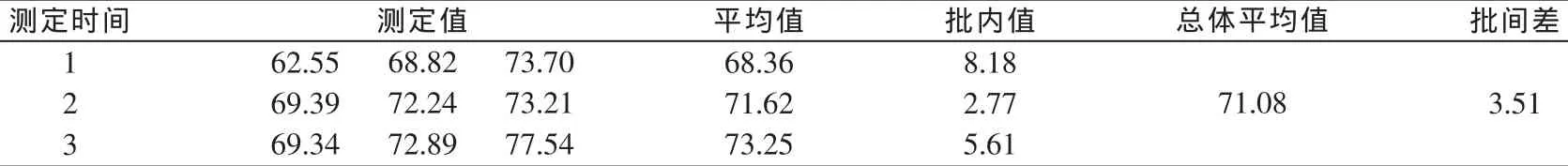
表4 猪浓缩饲料中咪达唑仑添加回收率结果(%)
3 讨论
3.1 前处理方法的确定
本标准用于测定饲料中咪达唑仑的含量,但饲料中复杂的基质使得进行液相色谱测定时干扰极大,因此在进行检测前选择良好的前处理方法是十分必要的。
3.1.1 提取条件的确定
由于咪达唑仑易溶于乙腈、甲醇以及乙酸乙酯等有机溶剂,实验尝试用乙腈、甲醇、乙酸乙酯、正己烷、丙酮、乙醇六种溶液提取饲料样品中的咪达唑仑,并进行高效液相色谱分析。结果表明,用正己烷、丙酮、乙醇提取时,提取效果不好;用乙酸乙酯提取时,虽回收率较高,但提取液在咪达唑仑出峰位置附近有很强的杂峰干扰,无法准确定量;用甲醇提取时,虽与杂峰分开,但回收率较低。用乙腈提取时,咪达唑仑提取完全,回收率较高,杂峰干扰小,所以我们选择乙腈为提取溶剂。乙酸乙酯提取色谱见图4。
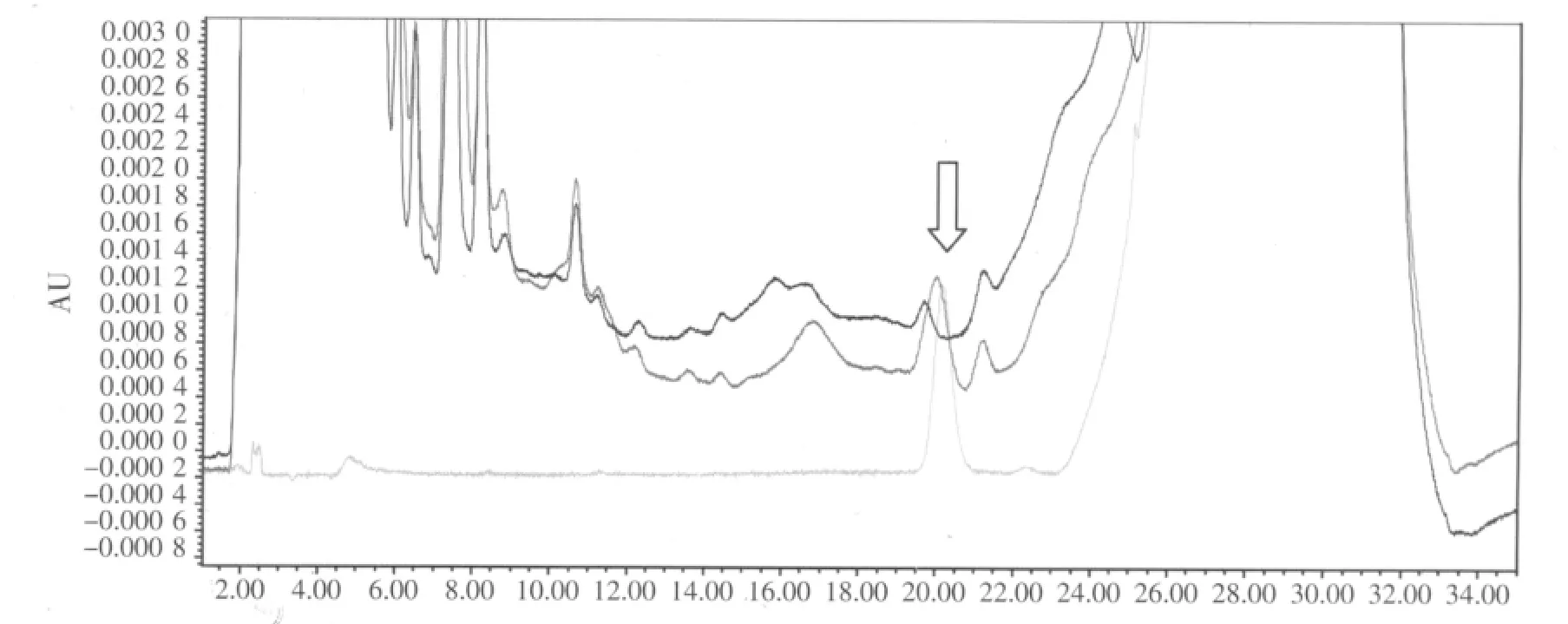
图4 乙酸乙酯提取配合饲料空白、添加及标准品比较
3.1.2 净化方法的确定
本方法采用固相萃取柱净化样品提取液。由于咪达唑仑极性较弱,选用C18柱和硅胶柱进行净化。实验结果表明,硅胶柱不能除去目标峰附近的杂峰干扰,而C18柱的分离效果较好,且回收率高,因此最终确立采用C18柱对饲料提取液进行固相萃取。
3.2 检测波长的确定
对标准工作液在200~400 nm以1 nm间隔扫描,测得咪达唑仑的最大吸收波长为223 nm。在实验过程中发现,223 nm波长处始终有杂峰干扰,无法去除。但此杂峰在254 nm波长时无紫外吸收,且分离良好。因此确定254 nm为最佳检测波长。
3.3 液相色谱柱的确定
由于咪达唑仑极性较弱,试验中尝试选用C18色谱柱进行测定,但因饲料基质中杂质众多不能在前处理中完全净化,用150 mm的C18色谱柱检测时分离度较低,干扰大,无法准确定量;用250 mm的C18柱检测时分离度明显增强,因此选择250 mm的C18柱进行检测。
3.4 流动相比例及梯度的确定
C18色谱柱为反相柱,实验时一般采用水、甲醇、乙腈等强极性溶剂作为流动相,实验表明咪达唑仑在甲醇的溶解度高,因此采用水+甲醇作为流动相进行测定。当甲醇比例大于58%时,目标峰出峰时间较早与杂峰分离度低;比例小于58%目标峰与杂峰难以分离。因此选用58%甲醇+42%的水作为流动相初始比例。又因在饲料提取过程中,乙腈提取出大量脂溶性杂质,使得样品中有大量残留,无法被58%甲醇流动相完全洗脱,为保证结果的稳定性,延长色谱柱使用寿命。故在目标峰保留时间之后将流动相中甲醇比例变化为100%,以清洗色谱柱中残留的大量脂溶性杂质。图5~图10为确定色谱条件下3种饲料的空白及标准添加色谱图。
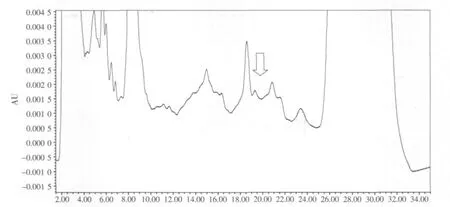
图5 猪配合饲料空白样品色谱

图6 猪配合饲料咪达唑仑添加色谱
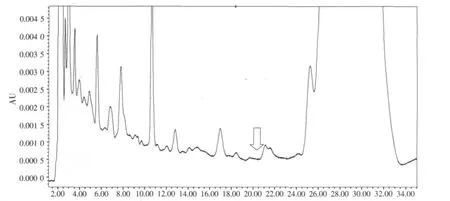
图7 猪预混合饲料空白样品色谱

图8 猪预混合饲料咪达唑仑添加色谱

图9 猪浓缩饲料空白样品色谱

图10 猪浓缩饲料咪达唑仑添加色谱
4 结论
本实验中所确立的检测方法适用于猪配合饲料、猪预混合饲料、猪浓缩饲料中咪达唑仑含量的测定,通过对仪器色谱条件及前处理条件的优化,以及采用C18固相萃取柱对样品提取液的净化,使得方法的灵敏度、精确度均能满足日常分析的要求,且具有检测成本低,操作简单,检测效率高等特点。
[1]徐波,张兴安,曾晓晖,等.HPLC法测定人血浆中咪达唑仑的浓度[J].中国药房,2008,19(20):1543-1545.
[2]Norio Y F,Yoshimasa I,Tomonori T.Sensitive determination of midazolam and 1-hydroxymidazolam in plasma by liquid-liquid extraction and column-switchig liquid chromatgraphy with ultraviolet absorbance detection and its application for measuring CYP3A activity[J].Journal of Chromatography B,2004,811:153-157.
[3]Jiang Q B,Walton N Y,Guna S W,et al.Studies on high-performance liquid chromatographic determination of midazolam in rat brain[J].Journal of Chromatography B,1996,683:276-280.
[4]Ma F,Lau C E.Determination of midazolam and its metabolites in serum microsamples by high-performance liquid chromatography and its application to pharmacokinetics in rats[J].Journal of Chromatography B,1996,682:109-113.
[5]郑晓林,梁健成,黄猛金.反相高效液相色谱法测定人血浆中咪达唑仑的浓度[J].海峡药学,2010,227-229.
[6]王敏,林维宣,郭德华,等.高效液相色谱-串联质谱法同时检测动物食品中多种大环内酯类药物[J].分析测试学报,2007,26(5):675-678.
[7]陆晓彤,蒋樾廉,张顺国.固相萃取-HPLC法测定儿童血浆中咪达唑仑的浓度[J].中国药房,2007,18(17):1326-1328.
[8]毛桂福,郭涛,夏东亚.用RP-HPLC法测定人血浆中咪达唑仑的含量[J].药学服务与研究,2008,8(4):297-299.
