影像学诊断方法在妇科肿瘤中的应用
2012-05-30彭卫军蒋朝霞
彭卫军 蒋朝霞
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
妇科肿瘤的影像学诊断手段主要包括超声、CT、MRI、PET/CT等,各种影像学手段在妇科肿瘤治疗前准确分期、治疗过程中监测疗效、发现肿瘤残余及复发等方面发挥着重要的作用。不同的影像学诊断方式在诊断不同的妇科肿瘤中,其优势也不尽相同。
1 宫颈癌的影像学诊断
1.1 超声诊断
超声在宫颈癌诊断中,以宫颈不规则增大、实性占位、黏膜中断或消失、内含光斑或光条有较强的诊断价值,对部分Ⅰb期及以上宫颈癌,子宫颈有明显形态学改变的患者可作出 明确诊断。早期宫颈癌超声检查不易发现,超声检查对有无宫旁浸润及淋巴结转移的判断帮助不大。一项对111例Ⅰa~Ⅲa期宫颈癌患者进行术前超声检查及术后病理检查的对照研究表明,超声对宫颈癌的诊断并不优于临床妇科检查,而在术后经病理学证实的11例复发患者中,超声检查发现的仅有1例[1]。经阴道或直肠超声检查因位置与宫颈更为接近,能更直观地显示宫颈内口或肌层的病变,从而使其对宫颈癌诊断的符合率明显高于经腹超声检查[2]。
二维超声多普勒能够检测宫颈及其肿瘤的血流信号,对以往认为超声无阳性发现的早期宫颈癌可在宫颈内不均匀区中发现点状血流信号,中晚期宫颈癌则有其较为特征性的图像表现,还有部分病例可见其他脏器转移及腹盆腔淋巴结肿大图像。三维彩色多普勒能量超声可以发现微小血管、低速度血流,显示实质器官的血管立体分布,可全面了解肿瘤血流的空间分布及血流灌注,对宫颈癌的诊断有较大帮助,提高了宫颈癌术前分期的准确率,对浸润性宫颈癌病变范围的术前判断符合率高。同时,三维超声检查也被广泛应用于宫颈癌放化疗疗效的评价及术后复发的监测。
总之,超声因其价廉、简便、迅速、无创、无辐射、可连续动态及重复检查的优势,在妇科领域起着举足轻重的作用,尤其是三维彩色多普勒能量超声和超声造影的使用,提高了超声检查对宫旁组织和淋巴结浸润诊断的灵敏度。然而,超声检查也存在着以下不足:①检查组织分辨率低,不能很好地显示肿瘤和周边正常组织的分界,无法鉴别宫旁浸润与炎症反应;②超声检查易受肥胖及肠道气体等因素干扰;③其与CT、MRI相比,超声检查范围小,无法对整个盆腔做全面评估。
1.2 CT诊断
由于CT对病变与周围正常宫颈组织的对比度较差,故在宫颈癌,尤其是早期宫颈癌原发灶的显示优势有限。阴道浸润是宫颈癌分期的重要因素,由于CT是横断面扫描,盆腔局部解剖复杂,子宫颈管与阴道纵轴成角但不是直角,存在部分体积效应等因素,其诊断可靠性低,常高估或低估阴道病变。宫旁浸润是区别Ⅱa和Ⅱb期的标准,更是选择治疗方案的重要依据[3]。宫旁浸润在CT显像上缺乏特异性,宫颈癌患者合并宫旁炎症时可干扰诊断结果,子宫内膜异位症结节也会影响宫旁浸润的评价。由于CT扫描常将宫旁血管或炎症误认为是宫旁浸润,常导致其诊断病变的级别升高。CT对宫旁浸润的诊断准确率不高,增强扫描、薄层扫描以及螺旋CT可以减少误诊,使CT对宫旁浸润判断的诊断准确率明显提高。宫颈癌晚期输尿管受侵,出现输尿管梗阻、肾积水或膀胱受侵犯时,CT扫描有其优越性。由于盆腔结构复杂,CT平扫对宫颈癌转移淋巴结的敏感性较差,但随着CT技术的发展,多排螺旋CT扫描为淋巴结转移的评价提供了更好的分辨条件。然而,CT对鉴别转移性淋巴结和反应增生性淋巴结仍是一个难点。CT引导下进行腔内近距离放射治疗宫颈癌,能更好地估计靶区肿瘤放疗剂量及器官的风险剂量。
CT对肿瘤复发及放化疗疗效监测也有一定的作用,但因其对软组织的分辨能力有限,且对患者有电离辐射损害,尤其是放化疗后宫旁组织纤维化,一定程度上限制了CT的应用[4]。宫颈癌CT灌注成像是指在静脉注射对比剂的同时对选定层面进行连续不断的扫描,以获得该层面内每一个体素的密度随强化时间而演变的曲线,称为时间-密度曲线。设定参数评价组织器官的灌流情况,包括:血流量、血容量、平均通过时间、峰值时间和表面通透性。肿瘤血管生成对肿瘤的生长、分级、转移、预后有重要影响,肿瘤灌注本质是研究肿瘤的血流特点,评价宫颈癌新生血管的情况,是判断宫颈癌生长、转移、良恶性及恶性程度的重要指标。利用CT灌注成像分析宫颈癌放化疗的疗效也具有重要的临床价值,当宫颈癌行放化疗后,CT灌注成像中血流参数下降不明显或较前升高时,说明治疗效果不明显或不佳,应对治疗计划进行修改或采用其他治疗方法配合。
1.3 MRI诊断
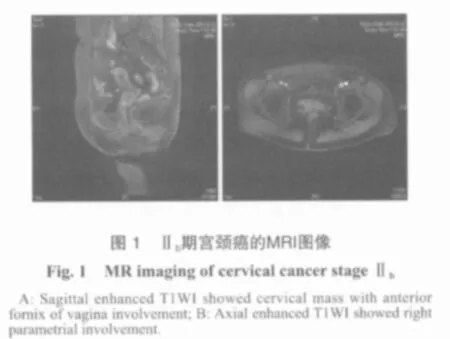
MRI对软组织分辨率高是其最大的优点,直接多断面扫描可以清晰显示宫颈、宫体、阴道及其邻近结构,优于CT单纯横断面扫描。MRI在宫颈癌的诊断和分期方面明显优于临床、超声及CT检查,具有很高的灵敏度、特异度和准确率,是目前宫颈癌诊断及分期的最佳方法(图1)。Manfredi等[5]对53例经组织学证实的早期宫颈癌患者进行MRI检查,结果表明MRI对肿瘤浸润宫颈内口和浸润阴道的准确性分别为92%和91%。Togashi等[6]对67例宫颈癌患者进行MRI检查,结果显示,MRI对浸润性宫颈癌的诊断准确率达95%,对所有分期的诊断准确率达76%。该研究结果还表明,弥散加权成像MRI具有分辨宫颈正常组织和肿瘤的能力,并能够区分肿瘤的不同组织类型,有助于早期宫颈癌的诊断。因MRI对软组织分辨率高,因此对宫颈癌宫旁浸润的诊断灵敏度、特异度和准确率显著高于CT。Togashi等[6]的研究结果显示,MRI对宫旁浸润诊断准确率达89%。Desonza等[7]所进行的一项回顾性调查研究表明,阴道线圈MRI对体积较小的宫颈癌诊断的灵敏度和特异度分别为80.0%和91.3%。而对盆腔脏器浸润如膀胱浸润,MRI诊断也同样有较高的准确率。MRI对宫颈癌淋巴结转移诊断的准确率报道不一致。Mithell等[8]进行的多中心研究表明,MRI对宫颈癌淋巴结转移的预测准确度高于CT。Desonza等[7]研究提示,阴道线圈MRI对转移淋巴结的灵敏度和特异度分别为78.6%和71.5%,与CT相同。而Manfredi等[5]的研究结果显示,MRI对宫颈癌淋巴结转移预测的灵敏度、特异度和准确率分别为28%、100%和89%。
MRI多断面扫描有助于显示盆腔,特别是阴道残端、膀胱、直肠的复发肿瘤,也可以显示盆壁复发的肿瘤。Hricak等[9]回顾分析了69例宫颈癌放疗后不同时期的MRI表现,提示肿瘤残存或复发的阳性预测值为86%,MRI在区分肿瘤或放疗后诊断组织纤维化的准确性与放疗后时间长短有关,放疗后6个月内准确率为69%,6个月以上的准确率为88%,特异度为81%。
1.4 PET/CT诊断
宫颈癌原发灶、复发和转移灶能摄取大量经静脉注射入的显像剂18F-FDG,而在病灶处出现放射性明显浓聚。PET/CT从代谢角度进行诊断,从而对肿瘤的诊断、淋巴结转移、周围浸润等方面有着更高的优越性,但其本身空间分辨率低,解剖结构显示欠佳,主要适用于预测宫颈癌复发及淋巴结转移。
2 子宫内膜癌的影像学诊断
子宫内膜癌是最常见的女性生殖道肿瘤之一,术前诊断依据宫腔组织病理,而宫腔以外包括子宫肌层、盆腹腔、腹膜后有无肿瘤浸润需术后才可以诊断。子宫内膜癌肌层浸润、浸润程度与盆腹腔淋巴转移和预后密切相关,术前诊断直接影响治疗方案的选择、临床处理及预后。
2.1 超声诊断
经腹或经阴道二维超声检查对了解宫腔占位性病灶以及子宫内膜厚度具有十分明显的优势,临床已广泛应用。超声测量子宫内膜厚度已经成为诊断内膜病变的基础。增厚的内膜提示子宫内膜癌,薄而规则的内膜患内膜癌的概率很小。多数学者赞同将阴道超声测得内膜厚度绝经期患者>5 mm,育龄期患者>10 mm作为区分内膜良恶性病变的临界值。超声检查用于子宫肌层浸润的判断,与病理诊断符合率虽然较高,但是估计肌层浸润深度的精确率相对不高,不能精确地预测肌层浸润深度,有一定局限性。
随着超声技术的发展,经阴道三维超声检查已经应用于临床,它不仅具备经阴道二维超声检查的优点,而且具备了三维成像、内膜容积测量、三维彩色多普勒能量技术,能更形象、清晰地显示内膜及肌层浸润情况,更准确地测量内膜的容积,更全面地显示内膜血流情况。阴道三维血管成像显示癌灶区血管丰富,血管走向紊乱,呈毛线球或珊瑚状。因此,基于二维超声的三维超声在诊断子宫内膜癌方面较二维超声更有优势。
2.2 CT诊断
盆腔CT诊断用于子宫内膜癌术前诊断,对于盆、腹腔的转移病灶优于超声检查,因不受体内埋植金属器影响而优于MRI检查;但其对于判断子宫肌层浸润,与超声、MRI检查比较并未显示出优势。早期内膜癌CT平扫表现为正常图像, 增强扫描时,正常子宫内膜不强化,正常肌层呈密度稍低强化,因癌肿强化程度低于邻近正常肌层而可以区分,表现为低密度肿块,边界多不清楚。由于缺乏区分内膜与肌层连接带的解剖结构,CT对肌层浸润深度的评估价值有限,但CT在确定淋巴结及远处转移方面有价值。Hardesty等[10]应用螺旋CT对25例患者进行术前分期,并与MRI分期及手术病理分期结果比较,发现CT在鉴别有无深肌层受侵犯的灵敏度(83.0%)和特异度(42.0%)均明显低于MRI(92.0%和90.0%),术前CT扫描不能准确预测肌层浸润深度。
2.3 MRI诊断
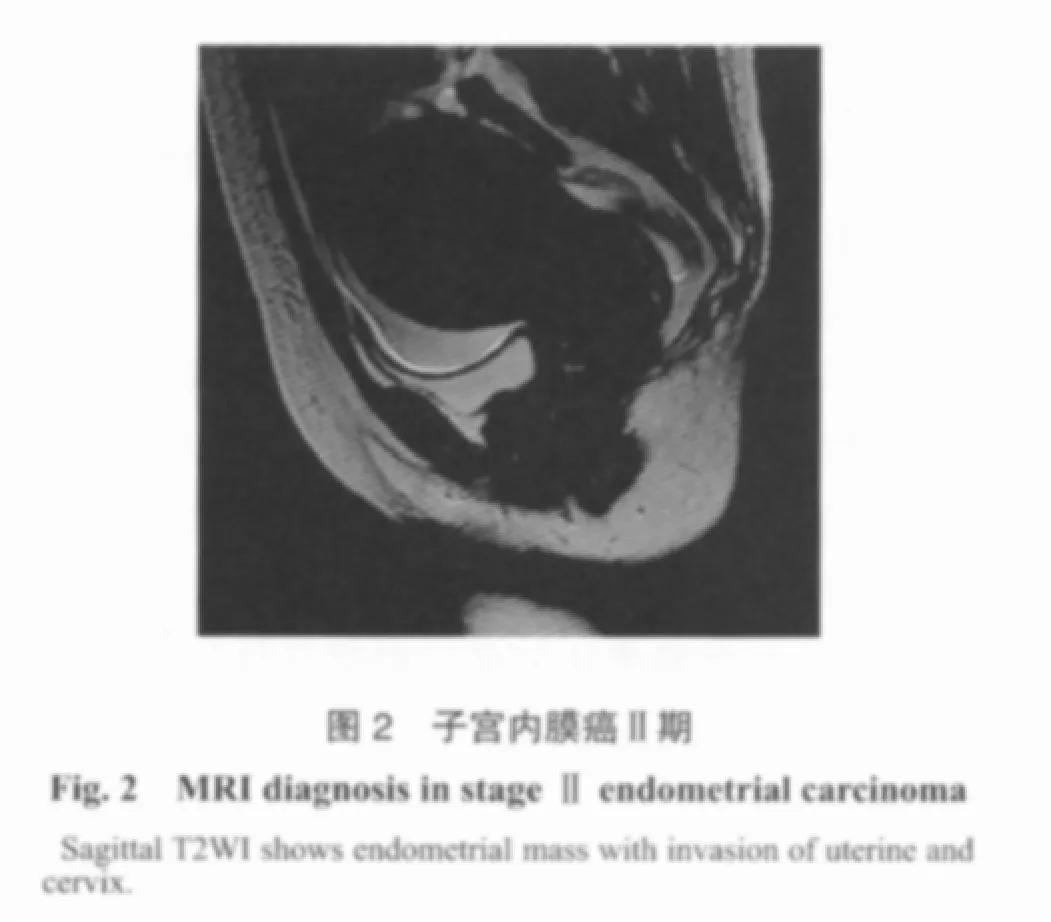
在未增强的情况下,MRI对子宫内膜癌诊断的准确率高达85%~92%,与超声诊断结果相似。国内外学者普遍认为,MRI是诊断早期子宫内膜癌及其分期最准确的影像学方法。Lubusky等[11]比较了经阴道超声检查和MRI在子宫内膜癌肌层浸润的诊断结果,其灵敏度分别为80%和84%。文献报道MRI在判断子宫内膜癌分期的准确率为87%,判断有无肌层浸润的灵敏度为93%[12]。MRI在诊断子宫内膜癌的重要价值在于对肌层浸润的判断。因此,术前行MRI检查对指导临床选择恰当的手术方式具有重要价值(图2)。
2.4 PET/CT诊断
有研究报道,PET/CT监测子宫内膜癌术后的灵敏度、特异度、阳性预测值、阴性预测值分别为96%、78%、89%和91%,认为全身PET/CT检查对于监测治疗后的内膜癌有较大价值,不仅可以发现复发病灶的准确位置,还可以发现无症状的复发病灶[13]。尚慧玲等[14]回顾性分析子宫内膜癌的术前MRI和PET/CT表现与术后病理结果,认为MRI有利于子对宫内膜癌进行术前分期;而PET/CT则有利于发现病灶,但对于术前分期意义不显著。
3 卵巢癌的影像学诊断
卵巢癌是女性生殖道肿瘤中死亡率最高的肿瘤,生存率取决于其临床分期和组织学分级,并对患者的预后起着重要作用。
3.1 超声诊断
目前,早期卵巢癌诊断的有效方法已集中在超声和肿瘤标志物的测定。超声诊断可清晰地显示盆腔脏器及病变,根据所测卵巢的大小、形态、血流和血管分布,从而发现卵巢病变。尤其经阴道超声检查,因其探头接近盆腔内的器官,能显著提高准确率。超声检查是常规的、无创性的检查方法,具有可重复性,是卵巢癌诊断中重要的影像检查手段之一。卵巢癌的二维超声表现为双侧多房、实性,外形不规则,分隔厚,多乳头,常伴腹腔积液。应用彩色血流显示功能,可发现肿块内高速低阻的动脉血,分布于肿块实质内如中央区及囊内乳头、分隔上,血管分布呈条状,树枝状甚至为团状,阻力指数多<0.4,显著提高了诊断准确率。胡萍等[15]报道,超声检测的结果准确率为72.20%,漏误诊率为13.90%,性质待定为13.90%。其中少数病例表现为单发囊性包块,或者未能发现的小病变。由此可见,超声对早期卵巢癌的诊断准确率尚低,对单发的囊性病灶不能忽视,需复查并结合其他检查结果综合分析,从而达到对卵巢癌早期诊断的目的。
3.2 CT诊断
CT诊断技术显著提高了卵巢癌的诊断准确率。目前普遍认为,CT对肿瘤的显示及术前分期明显优于超声。CT扫描能较为详细地反映肿瘤内部的形态,大小、内部细微结构,发现卵巢癌有如下特征:①肿瘤多为实性及囊实性,早期肿瘤则多为囊性,少数为囊实性;②肿瘤直径>4 cm,肿瘤壁厚度或囊腔分隔厚度>3 cm,伴壁结节,存在腹膜或盆腔浸润时可见明显的肿瘤血管,增强后扫描实性部分的影像显示明显增强。胡萍等[15]报道,CT检查结果准确率为86.10%,漏误诊率为8.30%,性质待定为5.60%。CT误诊病例均为单发性囊性肿瘤,被误诊为良性囊腺瘤,与超声对卵巢癌的早期诊断有类似的局限性。
3.3 MRI诊断
与CT相比,MRI具有多方位成像功能及良好的软组织对比分辨率,使之在盆腔病变的诊断和鉴别诊断中作用更加重要。但也存在一些问题,如良恶性肿瘤均可有明显强化,不能单纯靠强化率来判断病灶的性质。卵巢原发性肿瘤和转移瘤在MRI上的表现无显著差异,所以在诊断卵巢癌时,无论有无原发性病灶,均应与转移瘤相鉴别,进行全面细致的排查。有研究报道,MRI对卵巢癌诊断的准确率为91.79%,漏误诊率为5.60%,性质待定率为2.79%,优于CT及超声诊断[16]。
3.4 PET/CT诊断
PET/CT可用于疾病的早期发现和诊断,能更全面、准确地评价肿瘤的恶性程度,提高分期的准确性。上皮性卵巢癌经过初次手术及化疗后达到临床治愈,但仍有85%的患者在近期或远期出现复发,且复发灶多局限在腹腔内脏器表面,早期无症状,难以用常规方法检测,常被误认为完全缓解而停止治疗,因此卵巢癌的术后随访非常重要[17]。PET/CT显像能够反映肿瘤细胞代谢变化,能够在早期准确地发现卵巢癌的复发和转移,特别是对CT、MRI不易发现的部位或不易定性的软组织,如腹膜、腹腔、盆腔。尽管18F-FDG PET/CT对卵巢癌转移和复发的诊断有很大的优势,但仍存在一定的局限。这主要是因为炎性病变、肉芽肿等同样可以摄取18F-FDG,使炎症与肿瘤之间的鉴别有时很困难;另外腹部肠道、盆腔膀胱中的本底过高,也不利于病灶的显示[18]。一些新的代谢类显像剂正逐步应用于临床,相信在不久的将来PET/CT会发挥越来越重要的作用。
4 总结
综上所述,超声、CT、MRI及PET/CT对准确评价妇科肿瘤病灶、周围侵犯、淋巴结转移及远处转移十分重要,各种检查方法各有优劣。超声诊断价廉、无创、无辐射,可连续动态扫查,在妇科肿瘤的诊断、治疗上被视为常规检查。CT空间分辨率高,临床应用广泛,价格低廉,但对软组织分辨率有限,有辐射,主要应用于进展期妇科肿瘤的诊治及术后肿瘤复发及放疗效应的监控上。MRI无辐射,能多参数、多方位成像,对软组织分辨率高,空间结构清晰,且价格适中,其检查结果较少受人为因素的影响,目前是妇科肿瘤诊断、分期及制定治疗方案较好的检查方法。PET/CT技术虽对肿瘤组织、淋巴结转移及复发病灶的诊断敏感性高,但费用昂贵,尚不能视为宫颈癌诊治的常规检查项目。
[1]MAMSEN A, LEDERTONG S, HERLYCK A, et al.The possible role of ultrasound in early cervical cancer [J].Gynecol Oncol, 1995, 56 (2): 187-190.
[2]TESTA A C, LUDOVISI M, MANFREDIR, et al.Transvaginal ultrasonography and magnetic resonance imaging for assessment of presence, size andextent of invasive cervical cancer [J].Ultrasound Obstet Gynecol, 2009, 34(3): 335-344.
[3]OZARLAK O, TJALMA W, SCHEPENS E, et al.The correlation of preoperative CT, MR imaging and clinical staging (FIGO) with histopathology findings in primary cervical carcinoma [J].Eur Radiol, 2003, 1(10): 2338-2345.
[4]SHARMA D N, THULKAR S, GOYAL S, et al.Revisiting the role of computed tomographic scan and cystoscopy for detecting bladder invasion in the revised FIGO staging system for carcinoma of the uterine cervix[J].Int J Gynecol Cancer, 2010, 20 (3): 368-372.
[5]MANFREDI R, GUI B, GIORANZAN A, et al.Localized cervical cancer (stage<Ⅲb): accuracy of MR imaging in planning less extensive surgery[J].Radiol Med, 2009,114(6): 960-975.
[6]TOASHI K, NISHIMURS K, SAGOH T, et al.Carcinoma of the cervix: staging with MR imaging[J].Radiology, 2005,171: 245-251.
[7]DESOUAN M, DINA R, MCINDO E, et al.Cervical cancer:value of and endovaginal coil magnetic resonance imaging technique in detecting small volume disease and assessing parametrial extension [J].Gyncol Oncol, 2006, 102 (1):80-85.
[8]MITCHLL D G, SNYDER B, COAKLEY F, et al.Early invasive cervical cancer: MRI and CT predictors of lymphatic metastases in the Acrin 6651/GOG 183 intergroup study[J].Gynecol Oncol, 2009, 112 (1): 95-103.
[9]HRICAK H, POWELL C B, YU K K, et al.Invasive cervical carcinoma: role of MR imaging in pretreatment work upcost minimization and diagnostic efficacy analysis [J].Radiology, 1996, 198 (2): 403-409.
[10]HARDESTY L A, SUMKIN J H, HAKIM C, et al.The ability of CT to preoperatively stage endometrial carcinoma[J].AJR, 2001, 176(3): 603-606.
[11]LUBUSKY M, DZVINCUK P, PILKA R, et al.Preoperative assessment of myometrial invasion in endometrial cancer patients by ultrasonography and magnetic resonance imaging(MRI) [J].Ceska Gynekol, 2006, 71(5): 394-398.
[12]MANFREDI R, MIRK P, MARESCA G, et al.Local regional staging of endometrial carcinoma: role of MR imaging in surgical planning[J].Radiology, 2004, 231(2): 372-378.
[13]BELHOCINE T, DE BARSY C, HUSTINX R, et al.Usefulness of (18) F-FDG-PET in the post-therapy surveillance of endometrial carcinoma[J].Eur J Nucl Med Mol Imaging,2002, 29 (9): 1132-1139.
[14]尚慧玲, 李光仪, 王刚, 等.子宫内膜癌术前MRI及PET的诊断价值[J].中华妇产科临床杂志, 2004, 5(4): 271-272.
[15]胡萍, 何浩明, 刘玉, 等.超声、CT、MRI和血清CA125对卵巢癌诊断的对比分析[J].放射免疫学杂志, 2010, 23(5): 217-219.
[16]张莉.CT与MRI对女性盆腔肿块诊断能力的对比研究[J].实用医学影像杂志, 2007, 8(3): 198-199.
[17]SALA E, KATAOKA M, PANDIT-TASKAR N, et al.Recurrent ovarian cancer: use of contrast-enhanced CT and PET /CT to accurately localize tumor recurrence and to predict patients' survival[J].Radiology, 2010, 257: 125-134.
[18]PRAKASH P, CRONIN C G, BLAKE M A.Role of PET/CT in ovarian cancer[J].AJR, 2010, 194: 464-470.
