FXR1基因过表达对卵巢癌细胞生物学行为影响的初步研究
2012-05-30阳志军俸艳英张玮李力
阳志军 俸艳英 张玮 李力
广西医科大学附属肿瘤医院妇瘤科,广西 南宁 530021
本研究组前期研究,已从用卵巢上皮癌患者腹水癌细胞构建的文库中,筛选出脆性X染色体相关基因1(fragile X-related gene 1, FXR1)等6个卵巢癌相关抗原基因[1],同时卵巢上皮癌患者外周血检测FXR1抗体也明显高于卵巢良性肿瘤和正常对照[2],因而提示FXR1基因可能在卵巢癌发生发展发挥某些生物学作用,为进一步探讨FXR1基因表达与卵巢癌发生、发展的关系及临床意义,本研究组检测了不同卵巢组织中的FXR1mRNA表达并采用真核转染技术上调不表达FXR1的HO8910细胞中FXR1基因的表达,了解其对卵巢癌细胞生物学行为的影响。
1 材料和方法
1.1 临床资料
所有组织标本均采集于广西医科大学附属肿瘤医院妇瘤科收治的手术治疗患者。组织标本经手术切除后立即冻于液氮保存备用,并经病理确诊。36例卵巢癌均为上皮性癌,其中浆液性癌26例,黏液性癌7例,子宫内膜样癌2例,透明细胞癌1例;Ⅰ期7例,Ⅱ期12例,Ⅲ期17例;高分化13例,中、低分化23例。卵巢良性肿瘤15例;正常卵巢组织13例。卵巢癌患者年龄17~66岁,中位年龄46岁。卵巢良性肿瘤患者年龄14~67岁,中位年龄43.5岁,正常卵巢组织取材对照组年龄30~54岁,中位年龄45岁。
1.2 载体、菌种、细胞、cDNA模板
pEGFP-N1、pCDNA3.1真核表达质粒,购自Invitrogen公司;DH5α感受态细胞、人卵巢浆液性囊腺癌细胞系HO8910、卵巢癌cDNA模板由本研究室保存[3]。
1.3 主要试剂
TRIzol Reagent购自Invitrogen公司,Revert AidTMFirst Strand cDNA 合成试剂盒和100 bp DNA ladder购自MBI Fermentas公司,dNTP mixture(2.5 mmol/L)、25 mmol/L MgCl2溶液购自上海生工生物工程公司。Wizard®Plus Midipreps DNA提纯系统、G418购自美国Promega(北京)生物技术有限公司,无内毒素质粒大提试剂盒购自Tiangen公司,BamHⅠ、NotⅠ限制性内切酶购自美国NEB(北京吉泰生物科技有限公司),LipofectamineTM2000 Transfection reagent购自广州英韦创津生物科技有限公司,BD MatrigelTMMatrix、Fibronectin购自美国BD Biosciences(上海)有限公司。引物设计:根据GenBank应用设计软件Primer5设计引物,克隆引物加入BamHⅠ、NotⅠ酶切位点,由上海生工生物工程技术服务有限公司合成,FXR1全长克隆引物顺义链:5’-ATAAGAATGCGGCCG CCCAACATGGCGGACGTGACGGTG-3’,反义链:5’-CGCGGATCCACTGAAACACCAT T C A G G A C T G C T G-3’,产物大小为1 620 bp;表达检测引物顺义链:5’-GGCTAAA GTTCGGATGATG-3’,反义链:5’-ATGAAAA GCTGCTGCAAG-3’,产物大小为410 bp。参照基因GAPDH顺义链:5’-GAAGGTG AAGGTCGGAGT-3’,反义链:5’-GAAGATGGT GATGGGATTT- 3’,产物大小为225 bp。
1.4 方法
1.4.1 RT-PCR法检测卵巢组织中FXR1 mRNA表达
采用半定量RT-PCR法进行检测[4]。
1.4.2 pCDNA3.1/FXR1真核表达载体的构建与鉴定
以卵巢癌组织cDNA为模板,用RT-PCR法扩增FXR1基因 CDS全长,将PCR产物在琼脂糖凝胶下电泳分离,切胶回收目的DNA。将pCDNA3.1质粒、目的DNA用BamHⅠ、NotⅠ双酶切并回收,用连接酶进行连接,连接产物转化DH5α感受态细胞,转化产物在氨苄抗性LB平板筛选培养,提取质粒用BamHⅠ、NotⅠ进行酶切鉴定。送生物公司进行测序并blast比对鉴定。对阳性质粒按无内毒素质粒大提试剂盒说明书操作提取质粒,产物分装后-20 ℃保存。
1.4.3 pCDNA3.1质粒pEGFP-N1、pCDNA3.1/FXR1重组子的真核转染
毒性试验确定G418在HO8910细胞系的筛选浓度,首先采用胰酶消化指数增长期的HO8910细胞制成单细胞悬液,在细胞完全贴壁(约20%满)后按终浓度为100~1 000 μg/mL的递增浓度梯度加入G418,连续培养10~14 d,以细胞全部死亡的最小G418浓度为下一步实验的筛选浓度。
在LipofectamineTM2000的介导下,pEGFP-N1、pCDNA3.1及pCDNA3.1/FXR1的真核转染具体方法参见参考文献[5]。
1.4.4 稳定转染阳性细胞团块的筛选及鉴定
胰酶消化筛选经G418筛选剩余的散在的细胞团块,在倒置显微镜直视下用Tip头将细胞团吸出,稀释后接种在96孔板中,细胞贴壁后将单个细胞的孔标记出,用半量筛选浓度继续保持G418抗性筛选扩大培养,并经RT-PCR及蛋白质印迹法(Western blot)检测,最后冻存保种后,进行下一步的实验。稳转后细胞分别命名为pCDNA3.1及pCDNA3.1/FXR1。
1.4.5 FXR1基因对HO8910细胞生物学功能影响的检测
细胞生长曲线采用MTT法进行绘制;细胞生长周期采用流式细胞术进行分析;细胞体集落形成能力采用平板克隆形成计数法进行检测;细胞体外迁移、侵袭和黏附能力测定分别采用Transwell小室,Matrigel和细胞混合基质(粘连蛋白和胶原蛋白)黏附法,具体方法参见参考文献[3]。
1.5 统计学处理
采用SPSS 13.0软件包在计算机上进行数据的分析处理,计量资料采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各类卵巢组织中FXR1表达及与卵巢上皮癌临床病理的关系
FXR1 mRNA在卵巢癌组织中的相对表达水平比卵巢良性肿瘤组织及正常卵巢组织均高,癌组织中的表达水平与良性肿瘤组织相比,差异有统计学意义(P=0.048);癌组织中的表达水平与正常组织相比,差异有统计学意义(P=0.002 9);癌组织中的相对表达水平与非癌组织相比,差异亦有统计学意义(P=0.005);FIGO分期为Ⅰ~Ⅱ期的癌组织中FXR1 mRNA相对表达水平低于Ⅲ期,两者相比差异有统计学意义(P=0.03);高分化组织中的表达水平低于中、低分化组织,两者相比差异有统计学意义(P=0.037,表1)。
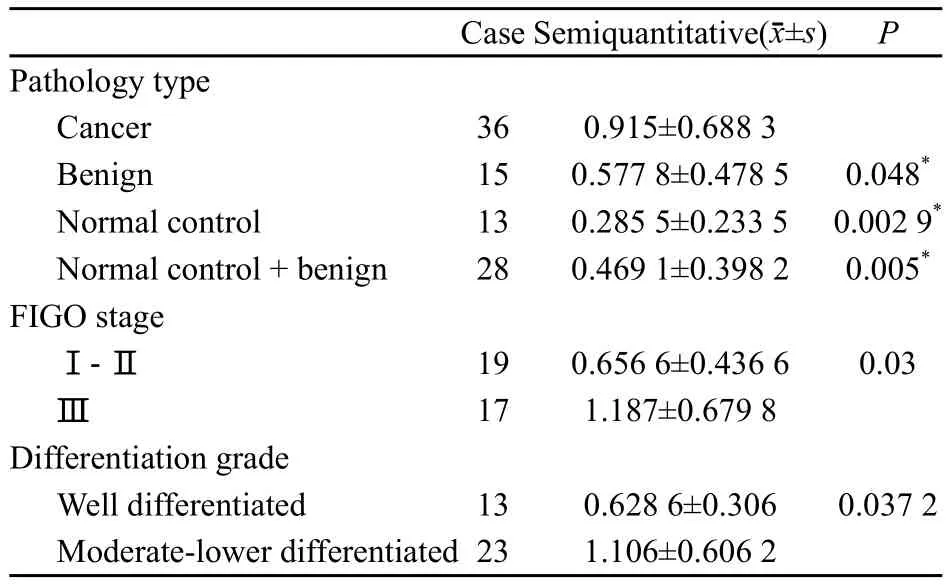
表 1 FXR1 mRNA在不同卵巢组织中的相对表达水平与卵巢上皮癌临床病理的关系Tab.1 Relative expression level of FXR1 mRNA in different ovarian tissues and related with clinical-pathology
2.2 pCDNA3.1/FXR1(OV-178)真核表达载体的构建与鉴定
重组阳性质粒经BamHⅠ、NotⅠ双酶切后有与目的片段大小吻合的基因片段(图1),经测序鉴定质粒中插入的FXR1(OV-178)序列与数据库中FXR1基因的序列进行BLAST比对,显示在第9~10位碱基上出现了无义突变GC/CG。提示成功构建pCDNA3.1/FXR1重组质粒。
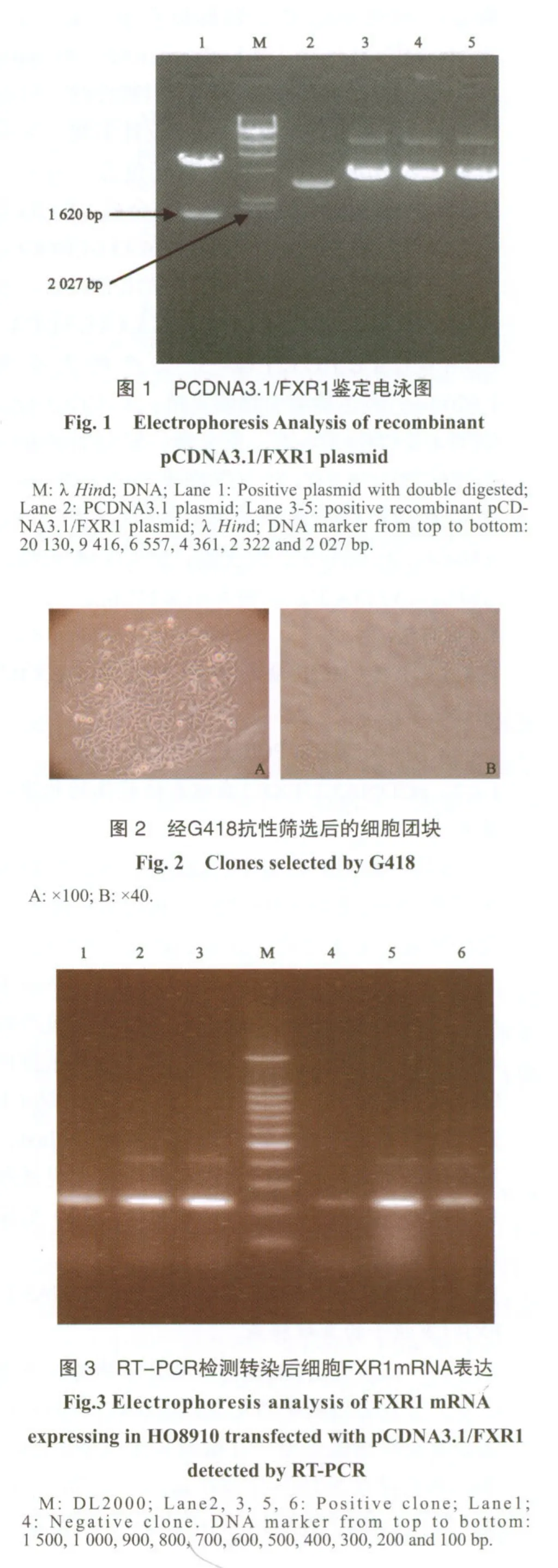
2.3 耐G418细胞团块的筛选
经毒性试验最终确定G418的筛选浓度为400 μg/mL。转染后pEGFP-N1质粒8 h后在荧光显微镜下拍照估计转染效率为30%~40%。经终浓度为400 μg/mL的G418筛选12 d,大部分细胞均死亡,仅有散在的细胞团块存活,这些细胞团块具有G418抗性(图2)。
2.4 RT-PCR法及Western blot鉴定稳定转染细胞株
将耐G418细胞团块胰酶消化、稀释后接种的单个细胞扩大培养,用RT-PCR检测了FXR1在这些克隆中的表达,结果在6个克隆中有4个克隆中FXR1的表达明显升高(图3)。并经Western blot检测到FXR1蛋白的表达(图4)。

2.6 FXR1基因对HO8910细胞平扳克隆形成能力的影响
转染pCDNA3.1/FXR1质粒后,平均克隆形成为(93.5±4.4)个,多于转染pCDNA3.1质粒后的平均克隆数[(83.5±4.0)个],差异有统计学意义(P<0.05,表2)。
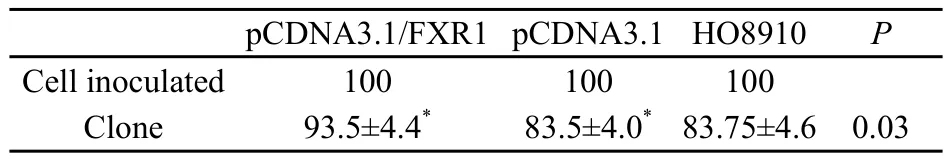
表 2 平板克隆计数Tab.2 Quantity of clone formation in plate
2.7 FXR1基因对HO8910细胞的细胞周期的影响
流式细胞术分析的细胞周期结果显示,与转染空载质粒细胞(83%)相比转染FXR1基因后G1期细胞比例明显减少(67.1%),而S期及G2期细胞数量相对增多(表3)。
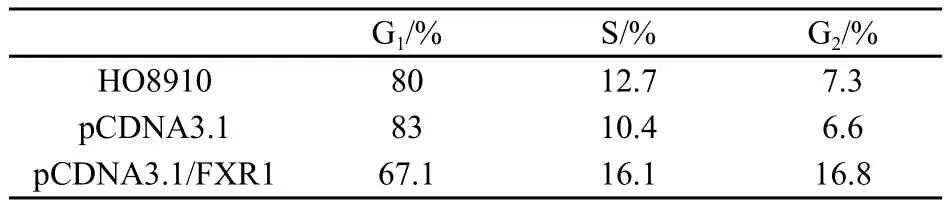
表 3 FXR1基因对HO8910细胞周期的影响Tab.3 Cell cycle of HO8910 after transfected
2.8 FXR1基因对HO8910细胞体外侵袭能力及迁移能力的影响
经DAPI染色后在荧光显微镜发现能降解Matrigel穿过膜的细胞数不多。转染FXR1基因与转染空载体相比,穿过滤膜的细胞数差异无统计学意义(P>0.05,表4)。
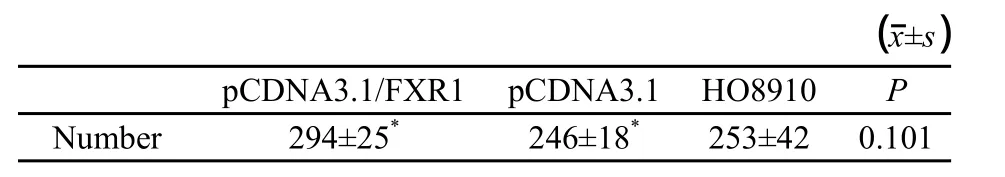
表 4 FXR1对HO8910体外细胞侵袭能力的影响Tab.4 Quantity of cell invasion
FXR1基因对HO8910细胞体外迁移能力的影响,与转染空载质粒细胞相比,转染FXR1基因的细胞穿过滤膜的相对细胞数相当(表5)。

表 5 FXR1对HO8910细胞体外迁移能力的影响Tab.5 Relative quantity of cell migration
2.8 FXR1基因对HO8910细胞基质黏附试能力的影响
转染pCDNA3.1/FXR1质粒后细胞对基质相对黏附能力比转染pCDNA3.1质粒的细胞要强,差异有统计学意义(P<0.05,表6)。

表 6 FXR1对HO8910细胞黏附能力的影响Tab.6 Relative ratio of cell adhesion
3 讨 论
FXR1是脆性X智力迟钝相关基因家族中的一员,该家族基因均有RNA绑定,与多聚核糖体相关,在核与细胞质间穿梭的生理功能。FXR1与大部分核糖体60S亚单位有关[6]。同时FXR1 3’-UTRS的富含AU元件(AREs)是对转录后有很强调节能力的信号,可影响mRNA的稳定和翻译,并可明显改变基因表达产生不同的临床及分化后果。因此FXR1具有细胞生长依赖的翻译活性功能[7]。FXR1在凋亡细胞中从细胞质中原来与核糖体相关的结合部位发生移动,并形成一些类似于典型的水泡样细胞器,认为正是这种定位上的改变及细胞凋亡过程中蛋白酶对FXR1进行裂解,使一些原来隐藏的抗原表位显露出来是引起机体免疫反应的原因[8]。Comtesse等[9]用芯片技术对鳞状细胞癌中3q25-28区域直接或间接与翻译起始有关基因在表达模式进行分析,结果发现位于扩增区域中心有包括FXR1在内的3个基因在鳞状细胞癌中有很高的过表达率,而与真核翻译起始因子4A1、4B2等在所有肺癌标本中均过表达,这提示FXR1对翻译活性的调节功能可能与细胞癌变有关。本研究在卵巢癌组织中亦检测到FXR1的表达明显高于良性肿瘤及正常卵巢组织,并且与临床期别及组织分化程度相关。可能FXR1在卵巢癌组织中的高表达与卵巢癌细胞的恶性转化过程中加强RNA转运,提高细胞翻译活性有关。
本研究采用基因克隆的方法成功构建了FXR1真核表达载体,用传统的基因替代技术将FXR1基因的真核表达载体稳定转染卵巢癌细胞系,使不表达FXR1基因的HO8910细胞系高表达,研究FXR1对HO8910生物学功能的影响。研究结果发现,FXR1基因可促进卵巢癌细胞的生长及增殖,这也证实了FXR1具有细胞生长依赖的翻译活性功能,这种翻译活性可能对细胞的生长增殖起正向调节作用。基质黏附实验提示上调FXR1基因可加强细胞对基质的黏附能力,而RT-PCR检测结果发现临床分期Ⅲ期的卵巢癌组织中FXR1基因的表达明显高于早期癌组织,可能 FXR1上调表达可促进细胞的黏附而利于病变进展有关;同时,研究发现FXR1对细胞侵袭、迁移的能力无明显影响,细胞的侵袭、转移是一个复杂、多因素参与的过程,细胞对基质的黏附只是其中的一个环节,有关FXR1基因与卵巢细胞侵袭转移的关系需进一步证实。流式细胞周期检测亦发现与对照相比,转染FXR1基因的细胞G1期细胞比例明显减少,这说明转染FXR1后细胞的增殖更旺盛,上调FXR1基因可促进卵巢癌细胞的增殖,与生长曲线及克隆形成实验的结果相吻合。这一结果只是从上调FXR1基因的表达得出的,还需从下调FXR1基因的表达来反向确证。
[1]阳志军, 杨光, 蒋燕明, 等.卵巢上皮性癌相关抗原的筛选和血清学检测[J].中华妇产科杂志, 2007, 42(12): 834-839.
[2]阳志军, 杨光, 蒋燕明, 等.血清中肿瘤相关抗原自身抗体谱与CA125联合检测在卵巢恶性肿瘤诊断及病情监测中的价值[J].中华妇产科杂志, 2011, 46(2): 113-118.
[3]赵冰冰, 张玮, 王琪, 等.TIZ基因过表达对卵巢上皮癌细胞生物学特性的影响[J].肿瘤, 2012, 32(1): 21-26.
[4]阳志军, 俸艳英, 李力, 等.卵巢上皮性癌相关抗原基因FXR1的表达及其临床价值[J].广西医科大学学报,2011, 28(2): 276-277.
[5]王素梅, 李力, 张玮, 等.组织蛋白酶L基因与卵巢上皮性癌细胞侵袭及转移的关系[J].中华妇产科杂志, 2010,45(8): 598-602.
[6]SIOMI M C, ZHANG Y, SIOMI H, et al.Specific sequences in the fragile X syndrome protein FMR1 and the FXR proteins mediate their binding to 60S ribosomal subunits and the interactions among them[J].Mol Cell Biol, 1996, 16(7):3825-3832.
[7]BOLIVAR J, GUELMAN S, IGLESIAS C, et al.The fragile-X-related gene FXR1 is a human autoantigen processed during apoptosis[J].J Biol Chem, 1998, 273(27): 17122-17127.
[8]CASCIOLA-ROSEN L A, ANHALT G J, ROSEN A.DNA-dependent protein kinase is one of a subset of autoantigens specifically cleaved early during apoptosis[J].J Exp Med,1995, 182(6): 1625-1634.
[9]COMTESSE N, KELLER A, DIESINGER I, et al.Frequent overexpression of the genes FXR1, CLAPM1 and EIF4G located on amplicon 3q26-27 in squamous cell carcinoma of the lung[J].Int J Cancer, 2007, 120(12): 2538-2544.
